Screening med høj kapacitet af mikrobielle isolater med indvirkning på Caenorhabditis elegans sundhed
Summary
Tarmmikrober kan positivt eller negativt påvirke deres værts sundhed via specifikke eller konserverede mekanismer. Caenorhabditis elegans er en bekvem platform til at screene for sådanne mikrober. Den nuværende protokol beskriver screening med høj kapacitet af 48 bakterieisolater for indvirkning på nematodestressresistens, der anvendes som en proxy for ormsundhed.
Abstract
Med sin lille størrelse, korte levetid og lette genetik tilbyder Caenorhabditis elegans en bekvem platform til at studere virkningen af mikrobielle isolater på værtsfysiologi. Det fluorescerer også i blåt, når det dør, hvilket giver et bekvemt middel til at lokalisere døden. Denne egenskab er blevet udnyttet til at udvikle high-throughput label-fri C. elegans overlevelse assays (LFASS). Disse involverer time-lapse fluorescensregistrering af ormepopulationer sat i multiwell-plader, hvorfra populationens mediantid for død kan udledes. Denne undersøgelse anvender LFASS-tilgangen til at screene flere mikrobielle isolater på én gang for virkningerne på C. elegans modtagelighed for svær varme og oxidative belastninger. En sådan mikrobiel screeningspipeline, som især kan bruges til at præscreene probiotika, ved hjælp af alvorlig stressresistens som en proxy for værtssundhed, rapporteres her. Protokollen beskriver, hvordan man dyrker både C. elegans tarmmikrobiota-isolatsamlinger og synkrone ormpopulationer i multiwell-arrays, før de kombineres til assays. Eksemplet dækker test af 47 bakterieisolater og en kontrolstamme på to ormestammer i to stressassays parallelt. Tilgangspipelinen er imidlertid let skalerbar og anvendelig til screening af mange andre modaliteter. Det giver således en alsidig opsætning til hurtigt at undersøge et multiparametrisk landskab af biologiske og biokemiske forhold, der påvirker C. elegans sundhed.
Introduction
Den menneskelige krop har anslået 10-100 billioner levende mikrobielle celler (bakterier, arkæa svampe), som primært findes i tarm-, hud- og slimhindemiljøerne1. I en sund tilstand giver disse fordele for deres vært, herunder vitaminproduktion, modning af immunsystemet, stimulering af medfødte og adaptive immunresponser på patogener, regulering af fedtstofskifte, modulering af stressresponser og mere med indvirkning på vækst og udvikling, sygdomsdebut og aldring 2,3,4,5 . Tarmens mikrobiota udvikler sig også betydeligt gennem hele livet. Den mest drastiske udvikling forekommer i barndommen og den tidlige barndom6, men betydelige ændringer forekommer også med alderen, herunder et fald i overflod af Bifidobacterium og en stigning i Clostridium, Lactobacillus, Enterobacteriaceae og Enterococcus arter7. Livsstil kan yderligere ændre tarmens mikrobielle sammensætning, hvilket fører til dysbiose (tab af gavnlige bakterier, overvækst af opportunistiske bakterier), hvilket resulterer i forskellige patologier såsom inflammatorisk tarmsygdom, diabetes og fedme5, men også bidrager til Alzheimers og Parkinsons sygdomme 8,9,10,11.
Denne erkendelse har kritisk bidraget til at forfine begrebet tarm-hjerneakse (GBA), hvor interaktioner mellem tarmfysiologi (nu inklusive mikroberne i den) og nervesystemet betragtes som den vigtigste regulator for dyremetabolisme og fysiologiske funktioner12. Imidlertid er mikrobiotaens præcise rolle i tarm-hjerne-signalering og de tilhørende virkningsmekanismer langt fra fuldt ud forstået13. Da tarmmikrobiota er en vigtig determinant for sund aldring, er hvordan bakterier modulerer aldringsprocessen blevet genstand for intens forskning og kontrovers 6,14,15.
Med demonstrationen af, at rundorm Caenorhabditis elegans er vært for en bonafide tarmmikrobiota domineret – som i andre arter – af Bacteroidetes, Firmicutes og Actinobacteria 16,17,18,19,20, dens hurtige stigning som en eksperimentel platform til at studere vært-tarm kommensale interaktioner 21,22,23,24 ,25,26 har udvidet vores efterforskningsarsenal betydeligt26,27,28,29. Især kan eksperimentelle tilgange med høj kapacitet, der er tilgængelige for C. elegans til at studere gen-diæt, gen-lægemiddel, genpatogen osv. interaktioner, tilpasses til hurtigt at undersøge, hvordan bakterieisolater og cocktails påvirker C. elegans sundhed og aldring.
Den nuværende protokol beskriver en eksperimentel pipeline til straks at screene arrays af bakterielle isolater eller blandinger sat i multiwell plader for virkninger på C. elegans stressresistens som en proxy for sundhed, som kan bruges til at identificere probiotika. Den beskriver, hvordan man dyrker store ormepopulationer og håndterer bakterielle arrays i 96- og 384-brønds pladeformater, før orme behandles til automatiseret stressresistensanalyse ved hjælp af en fluorescenspladelæser (figur 1). Tilgangen er baseret på etiketfri automatiserede overlevelsesanalyser (LFASS)30 , der udnytter fænomenet dødsfluorescens31, hvorved døende orme producerer et udbrud af blå fluorescens, der kan bruges til at lokalisere dødstidspunktet. Blå fluorescens udsendes af glucosylestere af anthranilsyre opbevaret i C. elegans tarmgranulat (en type lysosomrelateret organel), som brister, når en nekrotisk kaskade udløses i ormens tarm ved død31.
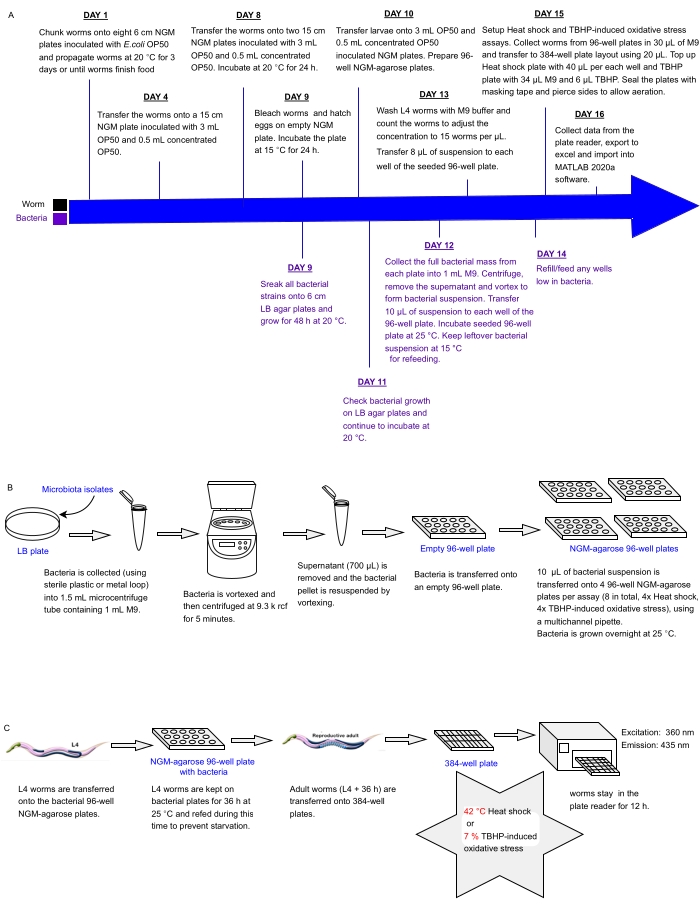
Figur 1: Eksperimentel arbejdsgang for high-throughput screening af bakterieisolater med indvirkning på C. elegans modstandsdygtighed over for stress . (A) Tidslinje for orm og bakteriel vedligeholdelse og assay opsætning. (B) 96-brønds bakteriel pladearray opsætning og håndtering. (C) opsætning af 384-brønds ormplade. Klik her for at se en større version af denne figur.
Protocol
Representative Results
Discussion
C. elegans tilbyder mange fordele ved hurtig screening af flere eksperimentelle parametre på én gang på grund af dens lille størrelse, gennemsigtighed, hurtige udvikling, korte levetid, billighed og lette håndtering. Dens betydeligt enklere genom, kropsplan, nervesystem, tarm og mikrobiom, men alligevel kompleks og ligner mennesker, gør det til en kraftfuld præklinisk model, hvor mekanistisk indsigt kan opnås, mens man tester for bioaktiv effekt eller toksicitet. Da interessen vokser for at udvikle mikro…
Declarações
The authors have nothing to disclose.
Acknowledgements
Vi takker CGC Minnesota (Madison, USA, NIH – P40 OD010440) for at levere ormestammer og OP50 og Pr. Hinrich Schulenburg (CAU, Kiel, Tyskland) for at levere alle de miljømæssige mikrobielle isolater, der er afbildet her. Dette arbejde blev finansieret af et UKRI-BBSRC-tilskud til AB (BB/S017127/1). JM er finansieret af et Lancaster University FHM ph.d.-stipendium.
Materials
| 10 cm diameter plates (Non-vented) | Fisher Scientific | 10720052 | Venting is not necessary for bacterial cultures |
| 15 cm diameter plates (Vented) | Fisher Scientific | 168381 | |
| 384-well black, transparent flat bottom plates | Corning | 3712 or 3762 | Not essential to be sterile for fast stress assays |
| 6 cm diameter plates (Vented) | Fisher Scientific | 150288 | Venting is necessary for worm cultures to avoid hypoxia |
| 96-well transparent plates (Biolite) | Thermo | 130188 | |
| Agar (<4% ash) | Sigma-Aldrich | 102218041 | Good quality agar is important for the structural integrity of the culture media, to avoid worm burrowing |
| Agarose | Fisher Scientific | BP1356 | |
| Avanti Centrifuge J-26 XP | Beckman coulter | ||
| Bleach | Honeywell | 425044 | |
| Calcium chloride | Sigma-Aldrich | C5080 | |
| Centrifuge 5415 R | Eppendorf | ||
| Centrifuge 5810 R | Eppendorf | ||
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB agar | Difco | 240110 | |
| LB broth | Invitrogen | 12795084 | |
| LoBind tips | VWR | 732-1488 | Lo-bind reduce worm loss during transfers |
| LoBind tubes | Eppendorf | 22431081 | |
| Magnesium sulfate | Fisher Scientific | M/1100/53 | |
| Plate reader- infinite M nano+ | Tecan | Monochromator setup enables fluorescence tuning but adequate filter-based setups may be used | |
| Plate reader- Spark | Tecan | ||
| Potassium phosphate monobasic | Honeywell | P0662 | |
| Sodium chloride | Sigma-Aldrich | S/3160/63 | |
| Stereomicroscope setup with transillumination base | Leica | MZ6, or M80 | Magnification from 0.6-0.8x up to 40-60x is necessary, as is a good quality transillumination base with a deformable, titable or slidable mirror to adjust contrast |
| t-BHP (tert-Butyl hydroperoxide) | Sigma-Aldrich | 458139 | |
| Transparent adhesive seals Nunc | Fisher Scientific | 101706871 | It is important that it is transparent and that it can tolerate the temperatures involved in the assays. |
| Tryptophan | Sigma-Aldrich | 1278-7099 | |
| Yeast extract | Fisher Scientific | BP1422 |
Referências
- Krishna, S., et al. Integrating microbiome network: establishing linkages between plants, microbes and human health. The Open Microbiology Journal. 13, 330-342 (2019).
- Amon, P., Sanderson, I. What is the microbiome. Archives of Disease in Childhood – Education & Practice Edition. 102 (5), 257-260 (2017).
- Belkaid, Y., Harrison, O. J. Homeostatic immunity and the microbiota. Immunity. 46 (4), 562-576 (2017).
- Cabreiro, F., Gems, D. Worms need microbes too: microbiota, health and aging in Caenorhabditis elegans. EMBO Molecular Medicine. 5 (9), 1300-1310 (2013).
- Vaga, S., et al. Compositional and functional differences of the mucosal microbiota along the intestine of healthy individuals. Scientific Reports. 10 (1), 14977 (2020).
- Nagpal, R., et al. Gut microbiome and aging: Physiological and mechanistic insights. Nutrition and Healthy Aging. 4 (4), 267-285 (2018).
- Mitsuoka, T. Establishment of intestinal bacteriology. Biosci Microbiota Food Health. 33 (3), 99-116 (2014).
- Bonfili, L., et al. Microbiota modulation as preventative and therapeutic approach in Alzheimer’s disease. The FEBS Journal. 288 (9), 2836-2855 (2021).
- Vendrik, K. E. W., et al. Fecal microbiota transplantation in neurological disorders. Frontiers in Cellular and Infection Microbiology. 10, 98 (2020).
- Wang, Q., et al. The role of gut dysbiosis in Parkinson’s disease: mechanistic insights and therapeutic options. Brain. 144 (9), 2571-2593 (2021).
- Zhu, X., et al. The relationship between the gut microbiome and neurodegenerative diseases. Neuroscience Bulletin. 37 (10), 1510-1522 (2021).
- Miller, I. The gut-brain axis: historical reflections. Microbial Ecology in Health and Disease. 29 (1), 1542921 (2018).
- Foster, J. A., Rinaman, L., Cryan, J. F. Stress & the gut-brain axis: Regulation by the microbiome. Neurobiology of Stress. 7, 124-136 (2017).
- Coman, V., Vodnar, D. C. Gut microbiota and old age: Modulating factors and interventions for healthy longevity. Experimental Gerontology. 141, 111095 (2020).
- Conway, J., Duggal, N. A. Ageing of the gut microbiome: Potential influences on immune senescence and inflammageing. Ageing Research Reviews. 68, 101323 (2021).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10 (8), 1998-2009 (2016).
- Dirksen, P., et al. CeMbio – The Caenorhabditis elegans Microbiome Resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: gateway to a new host-microbiome model. BMC Biology. 14, 38 (2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Felix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Zimmermann, J., et al. The functional repertoire contained within the native microbiota of the model nematode Caenorhabditis elegans. The ISME Journal. 14 (1), 26-38 (2020).
- Dinic, M., et al. Host-commensal interaction promotes health and lifespan in Caenorhabditis elegans through the activation of HLH-30/TFEB-mediated autophagy. Aging. 13 (6), 8040-8054 (2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against alpha-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Hacariz, O., Viau, C., Karimian, F., Xia, J. The symbiotic relationship between Caenorhabditis elegans and members of its microbiome contributes to worm fitness and lifespan extension. BMC Genomics. 22 (1), 364 (2021).
- Shin, M. G., et al. Bacteria-derived metabolite, methylglyoxal, modulates the longevity of C. elegans through TORC2/SGK-1/DAF-16 signaling. Proceedings of the National Academy of Sciences of the United States of America. 117 (29), 17142-17150 (2020).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Zhang, F., et al. High-throughput assessment of changes in the Caenorhabditis elegans gut microbiome. Methods in Molecular Biology. 2144, 131-144 (2020).
- Chan, J. P., et al. Using bacterial transcriptomics to investigate targets of host-bacterial interactions in Caenorhabditis elegans. Scientific Reports. 9 (1), 5545 (2019).
- Hartsough, L. A., et al. Optogenetic control of gut bacterial metabolism to promote longevity. Elife. 9, 56849 (2020).
- Pryor, R., et al. Host-microbe-drug-nutrient screen identifies bacterial effectors of Metformin therapy. Cell. 178 (6), 1299-1312 (2019).
- Benedetto, A., et al. New label-free automated survival assays reveal unexpected stress resistance patterns during C. elegans aging. Aging Cell. 18 (5), 12998 (2019).
- Coburn, C., et al. Anthranilate fluorescence marks a calcium-propagated necrotic wave that promotes organismal death in C. elegans. PLOS Biology. 11 (7), 1001613 (2013).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Naomi, R., et al. Probiotics for Alzheimer’s disease: a systematic review. Nutrients. 14 (1), 20 (2021).
- Zheng, S. Y., et al. Potential roles of gut microbiota and microbial metabolites in Parkinson’s disease. Ageing Research Reviews. 69, 101347 (2021).
- Gill, M. S., Olsen, A., Sampayo, J. N., Lithgow, G. J. An automated high-throughput assay for survival of the nematode Caenorhabditis elegans. Free Radical Biology and Medicine. 35 (6), 558-565 (2003).
- Park, H. -. E. H., Jung, Y., Lee, S. -. J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Partridge, F. A., et al. An automated high-throughput system for phenotypic screening of chemical libraries on C. elegans and parasitic nematodes. International Journal for Parasitology: Drugs and Drug Resistance. 8 (1), 8-21 (2018).
- Rahman, M., et al. NemaLife chip: a micropillar-based microfluidic culture device optimized for aging studies in crawling C. elegans. Scientific Reports. 10 (1), 16190 (2020).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: a quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Brown, A. E., Schafer, W. R. Unrestrained worms bridled by the light. Nature Methods. 8 (2), 129-130 (2011).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652 (2017).
- Jushaj, A., et al. Optimized criteria for locomotion-based healthspan evaluation in C. elegans using the WorMotel system. PLoS One. 15 (3), 0229583 (2020).
- Nambyiah, P., Brown, A. E. X. Quantitative behavioural phenotyping to investigate anaesthesia induced neurobehavioural impairment. Scientific Reports. 11 (1), 19398 (2021).
- Squiban, B., Belougne, J., Ewbank, J., Zugasti, O. Quantitative and automated high-throughput genome-wide RNAi screens in C. elegans. Journal of Visualized Experiments. (60), e3448 (2012).
- Zugasti, O., et al. Activation of a G protein-coupled receptor by its endogenous ligand triggers the innate immune response of Caenorhabditis elegans. Nature Immunology. 15 (9), 833-838 (2014).
- Zugasti, O., et al. A quantitative genome-wide RNAi screen in C. elegans for antifungal innate immunity genes. BMC Biology. 14, 35 (2016).

