High-Throughput Screening av mikrobielle isolater med innvirkning på Caenorhabditis elegans Helse
Summary
Tarmmikrober kan positivt eller negativt påvirke helsen til verten via spesifikke eller konserverte mekanismer. Caenorhabditis elegans er en praktisk plattform for å skjerme for slike mikrober. Denne protokollen beskriver høy gjennomstrømningsscreening av 48 bakterielle isolater for påvirkning på nematodestressresistens, brukt som proxy for ormhelse.
Abstract
Med sin lille størrelse, korte levetid og enkle genetikk, tilbyr Caenorhabditis elegans en praktisk plattform for å studere virkningen av mikrobielle isolater på vertsfysiologi. Det fluorescerer også i blått når du dør, og gir et praktisk middel til å finne døden. Denne egenskapen har blitt utnyttet til å utvikle high-throughput etikettfrie C. elegans overlevelsesanalyser (LFASS). Disse involverer time-lapse fluorescensregistrering av ormpopulasjoner satt i multiwellplater, hvorfra befolkningens median dødstid kan utledes. Denne studien vedtar LFASS-tilnærmingen for å skjerme flere mikrobielle isolater samtidig for effektene på C. elegans følsomhet for alvorlig varme og oksidativ stress. Slike mikrobielle screening rørledning, som spesielt kan brukes til å prescreen probiotika, ved hjelp av alvorlig stressmotstand som en proxy for vertshelse, er rapportert her. Protokollen beskriver hvordan man dyrker både C. elegans tarmmikrobiota-isolatsamlinger og synkrone ormpopulasjoner i multiwell-arrays før de kombineres for analysene. Eksemplet som er gitt dekker testing av 47 bakterieisolater og en kontrollstamme på to ormstammer, i to stressanalyser parallelt. Innflygingsrørledningen er imidlertid lett skalerbar og anvendelig for screening av mange andre modaliteter. Dermed gir det et allsidig oppsett for raskt å kartlegge et multiparametrisk landskap av biologiske og biokjemiske forhold som påvirker C. elegans helse.
Introduction
Menneskekroppen har anslagsvis 10-100 billioner levende mikrobielle celler (bakterier, archaea sopp), som primært finnes i tarm-, hud- og slimhinnemiljøer1. I en sunn tilstand gir disse fordeler for verten, inkludert vitaminproduksjon, modning av immunsystemet, stimulering av medfødte og adaptive immunresponser mot patogener, regulering av fettmetabolismen, modulering av stressresponser og mer, med innvirkning på vekst og utvikling, sykdomsutbrudd og aldring 2,3,4,5 . Tarmmikrobiotaen utvikler seg også betydelig gjennom livet. Den mest drastiske utviklingen skjer i barndom og tidlig barndom6, men signifikante endringer forekommer også med alderen, inkludert en reduksjon i Bifidobacterium overflod og en økning i Clostridium, Lactobacillus, Enterobacteriaceae og Enterococcus arter7. Livsstil kan ytterligere endre tarmens mikrobielle sammensetning som fører til dysbiose (tap av gunstige bakterier, overvekst av opportunistiske bakterier), noe som resulterer i ulike patologier som inflammatorisk tarmsykdom, diabetes og fedme5, men bidrar også til Alzheimers og Parkinsons sykdommer 8,9,10,11.
Denne erkjennelsen har kritisk bidratt til å raffinere begrepet tarm-hjerneaksen (GBA), hvor interaksjoner mellom tarmfysiologi (nå inkludert mikrober i den) og nervesystemet regnes som hovedregulator for dyremetabolisme og fysiologiske funksjoner12. Imidlertid er den nøyaktige rollen som mikrobiota i tarm-hjernesignalering og tilhørende virkningsmekanismer langt fra å bli fullt ut forstått13. Med tarmmikrobiota som en viktig determinant for sunn aldring, har hvordan bakterier modulerer aldringsprosessen blitt gjenstand for intens forskning og kontrovers 6,14,15.
Med demonstrasjonen at rundorm Caenorhabditis elegans er vert for en bonafide tarmmikrobiota dominert – som i andre arter – av Bacteroidetes, Firmicutes og Actinobacteria 16,17,18,19,20, den raske økningen som en eksperimentell plattform for å studere host-gut commensal interaksjoner 21,22,23,24 ,25,26 har betydelig utvidet vårt etterforskningsarsenal26,27,28,29. Spesielt kan eksperimentelle tilnærminger med høy gjennomstrømning som er tilgjengelige for C. elegans for å studere gen-diett, gen-stoff, genpatogen, etc. interaksjoner, tilpasses for raskt å undersøke hvordan bakterielle isolater og cocktailer påvirker C. elegans helse og aldring.
Den nåværende protokollen beskriver en eksperimentell rørledning for å skjerme samtidig arrays av bakterielle isolater eller blandinger satt i multiwell plater for effekter på C. elegans stressmotstand som en proxy for helse, som kan brukes til å identifisere probiotika. Den beskriver hvordan man kan vokse store ormpopulasjoner og håndtere bakterielle arrays i 96- og 384-brønns plateformater før behandling av ormer for automatisert stressmotstandsanalyse ved hjelp av en fluorescensplateleser (figur 1). Tilnærmingen er basert på etikettfrie automatiserte overlevelsesanalyser (LFASS)30 som utnytter fenomenet dødsfluorescens31, der døende ormer produserer et utbrudd av blå fluorescens som kan brukes til å fastslå dødstidspunktet. Blå fluorescens sendes ut av glukosylestere av anthranilinsyre lagret i C. elegans tarmgranulat (en type lysosomrelatert organell), som brister når en nekrotisk kaskade utløses i ormtarmen ved døden31.
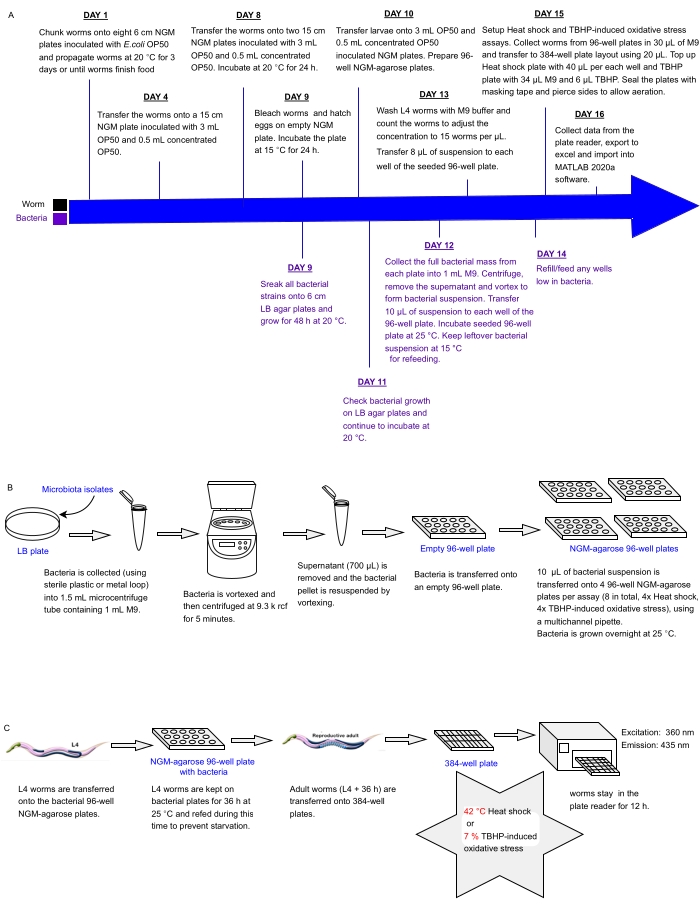
Figur 1: Eksperimentell arbeidsflyt for høy gjennomstrømningsscreening av bakterieisolater med innvirkning på C. elegans motstand mot stress . (A) Tidslinje for vedlikehold og analyse av ormer og bakterier. (B) 96-brønn bakteriell plate array oppsett og håndtering. (C) 384-brønns ormplateoppsett. Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
C. elegans tilbyr mange fordeler for rask screening av flere eksperimentelle parametere samtidig, på grunn av sin lille størrelse, gjennomsiktighet, rask utvikling, kort levetid, billighet og enkel håndtering. Dens betydelig enklere genom, kroppsplan, nervesystem, tarm og mikrobiom, men likevel kompleks og lik nok til mennesker, gjør det til en kraftig preklinisk modell, hvor mekanistisk innsikt kan oppnås under testing for bioaktiv effekt eller toksisitet. Ettersom interessen vokser for å utvikle mikrobie…
Declarações
The authors have nothing to disclose.
Acknowledgements
Vi takker CGC Minnesota (Madison, USA, NIH – P40 OD010440) for å gi ormstammer og OP50 og Pr. Hinrich Schulenburg (CAU, Kiel, Tyskland) for å gi alle de miljømessige mikrobielle isolatene som er avbildet her. Dette arbeidet ble finansiert av et UKRI-BBSRC-stipend til AB (BB / S017127/1). JM er finansiert av et Lancaster University FHM PhD-stipend.
Materials
| 10 cm diameter plates (Non-vented) | Fisher Scientific | 10720052 | Venting is not necessary for bacterial cultures |
| 15 cm diameter plates (Vented) | Fisher Scientific | 168381 | |
| 384-well black, transparent flat bottom plates | Corning | 3712 or 3762 | Not essential to be sterile for fast stress assays |
| 6 cm diameter plates (Vented) | Fisher Scientific | 150288 | Venting is necessary for worm cultures to avoid hypoxia |
| 96-well transparent plates (Biolite) | Thermo | 130188 | |
| Agar (<4% ash) | Sigma-Aldrich | 102218041 | Good quality agar is important for the structural integrity of the culture media, to avoid worm burrowing |
| Agarose | Fisher Scientific | BP1356 | |
| Avanti Centrifuge J-26 XP | Beckman coulter | ||
| Bleach | Honeywell | 425044 | |
| Calcium chloride | Sigma-Aldrich | C5080 | |
| Centrifuge 5415 R | Eppendorf | ||
| Centrifuge 5810 R | Eppendorf | ||
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB agar | Difco | 240110 | |
| LB broth | Invitrogen | 12795084 | |
| LoBind tips | VWR | 732-1488 | Lo-bind reduce worm loss during transfers |
| LoBind tubes | Eppendorf | 22431081 | |
| Magnesium sulfate | Fisher Scientific | M/1100/53 | |
| Plate reader- infinite M nano+ | Tecan | Monochromator setup enables fluorescence tuning but adequate filter-based setups may be used | |
| Plate reader- Spark | Tecan | ||
| Potassium phosphate monobasic | Honeywell | P0662 | |
| Sodium chloride | Sigma-Aldrich | S/3160/63 | |
| Stereomicroscope setup with transillumination base | Leica | MZ6, or M80 | Magnification from 0.6-0.8x up to 40-60x is necessary, as is a good quality transillumination base with a deformable, titable or slidable mirror to adjust contrast |
| t-BHP (tert-Butyl hydroperoxide) | Sigma-Aldrich | 458139 | |
| Transparent adhesive seals Nunc | Fisher Scientific | 101706871 | It is important that it is transparent and that it can tolerate the temperatures involved in the assays. |
| Tryptophan | Sigma-Aldrich | 1278-7099 | |
| Yeast extract | Fisher Scientific | BP1422 |
Referências
- Krishna, S., et al. Integrating microbiome network: establishing linkages between plants, microbes and human health. The Open Microbiology Journal. 13, 330-342 (2019).
- Amon, P., Sanderson, I. What is the microbiome. Archives of Disease in Childhood – Education & Practice Edition. 102 (5), 257-260 (2017).
- Belkaid, Y., Harrison, O. J. Homeostatic immunity and the microbiota. Immunity. 46 (4), 562-576 (2017).
- Cabreiro, F., Gems, D. Worms need microbes too: microbiota, health and aging in Caenorhabditis elegans. EMBO Molecular Medicine. 5 (9), 1300-1310 (2013).
- Vaga, S., et al. Compositional and functional differences of the mucosal microbiota along the intestine of healthy individuals. Scientific Reports. 10 (1), 14977 (2020).
- Nagpal, R., et al. Gut microbiome and aging: Physiological and mechanistic insights. Nutrition and Healthy Aging. 4 (4), 267-285 (2018).
- Mitsuoka, T. Establishment of intestinal bacteriology. Biosci Microbiota Food Health. 33 (3), 99-116 (2014).
- Bonfili, L., et al. Microbiota modulation as preventative and therapeutic approach in Alzheimer’s disease. The FEBS Journal. 288 (9), 2836-2855 (2021).
- Vendrik, K. E. W., et al. Fecal microbiota transplantation in neurological disorders. Frontiers in Cellular and Infection Microbiology. 10, 98 (2020).
- Wang, Q., et al. The role of gut dysbiosis in Parkinson’s disease: mechanistic insights and therapeutic options. Brain. 144 (9), 2571-2593 (2021).
- Zhu, X., et al. The relationship between the gut microbiome and neurodegenerative diseases. Neuroscience Bulletin. 37 (10), 1510-1522 (2021).
- Miller, I. The gut-brain axis: historical reflections. Microbial Ecology in Health and Disease. 29 (1), 1542921 (2018).
- Foster, J. A., Rinaman, L., Cryan, J. F. Stress & the gut-brain axis: Regulation by the microbiome. Neurobiology of Stress. 7, 124-136 (2017).
- Coman, V., Vodnar, D. C. Gut microbiota and old age: Modulating factors and interventions for healthy longevity. Experimental Gerontology. 141, 111095 (2020).
- Conway, J., Duggal, N. A. Ageing of the gut microbiome: Potential influences on immune senescence and inflammageing. Ageing Research Reviews. 68, 101323 (2021).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10 (8), 1998-2009 (2016).
- Dirksen, P., et al. CeMbio – The Caenorhabditis elegans Microbiome Resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: gateway to a new host-microbiome model. BMC Biology. 14, 38 (2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Felix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Zimmermann, J., et al. The functional repertoire contained within the native microbiota of the model nematode Caenorhabditis elegans. The ISME Journal. 14 (1), 26-38 (2020).
- Dinic, M., et al. Host-commensal interaction promotes health and lifespan in Caenorhabditis elegans through the activation of HLH-30/TFEB-mediated autophagy. Aging. 13 (6), 8040-8054 (2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against alpha-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Hacariz, O., Viau, C., Karimian, F., Xia, J. The symbiotic relationship between Caenorhabditis elegans and members of its microbiome contributes to worm fitness and lifespan extension. BMC Genomics. 22 (1), 364 (2021).
- Shin, M. G., et al. Bacteria-derived metabolite, methylglyoxal, modulates the longevity of C. elegans through TORC2/SGK-1/DAF-16 signaling. Proceedings of the National Academy of Sciences of the United States of America. 117 (29), 17142-17150 (2020).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Zhang, F., et al. High-throughput assessment of changes in the Caenorhabditis elegans gut microbiome. Methods in Molecular Biology. 2144, 131-144 (2020).
- Chan, J. P., et al. Using bacterial transcriptomics to investigate targets of host-bacterial interactions in Caenorhabditis elegans. Scientific Reports. 9 (1), 5545 (2019).
- Hartsough, L. A., et al. Optogenetic control of gut bacterial metabolism to promote longevity. Elife. 9, 56849 (2020).
- Pryor, R., et al. Host-microbe-drug-nutrient screen identifies bacterial effectors of Metformin therapy. Cell. 178 (6), 1299-1312 (2019).
- Benedetto, A., et al. New label-free automated survival assays reveal unexpected stress resistance patterns during C. elegans aging. Aging Cell. 18 (5), 12998 (2019).
- Coburn, C., et al. Anthranilate fluorescence marks a calcium-propagated necrotic wave that promotes organismal death in C. elegans. PLOS Biology. 11 (7), 1001613 (2013).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Naomi, R., et al. Probiotics for Alzheimer’s disease: a systematic review. Nutrients. 14 (1), 20 (2021).
- Zheng, S. Y., et al. Potential roles of gut microbiota and microbial metabolites in Parkinson’s disease. Ageing Research Reviews. 69, 101347 (2021).
- Gill, M. S., Olsen, A., Sampayo, J. N., Lithgow, G. J. An automated high-throughput assay for survival of the nematode Caenorhabditis elegans. Free Radical Biology and Medicine. 35 (6), 558-565 (2003).
- Park, H. -. E. H., Jung, Y., Lee, S. -. J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Partridge, F. A., et al. An automated high-throughput system for phenotypic screening of chemical libraries on C. elegans and parasitic nematodes. International Journal for Parasitology: Drugs and Drug Resistance. 8 (1), 8-21 (2018).
- Rahman, M., et al. NemaLife chip: a micropillar-based microfluidic culture device optimized for aging studies in crawling C. elegans. Scientific Reports. 10 (1), 16190 (2020).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: a quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Brown, A. E., Schafer, W. R. Unrestrained worms bridled by the light. Nature Methods. 8 (2), 129-130 (2011).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652 (2017).
- Jushaj, A., et al. Optimized criteria for locomotion-based healthspan evaluation in C. elegans using the WorMotel system. PLoS One. 15 (3), 0229583 (2020).
- Nambyiah, P., Brown, A. E. X. Quantitative behavioural phenotyping to investigate anaesthesia induced neurobehavioural impairment. Scientific Reports. 11 (1), 19398 (2021).
- Squiban, B., Belougne, J., Ewbank, J., Zugasti, O. Quantitative and automated high-throughput genome-wide RNAi screens in C. elegans. Journal of Visualized Experiments. (60), e3448 (2012).
- Zugasti, O., et al. Activation of a G protein-coupled receptor by its endogenous ligand triggers the innate immune response of Caenorhabditis elegans. Nature Immunology. 15 (9), 833-838 (2014).
- Zugasti, O., et al. A quantitative genome-wide RNAi screen in C. elegans for antifungal innate immunity genes. BMC Biology. 14, 35 (2016).

