Высокопроизводительный скрининг микробных изолятов с воздействием на здоровье Caenorhabditis elegans
Summary
Кишечные микробы могут положительно или отрицательно влиять на здоровье своего хозяина через определенные или сохраненные механизмы. Caenorhabditis elegans является удобной платформой для скрининга таких микробов. Настоящий протокол описывает высокопроизводительный скрининг 48 бактериальных изолятов на предмет воздействия на стрессоустойчивость нематод, используемых в качестве прокси для здоровья червей.
Abstract
Благодаря своему небольшому размеру, короткой продолжительности жизни и легкой генетике, Caenorhabditis elegans предлагает удобную платформу для изучения влияния микробных изолятов на физиологию хозяина. Он также флуоресцирует синим цветом при смерти, обеспечивая удобное средство точного определения смерти. Это свойство было использовано для разработки высокопроизводительных анализов выживания C. elegans без маркировки (LFASS). Они включают в себя покадровую флуоресцентную регистрацию популяций червей, установленных в многолуночных пластинах, из которых может быть получено медианное время смерти популяции. В настоящем исследовании используется подход LFASS для скрининга нескольких микробных изолятов одновременно на воздействие на восприимчивость C. elegans к сильным тепловым и окислительным стрессам. Такой микробный скрининговый конвейер, который, в частности, может быть использован для предварительного скрининга пробиотиков, используя сильную стрессоустойчивость в качестве прокси для здоровья хозяина, сообщается здесь. Протокол описывает, как выращивать как коллекции изолятов кишечной микробиоты C. elegans , так и синхронные популяции червей в многоязычных массивах, прежде чем комбинировать их для анализов. Приведенный пример охватывает тестирование 47 бактериальных изолятов и одного контрольного штамма на двух штаммах червей в двух параллельных анализах напряжения. Тем не менее, конвейер подходов легко масштабируется и применим к скринингу многих других модальностей. Таким образом, он обеспечивает универсальную установку для быстрого обследования многопараметрического ландшафта биологических и биохимических условий, которые влияют на здоровье C. elegans .
Introduction
Человеческое тело содержит около 10-100 триллионов живых микробных клеток (бактерий, грибов архей), которые в основном находятся в кишечнике, коже и слизистой оболочке1. В здоровом состоянии они обеспечивают преимущества для своего хозяина, включая выработку витаминов, созревание иммунной системы, стимуляцию врожденных и адаптивных иммунных реакций на патогены, регуляцию жирового обмена, модуляцию стрессовых реакций и многое другое, с влиянием на рост и развитие, начало заболевания и старение 2,3,4,5 . Микробиота кишечника также значительно развивается на протяжении всей жизни. Наиболее радикальная эволюция происходит в младенчестве и раннем детстве6, но значительные изменения также происходят с возрастом, включая снижение численности бифидобактерий и увеличение Clostridium, Lactobacillus, Enterobacteriaceae и Enterococcus видов 7. Образ жизни может еще больше изменить микробный состав кишечника, что приводит к дисбактериозу (потеря полезных бактерий, чрезмерный рост условно-патогенных бактерий), что приводит к различным патологиям, таким как воспалительные заболевания кишечника, диабет и ожирение5, но также способствует развитию болезней Альцгеймера и Паркинсона 8,9,10,11.
Это осознание критически способствовало уточнению концепции оси кишечник-мозг (GBA), где взаимодействия между физиологией кишечника (теперь включая микробы внутри него) и нервной системой считаются основным регулятором метаболизма животных и физиологических функций12. Однако точная роль микробиоты в передаче сигналов кишечником и мозгом и связанные с ней механизмы действия далеко не полностью поняты13. Поскольку микробиота кишечника является ключевым фактором, определяющим здоровое старение, то, как бактерии модулируют процесс старения, стало предметом интенсивных исследований и споров 6,14,15.
С демонстрацией того, что круглый червь Caenorhabditis elegans содержит добросовестную микробиоту кишечника, в которой преобладают, как и у других видов, Bacteroidetes, Firmicutes и Actinobacteria 16,17,18,19,20, его быстрый рост в качестве экспериментальной платформы для изучения комменсальных взаимодействий между кишечником хозяина и кишечника 21,22,23,24 ,25,26 значительно расширил наш следственный арсенал 26,27,28,29. В частности, высокопроизводительные экспериментальные подходы, доступные для C. elegans для изучения взаимодействий ген-диета, ген-лекарство, ген-патоген и т. Д., Могут быть адаптированы для быстрого изучения того, как бактериальные изоляты и коктейли влияют на здоровье и старение C. elegans.
Настоящий протокол описывает экспериментальный конвейер для одновременного скрининга массивов бактериальных изолятов или смесей, установленных в многолуночных пластинах, на предмет воздействия на стрессоустойчивость C. elegans в качестве прокси для здоровья, который может быть использован для идентификации пробиотиков. В нем подробно описывается, как выращивать большие популяции червей и обрабатывать бактериальные массивы в форматах пластин с 96 и 384 лунками перед обработкой червей для автоматизированного анализа стрессоустойчивости с использованием считывателя флуоресцентных пластин (рисунок 1). Этот подход основан на автоматизированных анализах выживания без маркировки (LFASS)30 , которые используют явление флуоресценциисмерти 31, в результате чего умирающие черви производят всплеск синей флуоресценции, который может быть использован для точного определения времени смерти. Синяя флуоресценция испускается глюкозильными эфирами антраниловой кислоты, хранящимися в кишечных гранулах C. elegans (тип органелл, связанных с лизосомами), которые лопаются, когда некротический каскад запускается в кишечнике червя после смерти31.
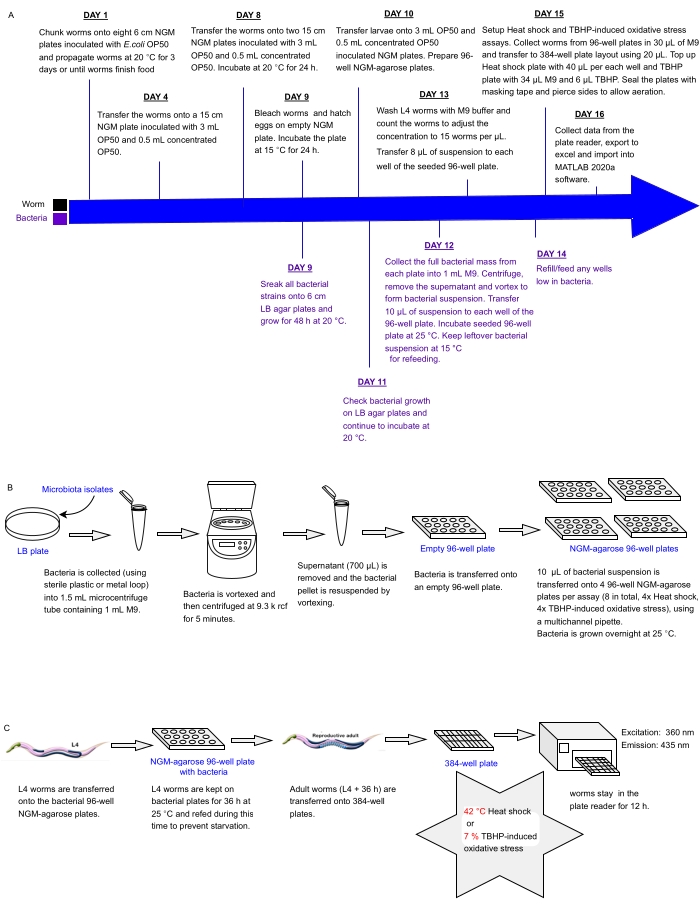
Рисунок 1: Экспериментальный рабочий процесс для высокопроизводительного скрининга бактериальных изолятов с воздействием на устойчивость C. elegans к стрессу. (A) Временная шкала для поддержания червей и бактерий и настройки анализа. (B) Установка и обработка 96-луночной бактериальной пластинчатой решетки. (C) Установка червячной пластины на 384 скважины. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Protocol
Representative Results
Discussion
C. elegans предлагает множество преимуществ для быстрого скрининга нескольких экспериментальных параметров одновременно, благодаря своим небольшим размерам, прозрачности, быстрому развитию, короткому сроку службы, недороговизне и простоте обращения. Его значительно более простой г…
Declarações
The authors have nothing to disclose.
Acknowledgements
Мы благодарим CGC Minnesota (Madison, США, NIH – P40 OD010440) за предоставление штаммов червей и OP50 и Pr. Hinrich Schulenburg (CAU, Киль, Германия) за предоставление всех экологических микробных изолятов, изображенных здесь. Эта работа финансировалась за счет гранта UKRI-BBSRC ab (BB/S017127/1). JM финансируется стипендией FHM PhD Ланкастерского университета.
Materials
| 10 cm diameter plates (Non-vented) | Fisher Scientific | 10720052 | Venting is not necessary for bacterial cultures |
| 15 cm diameter plates (Vented) | Fisher Scientific | 168381 | |
| 384-well black, transparent flat bottom plates | Corning | 3712 or 3762 | Not essential to be sterile for fast stress assays |
| 6 cm diameter plates (Vented) | Fisher Scientific | 150288 | Venting is necessary for worm cultures to avoid hypoxia |
| 96-well transparent plates (Biolite) | Thermo | 130188 | |
| Agar (<4% ash) | Sigma-Aldrich | 102218041 | Good quality agar is important for the structural integrity of the culture media, to avoid worm burrowing |
| Agarose | Fisher Scientific | BP1356 | |
| Avanti Centrifuge J-26 XP | Beckman coulter | ||
| Bleach | Honeywell | 425044 | |
| Calcium chloride | Sigma-Aldrich | C5080 | |
| Centrifuge 5415 R | Eppendorf | ||
| Centrifuge 5810 R | Eppendorf | ||
| Cholesterol | Sigma-Aldrich | C8667 | |
| LB agar | Difco | 240110 | |
| LB broth | Invitrogen | 12795084 | |
| LoBind tips | VWR | 732-1488 | Lo-bind reduce worm loss during transfers |
| LoBind tubes | Eppendorf | 22431081 | |
| Magnesium sulfate | Fisher Scientific | M/1100/53 | |
| Plate reader- infinite M nano+ | Tecan | Monochromator setup enables fluorescence tuning but adequate filter-based setups may be used | |
| Plate reader- Spark | Tecan | ||
| Potassium phosphate monobasic | Honeywell | P0662 | |
| Sodium chloride | Sigma-Aldrich | S/3160/63 | |
| Stereomicroscope setup with transillumination base | Leica | MZ6, or M80 | Magnification from 0.6-0.8x up to 40-60x is necessary, as is a good quality transillumination base with a deformable, titable or slidable mirror to adjust contrast |
| t-BHP (tert-Butyl hydroperoxide) | Sigma-Aldrich | 458139 | |
| Transparent adhesive seals Nunc | Fisher Scientific | 101706871 | It is important that it is transparent and that it can tolerate the temperatures involved in the assays. |
| Tryptophan | Sigma-Aldrich | 1278-7099 | |
| Yeast extract | Fisher Scientific | BP1422 |
Referências
- Krishna, S., et al. Integrating microbiome network: establishing linkages between plants, microbes and human health. The Open Microbiology Journal. 13, 330-342 (2019).
- Amon, P., Sanderson, I. What is the microbiome. Archives of Disease in Childhood – Education & Practice Edition. 102 (5), 257-260 (2017).
- Belkaid, Y., Harrison, O. J. Homeostatic immunity and the microbiota. Immunity. 46 (4), 562-576 (2017).
- Cabreiro, F., Gems, D. Worms need microbes too: microbiota, health and aging in Caenorhabditis elegans. EMBO Molecular Medicine. 5 (9), 1300-1310 (2013).
- Vaga, S., et al. Compositional and functional differences of the mucosal microbiota along the intestine of healthy individuals. Scientific Reports. 10 (1), 14977 (2020).
- Nagpal, R., et al. Gut microbiome and aging: Physiological and mechanistic insights. Nutrition and Healthy Aging. 4 (4), 267-285 (2018).
- Mitsuoka, T. Establishment of intestinal bacteriology. Biosci Microbiota Food Health. 33 (3), 99-116 (2014).
- Bonfili, L., et al. Microbiota modulation as preventative and therapeutic approach in Alzheimer’s disease. The FEBS Journal. 288 (9), 2836-2855 (2021).
- Vendrik, K. E. W., et al. Fecal microbiota transplantation in neurological disorders. Frontiers in Cellular and Infection Microbiology. 10, 98 (2020).
- Wang, Q., et al. The role of gut dysbiosis in Parkinson’s disease: mechanistic insights and therapeutic options. Brain. 144 (9), 2571-2593 (2021).
- Zhu, X., et al. The relationship between the gut microbiome and neurodegenerative diseases. Neuroscience Bulletin. 37 (10), 1510-1522 (2021).
- Miller, I. The gut-brain axis: historical reflections. Microbial Ecology in Health and Disease. 29 (1), 1542921 (2018).
- Foster, J. A., Rinaman, L., Cryan, J. F. Stress & the gut-brain axis: Regulation by the microbiome. Neurobiology of Stress. 7, 124-136 (2017).
- Coman, V., Vodnar, D. C. Gut microbiota and old age: Modulating factors and interventions for healthy longevity. Experimental Gerontology. 141, 111095 (2020).
- Conway, J., Duggal, N. A. Ageing of the gut microbiome: Potential influences on immune senescence and inflammageing. Ageing Research Reviews. 68, 101323 (2021).
- Berg, M., et al. Assembly of the Caenorhabditis elegans gut microbiota from diverse soil microbial environments. The ISME Journal. 10 (8), 1998-2009 (2016).
- Dirksen, P., et al. CeMbio – The Caenorhabditis elegans Microbiome Resource. G3: Genes, Genomes, Genetics. 10 (9), 3025-3039 (2020).
- Dirksen, P., et al. The native microbiome of the nematode Caenorhabditis elegans: gateway to a new host-microbiome model. BMC Biology. 14, 38 (2016).
- Samuel, B. S., Rowedder, H., Braendle, C., Felix, M. A., Ruvkun, G. Caenorhabditis elegans responses to bacteria from its natural habitats. Proceedings of the National Academy of Sciences of the United States of America. 113 (27), 3941-3949 (2016).
- Zimmermann, J., et al. The functional repertoire contained within the native microbiota of the model nematode Caenorhabditis elegans. The ISME Journal. 14 (1), 26-38 (2020).
- Dinic, M., et al. Host-commensal interaction promotes health and lifespan in Caenorhabditis elegans through the activation of HLH-30/TFEB-mediated autophagy. Aging. 13 (6), 8040-8054 (2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against alpha-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Hacariz, O., Viau, C., Karimian, F., Xia, J. The symbiotic relationship between Caenorhabditis elegans and members of its microbiome contributes to worm fitness and lifespan extension. BMC Genomics. 22 (1), 364 (2021).
- Shin, M. G., et al. Bacteria-derived metabolite, methylglyoxal, modulates the longevity of C. elegans through TORC2/SGK-1/DAF-16 signaling. Proceedings of the National Academy of Sciences of the United States of America. 117 (29), 17142-17150 (2020).
- Zhang, F., et al. Natural genetic variation drives microbiome selection in the Caenorhabditis elegans gut. Current Biology. 31 (12), 2603-2618 (2021).
- Zhang, F., et al. High-throughput assessment of changes in the Caenorhabditis elegans gut microbiome. Methods in Molecular Biology. 2144, 131-144 (2020).
- Chan, J. P., et al. Using bacterial transcriptomics to investigate targets of host-bacterial interactions in Caenorhabditis elegans. Scientific Reports. 9 (1), 5545 (2019).
- Hartsough, L. A., et al. Optogenetic control of gut bacterial metabolism to promote longevity. Elife. 9, 56849 (2020).
- Pryor, R., et al. Host-microbe-drug-nutrient screen identifies bacterial effectors of Metformin therapy. Cell. 178 (6), 1299-1312 (2019).
- Benedetto, A., et al. New label-free automated survival assays reveal unexpected stress resistance patterns during C. elegans aging. Aging Cell. 18 (5), 12998 (2019).
- Coburn, C., et al. Anthranilate fluorescence marks a calcium-propagated necrotic wave that promotes organismal death in C. elegans. PLOS Biology. 11 (7), 1001613 (2013).
- Porta-de-la-Riva, M., Fontrodona, L., Villanueva, A., Ceron, J. Basic Caenorhabditis elegans methods: synchronization and observation. Journal of Visualized Experiments. (64), e4019 (2012).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Naomi, R., et al. Probiotics for Alzheimer’s disease: a systematic review. Nutrients. 14 (1), 20 (2021).
- Zheng, S. Y., et al. Potential roles of gut microbiota and microbial metabolites in Parkinson’s disease. Ageing Research Reviews. 69, 101347 (2021).
- Gill, M. S., Olsen, A., Sampayo, J. N., Lithgow, G. J. An automated high-throughput assay for survival of the nematode Caenorhabditis elegans. Free Radical Biology and Medicine. 35 (6), 558-565 (2003).
- Park, H. -. E. H., Jung, Y., Lee, S. -. J. V. Survival assays using Caenorhabditis elegans. Molecules and Cells. 40 (2), 90-99 (2017).
- Partridge, F. A., et al. An automated high-throughput system for phenotypic screening of chemical libraries on C. elegans and parasitic nematodes. International Journal for Parasitology: Drugs and Drug Resistance. 8 (1), 8-21 (2018).
- Rahman, M., et al. NemaLife chip: a micropillar-based microfluidic culture device optimized for aging studies in crawling C. elegans. Scientific Reports. 10 (1), 16190 (2020).
- Stroustrup, N., et al. The Caenorhabditis elegans lifespan machine. Nature Methods. 10 (7), 665-670 (2013).
- Xian, B., et al. WormFarm: a quantitative control and measurement device toward automated Caenorhabditis elegans aging analysis. Aging Cell. 12 (3), 398-409 (2013).
- Brown, A. E., Schafer, W. R. Unrestrained worms bridled by the light. Nature Methods. 8 (2), 129-130 (2011).
- Churgin, M. A., et al. Longitudinal imaging of Caenorhabditis elegans in a microfabricated device reveals variation in behavioral decline during aging. Elife. 6, 26652 (2017).
- Jushaj, A., et al. Optimized criteria for locomotion-based healthspan evaluation in C. elegans using the WorMotel system. PLoS One. 15 (3), 0229583 (2020).
- Nambyiah, P., Brown, A. E. X. Quantitative behavioural phenotyping to investigate anaesthesia induced neurobehavioural impairment. Scientific Reports. 11 (1), 19398 (2021).
- Squiban, B., Belougne, J., Ewbank, J., Zugasti, O. Quantitative and automated high-throughput genome-wide RNAi screens in C. elegans. Journal of Visualized Experiments. (60), e3448 (2012).
- Zugasti, O., et al. Activation of a G protein-coupled receptor by its endogenous ligand triggers the innate immune response of Caenorhabditis elegans. Nature Immunology. 15 (9), 833-838 (2014).
- Zugasti, O., et al. A quantitative genome-wide RNAi screen in C. elegans for antifungal innate immunity genes. BMC Biology. 14, 35 (2016).

