동적 인터페이스의 공초점 현미경 시각화를 위한 마이크로텐시오미터
Summary
이 원고는 계면 형태를 시각화하면서 계면 장력과 표면 팽창 유변학을 동시에 측정하기 위해 마이크로 텐시오미터 / 공초점 현미경의 설계 및 작동을 설명합니다. 이것은 기술 및 생리학에서 중요한 인터페이스의 구조 – 속성 관계의 실시간 구축을 제공합니다.
Abstract
유체-유체 계면에 대한 표면-활성 분자의 흡착은 자연에서 유비쿼터스적이다. 이러한 계면을 특성화하려면 계면활성제 흡착률을 측정하고, 벌크 계면활성제 농도의 함수로서 평형 표면 장력을 평가하고, 평형 후 계면 영역의 변화에 따라 표면 장력이 어떻게 변하는지를 연관시켜야 합니다. 고속 공초점 현미경으로 형광 이미징을 사용하여 계면을 동시에 시각화하면 구조-기능 관계를 직접 평가할 수 있습니다. 모세관 압력 마이크로텐시오미터(CPM)에서, 반구형 기포가 1 mL 부피의 액체 저장소에서 모세관의 끝에 고정된다. 버블 인터페이스를 가로지르는 모세관 압력은 라플라스 방정식에 기초한 모델 기반 압력, 버블 곡률 또는 버블 영역 제어를 허용하는 상용 미세유체 유동 제어기를 통해 제어됩니다. Langmuir 물마루 및 펜던트 드롭과 같은 이전 기술과 비교하여 측정 및 제어 정밀도 및 응답 시간이 크게 향상되었습니다. 모세관 압력 변동을 밀리초 단위로 적용하고 제어할 수 있습니다. 버블 인터페이스의 동적 반응은 버블이 확장되고 수축함에 따라 두 번째 광학 렌즈를 통해 시각화됩니다. 버블 윤곽선은 원형 프로파일에 적합하여 버블 곡률 반경, R 및 결과를 무효화하는 원형으로부터의 편차를 결정합니다. 라플라스 방정식은 계면의 동적 표면 장력을 결정하는 데 사용됩니다. 평형 후, 컴퓨터 제어 마이크로 유체 펌프에 의해 작은 압력 진동을 부과하여 버블 반경 (0.001-100 사이클 / 분의 주파수)을 진동시켜 팽창 모듈러스를 결정할 수 있습니다 시스템의 전체 치수는 마이크로 텐시오미터가 고속 공초점 현미경의 렌즈 아래에 들어갈 정도로 충분히 작아서 형광 태그가 지정된 화학 종을 서브 미크론 측방향 분해능으로 정량적으로 추적 할 수 있습니다.
Introduction
계면활성제 필름으로 덮인 공기-물 계면은 일상 생활에서 유비쿼터스입니다. 계면 활성제 – 물 주입은 고갈 된 들판에서 오일 회수를 향상시키는 데 사용되며 셰일 가스 및 오일의 유압 파쇄 용액으로 사용됩니다. 기액 거품 및 액체 – 액체 에멀젼은 윤활유 및 세정제로서 많은 산업 및 과학 공정에 공통적이며 식품에서 일반적입니다. 계면에서의 계면활성제 및 단백질은 포장, 저장 및 투여 동안 항체 입체 형태를 안정화 1,2,3,4,5, 눈에서의 눈물막 안정성 6,7,8, 및 폐 역학9,10,11,12,13,14, 15.
계면과 그 성질에 흡착하는 표면 활성제 또는 계면활성제에 대한 연구는 많은 다른 실험 기술로 오랜 역사를 가지고 있습니다 16,17,18,19,20,21,22,23,24,25,26,27 . 최근의 개발은 모세관 압력 마이크로 텐시오미터 (CPM)로, 다른 일반적인 방법 9,23,24,25보다 훨씬 적은 재료를 사용하면서 훨씬 작은 길이 스케일에서 고도로 곡선 된 인터페이스에서 계면 특성을 검사 할 수 있습니다. 공초점 형광 현미경 (CFM)은 CPM 22 또는 Langmuir 골짜기 20,26,27,28,29의 공기 – 물 계면에서 지질 및 단백질의 형태를 연구하는 데 사용할 수 있습니다. 여기서 CPM과 CFM은 형태학적 현상을 동적 및 평형 계면 특성에 연결하여 생물학적 및 기술적 인터페이스에 대한 구조-기능 관계를 개발하기 위해 결합되었다.
CPM-CFM에 접근할 수 있는 계면 계면활성제 시스템에서 중요한 수많은 파라미터가 있다. CPM에서, 직경 30-200 μm의 기포가 유리 모세관 튜브의 팁에 고정된다. CPM의 이전 버전에서, 기포의 내부와 외부 사이의 모세관 압력 차이는 물 컬럼 및 진동 주사기 펌프 9,30을 통해 제어되었다; 여기에 설명 된 새 버전은 이들을 더 높은 정밀도의 컴퓨터 제어 마이크로 유체 펌프로 대체합니다. 표면 장력 (γ)은 펌프에 의해 설정된 계면을 가로 지르는 압력 강하, ΔP 및 기포의 곡률 반경, R의 광학 분석으로부터 라플라스 방정식 인 ΔP = 2γ / R을 통해 결정됩니다. 계면의 동적 표면 장력은 가용성 계면활성제를 함유하는 벌크 액체와 접촉하는 새로운 기포의 생성에 이어 10 ms 시간 분해능으로 결정될 수 있다. 계면활성제 흡착 역학은 확산도, 표면 커버리지, 벌크 농도와 평형 표면 장력 사이의 관계를 포함하는 계면활성제의 필수 특성을 결정하기 위해 고전적인 Ward-Tordai 방정식 10,31에 의해 설명될 수 있다. 일단 평형 표면 장력이 달성되면, 계면 영역은 진동화되어 팽창 탄성률을 측정하고, 표면 장력의 변화를 기록함으로써, 기포 표면적의 작은 변화에 의해 유도된, 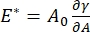 A32일 수 있다. 얽힌 중합체 또는 단백질과 같은 그들 자신의 내부 구조를 개발하는 보다 복잡한 계면의 경우, 표면 장력은, 보다 일반적인 표면 응력(4,33
A32일 수 있다. 얽힌 중합체 또는 단백질과 같은 그들 자신의 내부 구조를 개발하는 보다 복잡한 계면의 경우, 표면 장력은, 보다 일반적인 표면 응력(4,33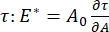 )으로 대체된다.
)으로 대체된다.
호흡 동안의 폐 안정성은 폐포 공기-액체 계면(9,10)에서 낮은 표면 장력 및 높은 팽창 모듈러스 둘 다를 유지하는 것에 직접적으로 연결될 수 있다. 모든 내부 폐 표면은 조직 수화를 유지하기 위해 상피 라이닝 유체의 연속적이고 미크론 두께의 필름으로 라이닝된다(34). 이 상피 라이닝 유체는 주로 염 및 다양한 다른 단백질, 효소, 당 및 폐 계면 활성제와 함께 물입니다. 임의의 곡선형 액체-증기 계면의 경우와 마찬가지로, 모세관 압력은 폐포(또는 버블)의 내부에서 더 높은 압력으로 유도된다. 그러나 표면 장력이 폐 내의 모든 곳에서 일정하다면 라플라스 방정식 인 ΔP = 2γ / R은 작은 폐포가 더 큰 폐포에 비해 더 높은 내부 압력을 가하여 더 작은 폐포의 가스 내용물이 더 크고 낮은 압력 폐포로 흐르게한다는 것을 보여줍니다. 이것은 “라플라스 불안정”9,35로 알려져 있습니다. 최종 결과는 가장 작은 폐포가 붕괴되어 액체로 채워지고 다시 팽창하여 폐의 일부가 붕괴되고 다른 부분이 과도하게 팽창하여 급성 호흡 곤란 증후군 (ARDS)의 전형적인 증상입니다. 그러나 제대로 기능하는 폐에서는 폐포 계면 영역의 공기 – 상피액 계면이 호흡 중에 팽창하고 수축함에 따라 표면 장력이 동적으로 변합니다. 만약, 또는 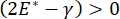 라플라스 압력이 반경이 감소함에 따라 감소하고 반경이
라플라스 압력이 반경이 감소함에 따라 감소하고 반경이 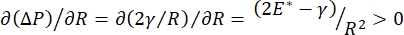 증가함에 따라 증가하여 라플라스 불안정성을 제거함으로써 폐(9)를 안정화시킨다. 따라서, 빈도,
증가함에 따라 증가하여 라플라스 불안정성을 제거함으로써 폐(9)를 안정화시킨다. 따라서, 빈도, 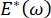 단층 형태학 및 조성, 및 폐포액 조성에 어떻게 의존하는지는 폐 안정성에 필수적일 수 있다. CPM-CFM은 또한 계면활성제 흡착(25), 단층형태학(22) 및 팽창 모듈러스(9)에 대한 계면 곡률의 효과에 대한 첫 번째 시연을 제공하였다. CPM 내의 저장소의 작은 부피(∼1 mL)는 액상의 신속한 도입, 제거 또는 교환을 허용하고, 고가의 단백질 또는 계면활성제(10)의 필요한 양을 최소화한다.
단층 형태학 및 조성, 및 폐포액 조성에 어떻게 의존하는지는 폐 안정성에 필수적일 수 있다. CPM-CFM은 또한 계면활성제 흡착(25), 단층형태학(22) 및 팽창 모듈러스(9)에 대한 계면 곡률의 효과에 대한 첫 번째 시연을 제공하였다. CPM 내의 저장소의 작은 부피(∼1 mL)는 액상의 신속한 도입, 제거 또는 교환을 허용하고, 고가의 단백질 또는 계면활성제(10)의 필요한 양을 최소화한다.
CPM-CFM 이미지에서의 콘트라스트는 계면(16,27)에서 형광 태깅된 지질 또는 단백질의 작은 분획의 분포에 기인한다. 2차원 계면활성제 단층은 종종 표면 장력 또는 표면 압력의 함수로서 측방향 상 분리를 나타내는데, 이는 깨끗한 유체-유체 계면의 표면 장력 차이이며, 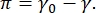 π0 및 계면활성제-피복 계면의 γ γ는 순수한 유체 표면 장력을 낮추π는 작용을 하는 계면에서의 계면활성제 분자의 상호작용에 의해 야기되는 2차원 “압력”으로 생각될 수 있다. 낮은 표면 압력에서, 지질 단일층은 액체-유사 무질서한 상태에 있고; 이것은 액체 팽창 (LE) 상으로 알려져 있습니다. 표면 압력이 증가하고 지질 분자 당 면적이 감소함에 따라, 지질은 서로 배향하고 장거리 정렬된 액체 응축 (LC) 상 16,20,27로 1차 상 전이를 겪을 수 있다. LE 및 LC 상은 다양한 표면 압력에서 공존할 수 있고, 형광 태깅된 지질이 LC 상으로부터 배제되고 LE 상으로 분리됨에 따라 가시화될 수 있다. 따라서, LE 상은 밝고 LC 상은 CFM16으로 이미징될 때 어둡다.
π0 및 계면활성제-피복 계면의 γ γ는 순수한 유체 표면 장력을 낮추π는 작용을 하는 계면에서의 계면활성제 분자의 상호작용에 의해 야기되는 2차원 “압력”으로 생각될 수 있다. 낮은 표면 압력에서, 지질 단일층은 액체-유사 무질서한 상태에 있고; 이것은 액체 팽창 (LE) 상으로 알려져 있습니다. 표면 압력이 증가하고 지질 분자 당 면적이 감소함에 따라, 지질은 서로 배향하고 장거리 정렬된 액체 응축 (LC) 상 16,20,27로 1차 상 전이를 겪을 수 있다. LE 및 LC 상은 다양한 표면 압력에서 공존할 수 있고, 형광 태깅된 지질이 LC 상으로부터 배제되고 LE 상으로 분리됨에 따라 가시화될 수 있다. 따라서, LE 상은 밝고 LC 상은 CFM16으로 이미징될 때 어둡다.
이 원고의 목표는 결합 된 공초점 현미경 마이크로 텐시오미터를 만들고 작동하는 데 필요한 단계를 설명하는 것입니다. 이를 통해 독자는 흡착 연구를 수행하고, 표면 장력, 유변학 적 행동을 측정하고, 미크론 규모의 공기 / 물 또는 오일 / 물 계면 계면에서 동시에 계면 형태를 검사 할 수 있습니다. 여기에는 필요한 모세혈관을 당기고, 자르고, 소수화하는 방법, 압력, 곡률 및 표면적 제어 모드를 사용하기 위한 지침, 그리고 마이크로텐시오미터 곡선 계면으로의 불용성 계면활성제의 계면 전달에 대한 논의가 포함된다.
Protocol
Representative Results
Discussion
결합 된 CPM / CFM은 계면 역학, 평형 및 형태를 검사하기위한 강력한 도구입니다. 이 프로토콜은 CPM/CFM으로 데이터를 얻는 데 필요한 단계를 설명합니다.
도 2는 표시된 모세관, 용매 및 열 교환을 위한 채널을 갖는 셀 설계를 도시한다. 용매 교환을위한 입구는 세포의 하단에 있어야하며 출구는 상단에 있어야하므로 교환 중에 셀이 오버플로되지 않도록해…
Declarações
The authors have nothing to disclose.
Acknowledgements
모든 공초점 현미경 이미지는 니콘 A1RHD 멀티포톤 직립 공초점 현미경을 사용하여 수득하였다. 우리는 미네소타 대학의 대학 이미징 센터에서 지원 직원, 특히 기예르모 마르크스 (Guillermo Marques)의지도와 도움을 인정합니다. 이 작업은 NIH Grant HL51177에 의해 지원되었습니다. SI는 Ruth L. Kirschstein NRSA Institutional Research Training Grant F32 HL151128의 지원을 받았다.
Materials
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ – cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL – 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
Referências
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44 (2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al., Ramachadran, A., et al. . Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. , (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., Nag, K., et al. . Surfactant Progress. , (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604 (2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. . Physical Chemistry of Surfaces, Sixth ed. , 784 (1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14 (2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115 (2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).

