Mikrotensiometer for konfektmikroskopivisualisering av dynamiske grensesnitt
Summary
Dette manuskriptet beskriver utformingen og driften av et mikrotensiometer/konfokalt mikroskop for å gjøre samtidige målinger av interfacial spenning og overflatedilatasjonsreologi mens man visualiserer interfacial morfologi. Dette gir sanntidskonstruksjon av struktur-eiendomsrelasjoner av grensesnitt som er viktige i teknologi og fysiologi.
Abstract
Adsorpsjon av overflateaktive molekyler til væskevæskegrensesnitt er allestedsnærværende i naturen. Karakterisering av disse grensesnittene krever måling av overflateaktive adsorpsjonshastigheter, evaluering av likevektsoverflatespenninger som en funksjon av bulk overflateaktiv konsentrasjon, og relatert til hvordan overflatespenningen endres med endringer i det interfaciale området etter likevekt. Samtidig visualisering av grensesnittet ved hjelp av fluorescensavbildning med et høyhastighets konfokalt mikroskop tillater direkte evaluering av strukturfunksjonsrelasjoner. I det kapillære trykkmikrotensiometeret (CPM) festes en halvkuleformet luftboble på slutten av kapillæren i et flytende reservoar på 1 ml volum. Det kapillære trykket over boblegrensesnittet styres via en kommersiell mikrofluid strømningsregulator som muliggjør modellbasert trykk, boblekurvatur eller bobleområdekontroll basert på Laplace-ligningen. Sammenlignet med tidligere teknikker som Langmuir trough og anhengsfall, er måle- og kontrollpresisjons- og responstiden sterkt forbedret; kapillære trykkvariasjoner kan påføres og kontrolleres i millisekunder. Den dynamiske responsen til boblegrensesnittet visualiseres via en annen optisk linse når boblen utvides og trekker seg sammen. Boblekonturen passer til en sirkulær profil for å bestemme boblekurvaturradiusen, R, samt eventuelle avvik fra sirkularitet som vil ugyldiggjøre resultatene. Laplace-ligningen brukes til å bestemme grensesnittets dynamiske overflatespenning. Etter likevekt kan små trykkoscillasjoner pålegges av den datastyrte mikrofluidiske pumpen for å svinge bobleradiusen (frekvenser på 0,001-100 sykluser/min) for å bestemme dilatasjonsmodulus De overordnede dimensjonene til systemet er tilstrekkelig små til at mikrotensiometeret passer under linsen til et høyhastighets konfokalt mikroskop som gjør det mulig å spore fluorescerende merkede kjemiske arter kvantitativt med submikron lateral oppløsning.
Introduction
Luftvannsgrensesnitt dekket av overflateaktive filmer er allestedsnærværende i hverdagen. Overflateaktive vanninjeksjoner brukes til å øke oljeutvinningen fra utarmede felt og brukes som hydrauliske oppsprekkingsløsninger for skifergass og olje. Gass-væske skum og væske-væske emulsjoner er felles for mange industrielle og vitenskapelige prosesser som smøremidler og rengjøringsmidler og er vanlige i mat. Overflateaktive stoffer og proteiner ved grensesnitt stabiliserer antistoffkonformasjoner under emballasje, lagring og administrasjon 1,2,3,4,5, tårefilmstabilitet i øyet 6,7,8, og lungemekanikk 9,10,11,12,13,14, 15.
Studien av overflateaktive agenter eller overflateaktive midler adsorbing til grensesnitt og deres egenskaper har en lang historie med mange forskjellige eksperimentelle teknikker 16,17,18,19,20,21,22,23,24,25,26,27 . En nylig utvikling er det kapillære trykkmikrotensiometeret (CPM), som tillater undersøkelse av interfaciale egenskaper på svært buede grensesnitt, i mye mindre lengdeskalaer, samtidig som det bruker betydelig færre materialer enn andre vanlige metoder 9,23,24,25. Confocal fluorescence mikroskopi (CFM) kan brukes til å studere morfologien til lipider og proteiner ved luft-vann grensesnitt i CPM22 eller på Langmuir troughs 20,26,27,28,29. Her er en CPM og CFM kombinert for å koble morfologiske fenomener til dynamiske og likevektsinterfaciale egenskaper for å utvikle strukturfunksjonsrelasjoner for biologiske og teknologiske grensesnitt.
Det er mange parametere av betydning i interfaciale overflateaktive systemer som er tilgjengelige for CPM-CFM. I CPM er en luftboble med en diameter på 30-200 μm festet til spissen av et glasskapillært rør. I tidligere versjoner av CPM ble kapillærtrykkforskjellen mellom innsiden og utsiden av boblen kontrollert via en vannsøyle og oscillatorisk sprøytepumpe 9,30 ; Den nye versjonen som er beskrevet her, erstatter disse med en datastyrt mikrofluidpumpe med høyere presisjon. Overflatespenningen (γ) bestemmes via Laplace-ligningen, ΔP = 2γ/R, fra trykkfallet over grensesnittet som er satt av pumpen, ΔP og optisk analyse av krumningsradiusen til boblen, R. Den dynamiske overflatespenningen til grensesnittet kan bestemmes med 10 ms tidsoppløsning etter generering av en ny boble i kontakt med en bulkvæske som inneholder et løselig overflateaktivt middel. Den overflateaktive adsorpsjonsdynamikken kan beskrives av den klassiske Ward-Tordai-ligningen10,31 for å bestemme essensielle egenskaper til overflateaktivaet, inkludert diffusivitet, overflatedekning og forholdet mellom bulkkonsentrasjon og likevektsoverflatespenning. Når en likevektsoverflatespenning er oppnådd, kan det interfaciale området oscilleres for å måle dilatasjonsmodulen, 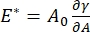 , ved å registrere endringene i overflatespenning, indusert av små endringer i bobleoverflateområdet, A32. For mer komplekse grensesnitt som utvikler sine egne indre strukturer som viklet polymerer eller proteiner, er overflatespenningen erstattet av en mer generell overflatespenning 4,33,
, ved å registrere endringene i overflatespenning, indusert av små endringer i bobleoverflateområdet, A32. For mer komplekse grensesnitt som utvikler sine egne indre strukturer som viklet polymerer eller proteiner, er overflatespenningen erstattet av en mer generell overflatespenning 4,33, 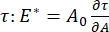 .
.
Lungestabilitet under pusten kan være direkte knyttet til å opprettholde både en lav overflatespenning og en høy dilatasjonsmodul ved alveolar luftvæskegrensesnitt 9,10. Alle indre lungeflater er foret med en kontinuerlig, mikron-tykk film av epitelforingsvæske for å opprettholde vevshydrering34. Denne epitelforingsvæsken er hovedsakelig vann, med salter og forskjellige andre proteiner, enzymer, sukker og lungeoveraktivt middel. Som det er tilfelle for et buet væskedampgrensesnitt, blir et kapillærtrykk indusert med trykket høyere på innsiden av alveolus (eller boblen). Men hvis overflatespenningen var konstant overalt i lungene, viser Laplace-ligningen, ΔP = 2γ/R, at mindre alveoli ville ha et høyere internt trykk i forhold til større alveoler, noe som tvinger gassinnholdet i den mindre alveolene til å strømme til større alveoler med lavere trykk. Dette er kjent som “Laplace Instability”9,35. Nettoresultatet er at den minste alveolen ville kollapse og bli fylt med væske og bli vanskelig å blåse opp igjen, noe som fikk en del av lungen til å kollapse, og andre deler ville overoppblåses, som begge er typiske symptomer på akutt respiratorisk nødsyndrom (ARDS). Men i en riktig fungerende lunge endres overflatespenningen dynamisk etter hvert som luftepitelvæskegrensesnittet i alveolus interfacialområdet utvides og trekkes sammen under pusten. Hvis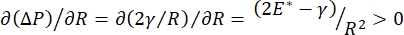 , eller
, eller 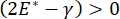 , Laplace-trykket reduseres med synkende radius og øker med økende radius for å eliminere Laplace-ustabiliteten, og dermed stabilisere lungen9. Derfor ,
, Laplace-trykket reduseres med synkende radius og øker med økende radius for å eliminere Laplace-ustabiliteten, og dermed stabilisere lungen9. Derfor , 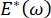 og hvordan det avhenger av frekvens, monolayer morfologi og sammensetning, og alveolarvæskesammensetning kan være avgjørende for lungestabilitet. CPM-CFM har også gitt de første demonstrasjonene av effekten av interfacial krumning på overflateaktiv adsorpsjon25, monolayer morfologi22 og dilatasjonsmodulus9. Det lille volumet (~1 ml) av reservoaret i CPM muliggjør rask innføring, fjerning eller utveksling av væskefasen og minimerer den nødvendige mengden dyre proteiner eller overflateaktive stoffer10.
og hvordan det avhenger av frekvens, monolayer morfologi og sammensetning, og alveolarvæskesammensetning kan være avgjørende for lungestabilitet. CPM-CFM har også gitt de første demonstrasjonene av effekten av interfacial krumning på overflateaktiv adsorpsjon25, monolayer morfologi22 og dilatasjonsmodulus9. Det lille volumet (~1 ml) av reservoaret i CPM muliggjør rask innføring, fjerning eller utveksling av væskefasen og minimerer den nødvendige mengden dyre proteiner eller overflateaktive stoffer10.
Kontrast i et CPM-CFM-bilde skyldes distribusjon av små brøkdeler av fluorescerende merkede lipider eller proteiner ved grensesnittet16,27. Todimensjonale overflateaktive monolayers viser ofte lateral faseseparasjon som en funksjon av overflatespenning eller overflatetrykk, 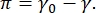 π er forskjellen mellom overflatespenningen til et rent væskevæskegrensesnitt, γ0, og et overflateaktivt dekket grensesnitt, γ. π kan tenkes som 2D-trykket forårsaket av samspillet mellom overflateaktive molekyler ved grensesnittet som virker for å senke den rene væskeoverflaten. Ved lavt overflatetrykk er lipidmonolayers i en væskelignende uorganisert tilstand; Dette er kjent som den væskeutvidede (LE) fasen. Etter hvert som overflatetrykket øker og området per lipidmolekyl reduseres, orienterer lipidene seg med hverandre og kan gjennomgå en første ordrefaseovergang til den langtrekkende bestilte væskekondenserte (LC) fase 16,20,27. LE- og LC-fasene kan eksistere sammen ved ulike overflatetrykk og kan visualiseres ettersom fluorescerende merkede lipider er utelukket fra LC-fasen og segregate til LE-fasen. Dermed er LE-fasen lys og LC-fasen er mørk når den er avbildet med CFM16.
π er forskjellen mellom overflatespenningen til et rent væskevæskegrensesnitt, γ0, og et overflateaktivt dekket grensesnitt, γ. π kan tenkes som 2D-trykket forårsaket av samspillet mellom overflateaktive molekyler ved grensesnittet som virker for å senke den rene væskeoverflaten. Ved lavt overflatetrykk er lipidmonolayers i en væskelignende uorganisert tilstand; Dette er kjent som den væskeutvidede (LE) fasen. Etter hvert som overflatetrykket øker og området per lipidmolekyl reduseres, orienterer lipidene seg med hverandre og kan gjennomgå en første ordrefaseovergang til den langtrekkende bestilte væskekondenserte (LC) fase 16,20,27. LE- og LC-fasene kan eksistere sammen ved ulike overflatetrykk og kan visualiseres ettersom fluorescerende merkede lipider er utelukket fra LC-fasen og segregate til LE-fasen. Dermed er LE-fasen lys og LC-fasen er mørk når den er avbildet med CFM16.
Målet med dette manuskriptet er å beskrive trinnene som er nødvendige for å bygge og betjene det kombinerte konfiske mikroskopmikrotensiometeret. Dette vil tillate leseren å utføre adsorpsjonsstudier, måle overflatespenning, reologisk oppførsel og undersøke interfacial morfologi samtidig på et mikronskala luft / vann eller olje / vann grensesnitt. Dette inkluderer en diskusjon om hvordan du trekker, kutter og hydrofoberer de nødvendige kapillærene, instruksjoner for bruk av trykk, krumning og kontrollmodus for overflateareal, og interfacial overføring av uoppløselig overflateaktivt middel til det mikrotensiometer buede grensesnittet.
Protocol
Representative Results
Discussion
Den kombinerte CPM/CFM er et kraftig verktøy for å undersøke interfacial dynamikk, likevekt og morfologi. Denne protokollen beskriver trinnene som er nødvendige for å hente data med CPM/CFM.
Figur 2 viser celledesignet med kanaler for kapillær-, løsningsmiddel- og varmevekslingen som er angitt. Innløpet for løsningsmiddelutveksling skal være på bunnen av cellen mens utløpet skal være øverst, slik at cellen ikke kan overløpe under utvekslingen. I pra…
Declarações
The authors have nothing to disclose.
Acknowledgements
Alle de konfokale mikroskopibildene ble oppnådd ved hjelp av Nikon A1RHD Multiphoton oppreist konfokalt mikroskop. Vi anerkjenner veiledning og hjelp fra støttepersonellet, spesielt Guillermo Marques, ved University Imaging Center ved University of Minnesota. Dette arbeidet ble støttet av NIH Grant HL51177. SI ble støttet av Ruth L. Kirschstein NRSA Institutional Research Training Grant F32 HL151128.
Materials
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ – cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL – 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
Referências
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44 (2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al., Ramachadran, A., et al. . Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. , (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., Nag, K., et al. . Surfactant Progress. , (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604 (2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. . Physical Chemistry of Surfaces, Sixth ed. , 784 (1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14 (2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115 (2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).

