Microtensiometer para Visualização de Microscopia Confocal de Interfaces Dinâmicas
Summary
Este manuscrito descreve o desenho e o funcionamento de um microscópio microtensiômetro/confocal para fazer medições simultâneas de tensão interfacial e reologia dilatacional superficial enquanto visualiza a morfologia interfacial. Isso proporciona a construção em tempo real das relações estrutura-propriedade de interfaces importantes em tecnologia e fisiologia.
Abstract
A adsorção de moléculas ativas da superfície para interfaces fluido-fluido é onipresente na natureza. Caracterizar essas interfaces requer medir as taxas de adsorção de surfactantes, avaliar as tensões superficiais de equilíbrio em função da concentração de surfactante em massa e relacionar como a tensão superficial muda com as mudanças na área interfacial após o equilíbrio. A visualização simultânea da interface usando imagens de fluorescência com um microscópio confocal de alta velocidade permite a avaliação direta das relações estrutura-função. No microtensiometer de pressão capilar (CPM), uma bolha de ar hemisférica é fixada no final do capilar em um reservatório líquido de volume de 1 mL. A pressão capilar através da interface de bolha é controlada através de um controlador de fluxo microfluido comercial que permite pressão baseada em modelo, curvatura de bolhas ou controle de área de bolha com base na equação de Laplace. Em comparação com técnicas anteriores, como o cocho Langmuir e a queda do pingente, a precisão de medição e controle e o tempo de resposta são muito aprimorados; variações de pressão capilar podem ser aplicadas e controladas em milissegundos. A resposta dinâmica da interface de bolha é visualizada através de uma segunda lente óptica à medida que a bolha se expande e contrai. O contorno da bolha é adequado a um perfil circular para determinar o raio de curvatura da bolha, R, bem como quaisquer desvios de circularidade que invalidariam os resultados. A equação de Laplace é usada para determinar a tensão dinâmica da superfície da interface. Após o equilíbrio, pequenas oscilações de pressão podem ser impostas pela bomba microfluida controlada por computador para oscilar o raio da bolha (frequências de 0,001-100 ciclos/min) para determinar o módulo dilatational As dimensões gerais do sistema são suficientemente pequenas para que o microtensiômetro se encaixe sob a lente de um microscópio confocrática de alta velocidade permitindo que espécies químicas fluorescentes marcadas sejam rastreadas quantitativamente com resolução lateral.
Introduction
Interfaces ar-água cobertas por filmes surfactantes são onipresentes no cotidiano. As injeções de água surfactante são usadas para melhorar a recuperação de óleo de campos empobrecidos e são usadas como soluções de fraturamento hidráulico para gás de xisto e óleo. Espumas gás-líquido e emulsões líquido-líquidos são comuns a muitos processos industriais e científicos como lubrificantes e agentes de limpeza e são comuns em alimentos. Surfactantes e proteínas nas interfaces estabilizam as conformações de anticorpos durante a embalagem, armazenamento e administração 1,2,3,4,5, estabilidade do filme lacrimal no olho 6,7,8 e mecânica pulmonar 9,10,11,12,13,14, 15 anos.
O estudo de agentes superanativos ou surfactantes que adsorvam interfaces e suas propriedades tem uma longa história com muitas técnicas experimentais diferentes 16,17,18,19,20,21,22,23,24,25,26,27 . Um desenvolvimento recente é o microtensiometer de pressão capilar (CPM), que permite o exame de propriedades interfaciais em interfaces altamente curvas, em escalas de comprimento muito menores, ao mesmo tempo em que utiliza significativamente menos materiais do que outros métodos comuns 9,23,24,25. A microscopia de fluorescência confocal (CFM) pode ser usada para estudar a morfologia de lipídios e proteínas nas interfaces ar-água no CPM22 ou nos cochos langmuir 20,26,27,28,29. Aqui, um CPM e CFM foram combinados para conectar fenômenos morfológicos a propriedades interfaciais dinâmicas e de equilíbrio para desenvolver relações estrutura-função para interfaces biológicas e tecnológicas.
Existem inúmeros parâmetros de importância em sistemas de surfactante interfacial acessíveis ao CPM-CFM. No CPM, uma bolha de ar de 30-200 μm de diâmetro é fixada na ponta de um tubo capilar de vidro. Nas versões anteriores do CPM, a diferença de pressão capilar entre o interior e o exterior da bolha foi controlada através de uma coluna de água e bomba de seringa oscilatória 9,30 ; a nova versão descrita aqui substitui-as por uma bomba microfluidica de maior precisão, controlada por computador. A tensão superficial (γ) é determinada através da equação de Laplace, ΔP = 2γ/R, a partir da queda de pressão através da interface definida pela bomba, ΔP, e análise óptica do raio de curvatura da bolha, R. A tensão dinâmica da superfície da interface pode ser determinada com resolução de tempo de 10 ms após a geração de uma nova bolha em contato com um líquido a granel contendo um surfactante solúvel. A dinâmica de adsorção surfactante pode ser descrita pela clássica equação Ward-Tordai10,31 para determinar propriedades essenciais do surfactante, incluindo a difusividade, a cobertura da superfície e a relação entre concentração a granel e tensão superficial de equilíbrio. Uma vez alcançada uma tensão superficial de equilíbrio, a área interfacial pode ser oscilada para medir o módulo dilatational, 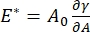 registrando as mudanças na tensão superficial, induzidas por pequenas mudanças na área da superfície da bolha, A32. Para interfaces mais complexas que desenvolvem suas próprias estruturas internas, como polímeros emaranhados ou proteínas, a tensão superficial, é substituída por um estresse superficial mais geral 4,33,
registrando as mudanças na tensão superficial, induzidas por pequenas mudanças na área da superfície da bolha, A32. Para interfaces mais complexas que desenvolvem suas próprias estruturas internas, como polímeros emaranhados ou proteínas, a tensão superficial, é substituída por um estresse superficial mais geral 4,33, 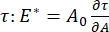 .
.
A estabilidade pulmonar durante a respiração pode estar diretamente ligada à manutenção de uma tensão superficial baixa e um módulo dilatational elevado na interface alveolar ar-líquido 9,10. Todas as superfícies pulmonares internas são forradas com uma película contínua e espessa de fluido de revestimento epitelial para manter a hidratação tecidual34. Este fluido de forro epitelial é principalmente água, com sais e várias outras proteínas, enzimas, açúcares e surfactante pulmonar. Como é o caso de qualquer interface curva de vapor líquido, uma pressão capilar é induzida com a pressão maior no interior do alvéolo (ou bolha). No entanto, se a tensão da superfície era constante em todos os lugares dentro dos pulmões, a equação de Laplace, ΔP = 2γ/R, mostra que alvéolos menores teriam uma pressão interna maior em relação aos alvéolos maiores, forçando o conteúdo gasoso dos alvéolos menores a fluir para alvéolos de menor pressão. Isso é conhecido como “Instabilidade Laplace”9,35. O resultado líquido é que os menores alvéolos entrariam em colapso e seriam preenchidos com líquido e se tornariam difíceis de reinflar causando o colapso de parte do pulmão, e outras partes inflariam demais, ambas sintomas típicos da síndrome do sofrimento respiratório agudo (ARDS). No entanto, em um pulmão em funcionamento adequado, a tensão da superfície muda dinamicamente à medida que a interface do fluido ar-epitelial na área interfacial alveolus se expande e contrai durante a respiração. Se 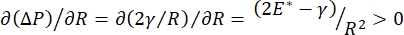 , ou
, ou 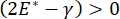 , a pressão de Laplace diminuir com o raio decrescente e aumenta com o raio crescente de modo a eliminar a instabilidade de Laplace, estabilizando assim o pulmão9. Assim,
, a pressão de Laplace diminuir com o raio decrescente e aumenta com o raio crescente de modo a eliminar a instabilidade de Laplace, estabilizando assim o pulmão9. Assim, 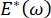 e como depende da frequência, da morfologia e composição da monocameira, e da composição do fluido alveolar pode ser essencial para a estabilidade pulmonar. O CPM-CFM também forneceu as primeiras demonstrações dos efeitos da curvatura interfacial na adsorçãosurfactante 25, morfologia monocamadas22 e módulo dilatational9. O pequeno volume (~1 mL) do reservatório no CPM permite a rápida introdução, remoção ou troca da fase líquida e minimiza a quantidade necessária de proteínas caras ou surfactantes10.
e como depende da frequência, da morfologia e composição da monocameira, e da composição do fluido alveolar pode ser essencial para a estabilidade pulmonar. O CPM-CFM também forneceu as primeiras demonstrações dos efeitos da curvatura interfacial na adsorçãosurfactante 25, morfologia monocamadas22 e módulo dilatational9. O pequeno volume (~1 mL) do reservatório no CPM permite a rápida introdução, remoção ou troca da fase líquida e minimiza a quantidade necessária de proteínas caras ou surfactantes10.
O contraste em uma imagem CPM-CFM deve-se à distribuição de pequenas frações de lipídios ou proteínas fluorescentes na interface16,27. Monocamadas surfactantes bidimensionais geralmente exibem separação de fase lateral em função da tensão superficial ou pressão da superfície, 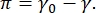 π é a diferença entre a tensão superficial de uma interface fluido-fluido limpo, γ0, e uma interface coberta de surfactante, γ. π pode ser pensado como a “pressão” 2D causada pelas interações de moléculas surfactantes na interface que age para diminuir a superfície de tensão pura. Em baixas pressões superficiais, as monocamadas lipídicas estão em um estado desorganizado semelhante a líquido; isso é conhecido como a fase expandida líquida (LE). À medida que a pressão superficial aumenta e a área por molécula lipídica diminui, os lipídios se orientam entre si e podem passar por uma transição de fase de primeira ordem para a fasecondensada líquida de longo alcance (LC) fase 16,20,27. As fases LE e LC podem coexistir em várias pressões superficiais e podem ser visualizadas à medida que lipídios marcados fluorescentes são excluídos da fase LC e segregados à fase LE. Assim, a fase LE é brilhante e a fase LC é escura quando imagens com CFM16.
π é a diferença entre a tensão superficial de uma interface fluido-fluido limpo, γ0, e uma interface coberta de surfactante, γ. π pode ser pensado como a “pressão” 2D causada pelas interações de moléculas surfactantes na interface que age para diminuir a superfície de tensão pura. Em baixas pressões superficiais, as monocamadas lipídicas estão em um estado desorganizado semelhante a líquido; isso é conhecido como a fase expandida líquida (LE). À medida que a pressão superficial aumenta e a área por molécula lipídica diminui, os lipídios se orientam entre si e podem passar por uma transição de fase de primeira ordem para a fasecondensada líquida de longo alcance (LC) fase 16,20,27. As fases LE e LC podem coexistir em várias pressões superficiais e podem ser visualizadas à medida que lipídios marcados fluorescentes são excluídos da fase LC e segregados à fase LE. Assim, a fase LE é brilhante e a fase LC é escura quando imagens com CFM16.
O objetivo deste manuscrito é descrever os passos necessários para construir e operar o microtensiometer de microscópio confocal combinado. Isso permitirá ao leitor realizar estudos de adsorção, medir a tensão superficial, o comportamento reológico e examinar a morfologia interfacial simultaneamente em uma interface de ar/água/água em escala de míccro ou óleo/água. Isso inclui uma discussão sobre como puxar, cortar e hidrofobizar os capilares necessários, instruções para o uso de modos de controle de pressão, curvatura e área de superfície, e transferência interfacial de surfactante insolúvel para a interface curva do microtensiometer.
Protocol
Representative Results
Discussion
O CPM/CFM combinado é uma poderosa ferramenta para examinar dinâmicas interfaciais, equilíbrio e morfologia. Este protocolo descreve as etapas necessárias para a obtenção de dados com CPM/CFM.
A Figura 2 mostra o design celular com canais para a troca capilar, solvente e de calor indicada. A entrada para troca de solventes deve estar na parte inferior da célula, enquanto a tomada deve estar na parte superior, permitindo que a célula não transborda durante…
Declarações
The authors have nothing to disclose.
Acknowledgements
Todas as imagens de microscopia confocal foram obtidas usando o microscópio confocal Multifocal Nikon A1RHD. Reconhecemos a orientação e assistência da equipe de apoio, especialmente Guillermo Marques, do Centro universitário de imagem da Universidade de Minnesota. Este trabalho foi apoiado pelo NIH Grant HL51177. O SI foi apoiado por um Ruth L. Kirschstein NRSA Institutional Research Training Grant F32 HL151128.
Materials
| 1.5 O.D. Tygon tubing | Fischer Scientific | Tubing | |
| A1RHD Multiphoton upright confocal microscope | Nikon | Confocal Microscope | |
| Acid Cleaning Solution | Sulfuric acid and Alnochromix diluted with water 50% by volume, wait until clear befor diluting | ||
| Alnochromix | Alconox | 2510 | Mixed with sulfuric acid to package instructionand diluted to make acid cleaning solution |
| Ceramic glass cutter | Sutter Instruments | ||
| Chloroform | Sigma-Aldrich | 650471 | HPLC Plus |
| Curosurf | Chiesi | Lung Surfactant | |
| Di Water | 18.5 MΩ – cm | ||
| Ethanol | any | 200 proof used for hydrophobization, denatured used for cleaning | |
| Fiber-Lite Model 190 fiber optic illuminator | Dolan-Jenner Industries Inc. | 281900100 | Light source; other light sources should work as well |
| Flow EZ F69 mbar w/Link Module | Fluigent | LU-FEZ-0069 | Microfluidic Pump |
| Fluigent SDK VIs | Fluigent | Required for CPM virtual Interface | |
| Fluoroelastomer gaskets | Machined from 1 mm thick Viton sheet, See figure 3 | ||
| Gas filter | Norgren | F07-100-A3TG | Put between microfluidic pump and pressure regulator |
| Gas regulator | Norgren | 10R0400R | Steps down pressure from sorce to range of pump, connected to gas filter range 2-120 psi |
| Glass Capilary | Sutter Instruments | B150-86-10 | Borosilicate glass O.D. 1.5 mm I.D. 0.86 mm |
| Glass Slide | any | 75 mm x 25 mm | |
| Glass Syringe | Hamilton | 84878 | 25 μL glass syringe |
| Hydrophobizing Agent | Sigma-Aldrich | 667420 | 1H,1H,2H,2H-Perfluoro-octyltriethoxysilane 98%, other hydrophobic triethoxysilane can be substituted |
| Insoluble surfactant | Avanti | 850355C-200mg | 16:0 DPPC in chloroform |
| LabVIEW Software | National Instruments | 2017 | |
| Longpass Filter | ThorLabs | FEL0650 | 650 nm Longpass filter, wavelength must remove excitation lazer frequence |
| Lyso-PC | Avanti | 855675P | 16:0 Lyso PC 1-palmitoyl-2-hydroxy-sn-glycero-3-phosphocholine |
| Masterflex L/S variable speed analog consol pump system w/ Easy-Load II pump head | Masterflex | HV-77916-20 | Peristaltic Pump |
| MATLAB | Mathworks | R2019 | |
| Micropipette Puller P-1000 | Sutter Instruments | Capillary Puller | |
| Microtensiometer Cell and Holder | Cell machined from PEEK, holder machined from aluminum, See Figure 3 and 4 | ||
| Microtensiometer Objective | Nikon | Fluor 20x/0.50W DIC M/N2 ∞/0 WD 2.0 mm | |
| NI Vision Development Module | National Instruments | Required for CPM virtual Interface | |
| PEEK finger tight fittings | IDEX | F-120x | 10-32 Coned Ports |
| PEEK plug | IDEX | P-551 | 10-31 Coned Ports |
| pippette tips | Eppendorf | 22492225 | 100 μL – 1000 μL, Autoclaved |
| Plastic Forceps | Thermo Scientific | 6320-0010 | |
| Plastic Syringe | Fischer Scientific | 14-955-459 | 10 mL |
| Plumbing parts | Fischer Scientific | 3-way valves and other plumbing parts to connect tubing. | |
| Research Plus 1-channel 100 μL–1000 μL | Eppendorf | 3123000063 | Micro pipetter |
| Sulfuric Acid | any | Used for acid cleaning solution | |
| T Plan SLWD 20x/0.30 OFN25 WD 30 mm | Nikon | Confocal Microscope Objective | |
| Texas Red DHPE triethylammonim salt | Thermo Fischer Scientific | 1395MP | Fluorophore |
| Vaccum Pump | Gast | DOA-P704-AA |
Referências
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Interfacial rheology of globular and flexible proteins at the hexadecane/water interface: Comparison of shear and dilatation deformation. Journal of Physical Chemistry B. 108 (12), 3835-3844 (2004).
- Freer, E. M., Yim, K. S., Fuller, G. G., Radke, C. J. Shear and dilatational relaxation mechanisms of globular and flexible proteins at the hexadecane/water interface. Langmuir. 20 (23), 10159-10167 (2004).
- Kannan, A., Shieh, I. C., Fuller, G. G. Linking aggregation and interfacial properties in monoclonal antibody-surfactant formulations. Journal of Colloid and Interface Science. 550, 128-138 (2019).
- Kannan, A., Shieh, I. C., Leiske, D. L., Fuller, G. G. Monoclonal antibody interfaces: Dilatation mechanics and bubble coalescence. Langmuir. 34 (2), 630-638 (2018).
- Li, J. J., et al. Interfacial stress in the development of biologics: Fundamental understanding, current practice, and future perspective. The AAPS Journal. 21 (3), 44 (2019).
- Bhamla, M. S., Giacomin, C. E., Balemans, C., Fuller, G. G. Influence of interfacial rheology on drainage from curved surfaces. Soft Matter. 10 (36), 6917-6925 (2014).
- Fuller, G. G., Vermant, J. Complex fluid-fluid interfaces: Rheology and structure. Annual Review of Chemical and Biomolecular Engineering. 3, 519-543 (2012).
- Rosenfeld, L., et al. Structural and rheological properties of meibomian lipid. Investigative Ophthalmology & Visual Science. 54 (4), 2720-2732 (2013).
- Barman, S., Davidson, M. L., Walker, L. M., Anna, S. L., Zasadzinski, J. A. Inflammation product effects on dilatational mechanics can trigger the Laplace instability and acute respiratory distress syndrome. Soft Matter. 16 (29), 6890-6901 (2020).
- Barman, S., et al., Ramachadran, A., et al. . Recent Advances in Rheology: Theory, Biorheology, Suspension and Interfacial Rheology. , (2022).
- Alonso, C., Zasadzinski, J. A. A brief review of the relationship between monolayer viscosity, phase behavior, surface pressure and temperature using a simple monolayer viscometer. The Journal of Physical Chemistry B. 110 (44), 22185-22191 (2006).
- Alonso, C., et al. More than a monolayer: Relating lung surfactant structure and mechanics to composition. Biophysical Journal. 87 (6), 4188-4202 (2004).
- Alonso, C., Bringezu, F., Brezesinski, G., Waring, A. J., Zasadzinski, J. A. Modifying calf lung surfactant by hexadecanol. Langmuir. 21 (3), 1028-1035 (2005).
- Alonso, C., Waring, A. J., Zasadzinski, J. A. Keeping lung surfactant where it belongs: Protein regulation of two-dimensional viscosity. Biophysical Journal. 89 (1), 266-273 (2005).
- Zasadzinski, J. A., et al. Inhibition of pulmonary surfactant adsorption by serum and the mechanisms of reversal by hydrophilic polymers: Theory. Biophysical Journal. 89 (3), 1621-1629 (2005).
- McConnell, H. M. Structures and transitions in lipid monolayers at the air-water-interface. Annual Reviews of Physical Chemistry. 42, 171-195 (1991).
- McConnell, H. M., Moy, V. T. Shapes of finite two-dimensional lipid domains. Journal of Physical Chemistry. 92 (15), 4520-4525 (1988).
- Zasadzinski, J. A., Stenger, P., Shieh, I., Dhar, P. Overcoming rapid inactivation of lung surfactant: analogies between competitive adsorption and colloid stability. Biochemica et Biophysica Acta. 1798 (4), 801-828 (2010).
- Zasadzinski, J. A., Nag, K., et al. . Surfactant Progress. , (2008).
- Valtierrez-Gaytan, C., et al. Spontaneous evolution of equilibrium morphology in phospholipid-cholesterol monolayers. Science Advances. 8 (14), (2022).
- Williams, I., Zasadzinski, J. A., Squires, T. M. Interfacial rheology and direct imaging reveal domain-templated network formation in phospholipid monolayers penetrated by fibrinogen. Soft Matter. 15 (44), 9076-9084 (2019).
- Sachan, A. K., Zasadzinski, J. A. Interfacial curvature effects on the monolayer morphology and dynamics of a clinical lung surfactant. Proceedings of the National Academy of Sciences of the United States of America. 115 (2), 134-143 (2018).
- Alvarez, N. J., Anna, S. L., Saigal, T., Tilton, R. D., Walker, L. M. Intefacial dynamics and rheology of polymer grafter nanoparticles at air-water and xylene-water interfaces. Langmuir. 28 (21), 8052-8063 (2012).
- Alvarez, N. J., Vogus, D. R., Walker, L. M., Anna, S. L. Using bulk convection in a microtensiometer to approach kinetic-limited surfactant dynamics at fluid-fluid interfaces. Journal of Colloid and Interface Science. 372 (1), 183-191 (2012).
- Alvarez, N. J., Walker, L. M., Anna, S. L. Diffusion-limited adsorption to a spherical geometry: The impact of curvature and competitive time scales. Physical Review. E, Statistical, Nonlinear, and Soft Matter Physics. 82, 011604 (2010).
- Shieh, I., Waring, A. J., Zasadzinski, J. A. Visualizing the analogy between competitive adsorption and colloid stability to restore lung surfactant function. Biophysical Journal. 102 (4), 777-786 (2012).
- Shieh, I., Zasadzinski, J. A. Visualizing monolayers with a water-soluble fluorophore to quantify adsorption, desorption and the double-layer. Proceedings of the National Academy of Sciences of the United States of America. 112 (8), 826-835 (2015).
- Lipp, M. M., Lee, K. Y. C., Takamoto, D. Y., Zasadzinski, J. A., Waring, A. J. Coexistence of buckled and flat monolayers. Physical Review Letters. 81, 1650-1653 (1998).
- Lipp, M. M., Lee, K. Y. C., Waring, A., Zasadzinski, J. A. Fluorescence, polarized fluorescence, and Brewster angle microscopy of palmitic acid and lung surfactant protein B monolayers. Biophysical Journal. 72 (6), 2783-2804 (1997).
- Alvarez, N. J., Walker, L. M., Anna, S. L. A microtensiometer to probe the effect of radius of curvature on surfactant transport to a spherical interface. Langmuir. 26 (16), 13310-13319 (2010).
- Ward, A. F. H., Tordai, L. Time dependents of boundary tensions of solutions. 1. The role of diffusion in time-effects. Journal of Chemical Physics. 14, 453-461 (1946).
- Lucassen, J., Vanden Tempel, M. Dynamic measurements of dilatational properties of a liquid interface. Chemical Engineering Science. 27 (6), 1283-1291 (1972).
- Lin, G. L., et al. Interfacial dilatational deformation accelerates particle formation in monoclonal antibody solutions. Soft Matter. 12 (14), 3293-3302 (2016).
- Bastacky, J., et al. Alveolar lining layer is thin and continuous: low temperature scanning electron microscopy of rat lung. Journal of Applied Physiology. 79 (5), 1615-1628 (1995).
- Adamson, A. W., Gast, A. P. . Physical Chemistry of Surfaces, Sixth ed. , 784 (1997).
- del Rio, O. I., Kwok, D. Y., Wu, R., Alvarez, J. M., Neumann, A. W. Contact angle measurements by axisymmetric drop shape analysis and an automated polynomial fit program. Colloids and Surfaces A Physicochemical and Engineering Aspects. 143 (2-3), 197-210 (1998).
- Kanthe, A., et al. No ordinary proteins: Adsorption and molecular orientation of monoclonal antibodies. Science Advances. 7 (5), 14 (2021).
- Manikantan, H., Squires, T. M. Surfactant dynamics: hidden variables controlling fluid flows. Journal of Fluid Mechanics. 892, 115 (2020).
- Narayan, S., et al. Dilatational rheology of water-in-diesel fuel interfaces: effect of surfactant concentration and bulk-to-interface exchange. Soft Matter. 17 (18), 4751-4765 (2021).
- Meng, G. N., Paulose, J., Nelson, D. R., Manoharan, V. N. Elastic instability of a crystal growing on a curved surface. Science. 343 (6171), 634-637 (2014).
- Kotula, A. P., Anna, S. L. Insoluble layer deposition and dilatational rheology at a microscale spherical cap interface. Soft Matter. 12 (33), 7038-7055 (2016).
- Lipp, M. M., Lee, K. Y. C., Zasadzinski, J. A., Waring, A. J. Phase and morphology changes in lipid monolayers induced by SP-B protein and its amino-terminal peptide. Science. 273 (5279), 1196-1199 (1996).
- Pocivavsek, L., et al. Stress and fold localization in thin elastic membranes. Science. 320 (5878), 912-916 (2008).
- Pocivavsek, L., et al. Lateral stress relaxation and collapse in lipid monolayers. Soft Matter. 4 (10), 2019-2029 (2008).
- Kim, K., Choi, S. Q., Squires, T. M., Zasadzinski, J. A. Cholesterol nanodomains: their effect on monolayer morphology and dynamics. Proceedings of the National Academy of Sciences of the United States of America. 110 (33), 3054-3060 (2013).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Interfacial microrheology of DPPC monolayers at the air-water interface. Soft Matter. 7 (17), 7782-7789 (2011).
- Kim, K., Choi, S. Q., Zasadzinski, J. A., Squires, T. M. Nonlinear chiral rheology of phospholipid monolayers. Soft Matter. 14 (13), 2476-2483 (2018).
- Kotula, A. P., Anna, S. L. Regular perturbation analysis of small amplitude oscillatory dilatation of an interface in a capillary pressure tensiometer. Journal of Rheology. 59, 85-117 (2015).

