フローサイトメトリーによる老化腫瘍細胞の同定と濃縮のための遠赤色蛍光老化関連β-ガラクトシダーゼプローブ
Summary
細胞培養またはマウス腫瘍モデルにおける化学療法薬によって誘導された老化癌細胞の蛍光フローサイトメトリー定量のためのプロトコルが提示されます。オプションの手順には、共免疫染色、大規模なバッチまたは時点分析を容易にするためのサンプル固定、およびフローサイトメトリーソーティングによる生細胞濃縮が含まれます。
Abstract
細胞老化は、生物学的損傷によって誘発される増殖性停止の状態であり、通常は老化した細胞で何年にもわたって発生しますが、さまざまな癌治療によって誘発される損傷への応答として腫瘍細胞に急速に現れることもあります。老化細胞は死に抵抗性になり、腫瘍の悪性度と治療抵抗性を悪化させながら腫瘍の寛解をブロックするため、腫瘍細胞の老化は一般的に望ましくないと考えられています。したがって、老化した腫瘍細胞の同定は、癌研究コミュニティにとって継続的な関心事です。様々な老化アッセイが存在し、その多くは、よく知られている老化マーカーである老化関連β−ガラクトシダーゼ(SA−β−Gal)の活性に基づいている。
典型的には、SA-β-Galアッセイは、固定細胞上の発色基質(X-Gal)を用いて行われ、光学顕微鏡による「青色」老化細胞のゆっくりとした主観的な列挙が行われる。C12-FDG(緑色)およびDDAO-ガラクトシド(DDAOG;遠赤色)を含む、細胞透過性の蛍光SA-β-Gal基質を使用した改良されたアッセイにより、生細胞の分析が可能になり、フローサイトメーターを含むハイスループット蛍光分析プラットフォームの使用が可能になりました。C12-FDGはSA-β-Galのプローブとして十分に文書化されていますが、その緑色蛍光発光は、リポフスチン凝集体の蓄積により老化中に生じる固有の細胞自家蛍光(AF)と重複しています。遠赤色のSA-β-GalプローブDDAOGを利用することにより、緑色の細胞自家蛍光を老化を確認するための二次パラメータとして使用でき、アッセイの信頼性が向上します。残りの蛍光チャネルは、細胞生存率染色またはオプションの蛍光免疫標識に使用できます。
フローサイトメトリーを使用して、老化した腫瘍細胞を同定するためのデュアルパラメーターアッセイとしてDDAOGとリポフスチン自家蛍光の使用を実証します。生細胞の割合の定量が行われる。所望により、目的の細胞表面抗原を評価するための任意の免疫標識ステップが含まれていてもよい。同定された老化細胞は、フローサイトメトリーで選別し、ダウンストリーム分析のために収集することもできます。集められた老化細胞は、直ちに溶解(例えば、イムノアッセイまたは’オミクス分析のために)またはさらに培養することができる。
Introduction
老化細胞は通常、通常の生物学的老化の間に何年にもわたって生物に蓄積しますが、放射線や化学療法を含むさまざまな癌治療によって誘発される損傷への応答として腫瘍細胞で急速に発達することもあります。もはや増殖しないが、治療誘発老化(TIS)腫瘍細胞は治療抵抗性に寄与し、再発を引き起こす可能性がある1,2,3。TIS細胞によって分泌される因子は、免疫回避または転移を促進することにより、腫瘍の悪性腫瘍を悪化させる可能性があります4,5。TIS細胞は、複雑な状況特異的な表現型、変化した代謝プロファイル、および独自の免疫応答を発達させます6,7,8。したがって、さまざまな癌治療アプローチによって誘導されるTIS腫瘍細胞の同定と特性評価は、癌研究コミュニティにとって継続的な関心事です。
TIS腫瘍細胞を検出するために、従来の老化アッセイが広く用いられており、主として老化マーカー酵素であるリソソームβ-ガラクトシダーゼGLB19の活性の増加を検出することに基づいている。(酸性ではなく)中性に近いリソソームpHでの検出により、老化関連β-ガラクトシダーゼ(SA-β-Gal)10を特異的に検出できます。数十年にわたって使用されてきた標準的なSA-β-Galアッセイは、青色発色ベータガラクトシダーゼ基質であるX-Gal(5-ブロモ-4-クロロ-3-インドリル-β-D-ガラクトピラノシド)を使用して、光学顕微鏡によって固定細胞中のSA-β-Galを検出します11。X-Galアッセイは、一般的に入手可能な試薬や実験装置を利用してTISを定性的に視覚的に確認することができます。基本的な透過光顕微鏡は、青色色原体の存在を評価するために必要な唯一の機器です。ただし、X-Gal染色手順は感度に欠ける可能性があり、色が発色するまでに24時間以上かかる場合があります。染色に続いて、光学顕微鏡下で青色色原体のある程度の強度を示す細胞をカウントすることに基づいて、個々の老化細胞の低スループットの主観的スコアリングが行われます。X-Galは細胞不透過性であるため、このアッセイには溶媒固定細胞が必要であり、ダウンストリーム分析のために回収することはできません。動物や患者からの限られたサンプルを扱う場合、これは大きな欠点になる可能性があります。
C 12-FDG(5-ドデカノイルアミノフルオレセインジβ-D-ガラクトピラノシド、緑色)およびDDAOG(9H-(1,3-ジクロロ-9,9-ジメチルアクリジン-2-オン-7-イル)β-D-ガラクトピラノシド、遠赤色)を含む、細胞透過性の蛍光酵素基質を用いた改良されたSA-β-Galアッセイは、文献12,13,14,15にすでに登場しています。DDAOGの化学プローブの構造と光学特性を補足図S1に示します。これらの細胞透過性プローブは(固定ではなく)生細胞の分析を可能にし、発色プローブではなく蛍光プローブは、ハイコンテントスクリーニング装置やフローサイトメーターなどの高速ハイスループット蛍光分析プラットフォームの使用を容易にします。ソーティングフローサイトメーターを使用すると、細胞培養物や腫瘍から濃縮された老化細胞の集団を回収して、ダウンストリーム分析(ウェスタンブロッティング、ELISA、オミクスなど)を行うことができます。蛍光分析は定量的シグナルも提供し、特定のサンプル内の老化細胞の割合をより正確に決定できるようにします。生存率プローブや蛍光色素標識抗体などの蛍光プローブも容易に追加でき、SA-β-Gal以外のターゲットのマルチプレックス解析が可能です。
DDAOGと同様に、C12-FDGはSA-β-Galの蛍光プローブですが、その緑色の蛍光発光は、細胞16にリポフスチン凝集体が蓄積するために老化中に生じる固有の細胞AFと重なります。遠赤色DDAOGプローブを利用することにより、緑色セルラーAFを老化17を確認するための二次パラメータとして使用できます。これにより、老化18の単一マーカーとして信頼性が低いことが多いSA-β-Galに加えて、2番目のマーカーを使用することでアッセイの信頼性が向上します。老化細胞における内因性AFの検出はラベルフリーのアプローチであるため、DDADOGベースのアッセイの特異性を拡大するための迅速かつ簡単な方法です。
このプロトコルでは、 in vitro 培養から、またはマウスで確立された薬物治療腫瘍から単離された生存可能なTIS腫瘍細胞を同定するための迅速なデュアルパラメータフローサイトメトリーアッセイとしてDDAOGおよびAFを使用する方法を示します(図1)。このプロトコルは、市販の幅広い標準的なフローサイトメトリー分析装置およびソーターと互換性のある蛍光色素を使用しています(表1)。標準的なフローサイトメトリー分析を用いた生細胞の割合の定量が可能です。所望により、任意の免疫標識ステップを実施して、老化と同時に目的の細胞表面抗原を評価してもよい。同定された老化細胞は、標準的な蛍光活性化セルソーティング(FACS)方法論を使用して濃縮することもできます。
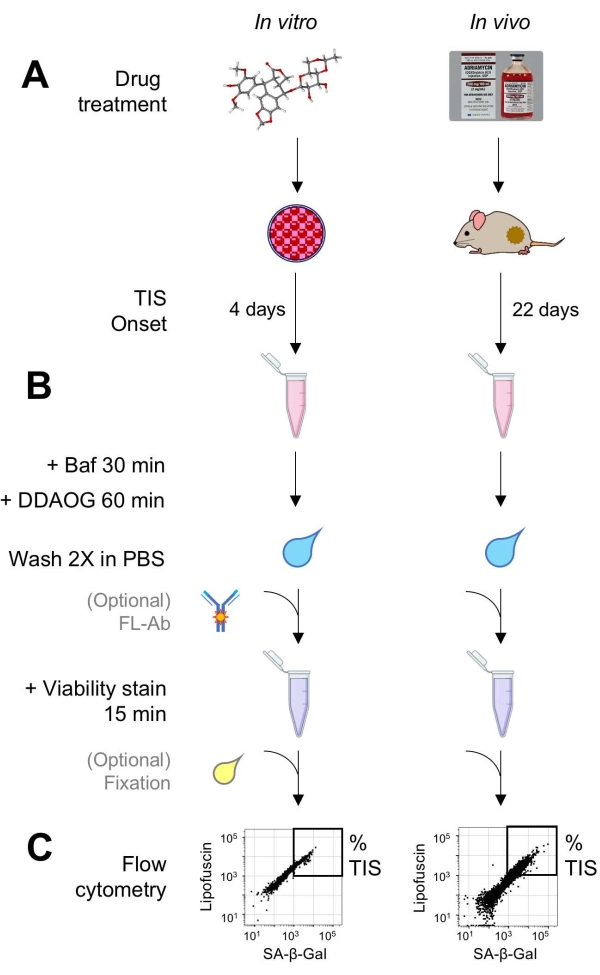
図1:実験ワークフロー。 DDAOGアッセイの要点をまとめた概略図。(A)哺乳類培養細胞にTIS誘導薬を添加するか、担がんマウスに投与する。その後、TISの発症に時間が与えられます:細胞の場合、治療後4日。マウスの場合、合計22日間、5日ごとに3回の治療と7日間の回復。細胞を採取するか、腫瘍を解離して懸濁液にします。(B)サンプルをBafで処理して、SA-β-Galを検出するためにリソソームpHを30分間調整します。次に、DDAOGプローブを60分間追加して、SA-β-Galを検出します。サンプルをPBSで2回洗浄し、生存率染色剤を短時間加えます(15分)。オプションで、サンプルをオープン蛍光チャネルで蛍光抗体で染色したり、後で分析するために固定したりすることができます。(C)サンプルは、標準のフローサイトメーターを使用して分析されます。生細胞は、赤色のDDAOG(SA-β-Galを示す)と緑色の自家蛍光(リポフスチン)を示すドットプロットで視覚化されます。TIS細胞の割合を決定するためのゲートは、未処理の対照試料(図示せず)に基づいて確立される。ソーティングサイトメーター(FACS)を使用する場合、TIS細胞を回収して培養液に戻してin vitro アッセイを行ったり、分子生物学的アッセイのために溶解して処理したりすることができます。略語:DDAO = 9H-(1,3-ジクロロ-9,9-ジメチルアクリジン-2-オン);DDAOG = DDAO-ガラクトシド;TIS =治療誘発性老化;FL-Ab = 蛍光色素標識抗体;Baf = バフィロマイシンA1;SA-β-Gal=老化関連β-ガラクトシダーゼ;PBS =リン酸緩衝生理食塩水;FACS = 蛍光活性化細胞選別。 この図の拡大版を表示するには、ここをクリックしてください。
| フルオロフォア | 検出 | 例/エム (ナノメートル) | サイトメーターレーザー(nm) | サイトメーター検出器/バンドパスフィルター(nm) |
| ダオグ | サβガル | 645/6601 | 640 | 670 / 30 |
| AF | リポフスチン | < 600 | 488 | 525 / 50 |
| CV450 | 生存 率 | 408/450 | 405 | 450 / 50 |
| ペ | 抗体/表面マーカー | 565/578 | 561 | 582 / 15 |
表1:蛍光色素およびサイトメーターの光学仕様。 このプロトコルで使用されるサイトメーターの仕様は、合計4つのレーザーと15の発光検出器を備えた機器についてリストされています。645/660 nmで検出されたDDAOGは、SA-β-Gal1によって切断されたプローブの形態です。切断されたDDAOGは、460/610 nmで低レベルの蛍光を示す可能性がありますが、プロトコルの洗浄ステップによって除去されます。略語:DDAO = 9H-(1,3-ジクロロ-9,9-ジメチルアクリジン-2-オン);DDAOG = DDAO-ガラクトシド;AF =自家蛍光;PE =フィコエリスリン;SA-β-Gal =老化関連β-ガラクトシダーゼ。
Protocol
Representative Results
Discussion
過去10年ほどで、フローサイトメトリーは、腫瘍免疫学の人気の高まり、低コストのフローサイトメーターの開発、および学術機関での共有機器施設の改善により、癌研究においてより一般的なアッセイプラットフォームになりました。マルチカラーアッセイは現在標準であり、ほとんどの新しい機器には紫、青緑、赤から遠赤色の光学アレイが装備されています。したがって、このDDAOGプロ…
Declarações
The authors have nothing to disclose.
Acknowledgements
シカゴ大学のサイトメトリーおよび抗体コアファシリティには、フローサイトメトリー機器のサポートに感謝します。シカゴ大学の動物研究センターは動物の住居を提供しました。
Materials
| Bafilomycin A1 | Research Products International | B40500 | |
| Bleomycin sulfate | Cayman | 13877 | |
| Bovine serum albumin (BSA) | US Biological | A1380 | |
| Calcein Violet 450 AM viability dye | ThermoFisher Scientific | 65-0854-39 | eBioscience |
| DPP4 antibody, PE conjugate | Biolegend | 137803 | Clone H194-112 |
| Cell line: A549 human lung adenocarcinoma | American Type Culture Collection | CCL-185 | |
| Cell line: B16-F10 mouse melanoma | American Type Culture Collection | CRL-6475 | |
| Cell scraper | Corning | 3008 | |
| Cell strainers, 100 µm | Falcon | 352360 | |
| DDAO-Galactoside | Life Technologies | D6488 | |
| DMEM medium 1x | Life Technologies | 11960-069 | |
| DMSO | Sigma | D2438 | |
| DNAse I | Sigma | DN25 | |
| Doxorubicin, hydrochloride injection (USP) | Pfizer | NDC 0069-3032-20 | |
| Doxorubicin, PEGylated liposomal (USP) | Sun Pharmaceutical | NDC 47335-049-40 | |
| EDTA 0.5 M | Life Technologies | 15575-038 | |
| Etoposide | Cayman | 12092 | |
| FBS | Omega | FB-11 | |
| Fc receptor blocking reagent | Biolegend | 101320 | Anti-mouse CD16/32 |
| Flow cytometer (cell analyzer) | Becton Dickinson (BD) | Various | LSRFortessa |
| Flow cytometer (cell sorter) | Becton Dickinson (BD) | Various | FACSAria |
| GlutaMax 100x | Life Technologies | 35050061 | |
| HEPES 1 M | Lonza | BW17737 | |
| Liberase TL | Sigma | 5401020001 | Roche |
| Paraformaldehyde 16% | Electron Microscopy Sciences | 15710 | |
| Penicillin/Streptomycin 100x | Life Technologies | 15140122 | |
| Phosphate buffered saline (PBS) 1x | Corning | MT21031CV | Dulbecco's PBS (without calcium and magnesium) |
| Rainbow calibration particles, ultra kit | SpheroTech | UCRP-38-2K | 3.5-3.9 µm, 2E6/mL |
| RPMI-1640 medium 1x | Life Technologies | 11875-119 | |
| Sodium chloride 0.9% (USP) | Baxter Healthcare Corporation | 2B1324 | |
| Software for cytometer data acquisition, "FACSDiva" | Becton Dickinson (BD) | n/a | Contact BD for license |
| Software for cytometer data analysis, "FlowJo" | TreeStar | n/a | Contact TreeStar for license |
| Trypsin-EDTA 0.25% | Life Technologies | 25200-114 |
Referências
- Saleh, T., Tyutyunyk-Massey, L., Gewirtz, D. A. Tumor cell escape from therapy-induced senescence as a model of disease recurrence after dormancy. Pesquisa do Câncer. 79 (6), 1044-1046 (2019).
- Wang, B., Kohli, J., Demaria, M. Senescent cells in cancer therapy: friends or foes. Trends in Cancer. 6 (10), 838-857 (2020).
- Prasanna, P. G., et al. Therapy-induced senescence: Opportunities to improve anticancer therapy. Journal of the National Cancer Institute. 113 (10), 1285-1298 (2021).
- Velarde, M. C., Demaria, M., Campisi, J. Senescent cells and their secretory phenotype as targets for cancer therapy. Interdisciplinary Topics in Gerontology and Geriatrics. 38, 17-27 (2013).
- Ou, H. L., et al. Cellular senescence in cancer: from mechanisms to detection. Molecular Oncology. 15 (10), 2634-2671 (2021).
- Hernandez-Segura, A., Nehme, J., Demaria, M. Hallmarks of cellular senescence. Trends in Cell Biology. 28 (6), 436-453 (2018).
- Bojko, A., Czarnecka-Herok, J., Charzynska, A., Dabrowski, M., Sikora, E. Diversity of the senescence phenotype of cancer cells treated with chemotherapeutic agents. Cells. 8 (12), 1501 (2019).
- Mikuła-Pietrasik, J., Niklas, A., Uruski, P., Tykarski, A., Książek, K. Mechanisms and significance of therapy-induced and spontaneous senescence of cancer cells. Cellular and Molecular Life Sciences. 77 (2), 213-229 (2020).
- Lee, B. Y., et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase. Aging cell. 5 (2), 187-195 (2006).
- Itahana, K., Itahana, Y., Dimri, G. P. Colorimetric detection of senescence-associated β galactosidase. Methods in Molecular Biology. 965, 143-156 (2013).
- Dimri, G. P., et al. A biomarker that identifies senescent human cells in culture and in aging skin in vivo. Proceedings of the National Academy of Sciences of the United States of America. 92 (20), 9363-9367 (1995).
- Debacq-Chainiaux, F., Erusalimsky, J. D., Campisi, J., Toussaint, O. Protocols to detect senescence-associated beta-galactosidase (SA-betagal) activity, a biomarker of senescent cells in culture and in vivo. Nature Protocols. 4 (12), 1798-1806 (2009).
- Noppe, G., et al. Rapid flow cytometric method for measuring senescence associated beta-galactosidase activity in human fibroblasts. Cytometry A. 75 (11), 910-916 (2009).
- Tung, C. -. H., et al. In vivo imaging of β-galactosidase activity using far red fluorescent switch. Pesquisa do Câncer. 64 (5), 1579-1583 (2004).
- Gong, H., et al. beta-Galactosidase activity assay using far-red-shifted fluorescent substrate DDAOG. Analytical Biochemistry. 386 (1), 59-64 (2009).
- Terman, A., Brunk, U. T. Lipofuscin: Mechanisms of formation and increase with age. APMIS. 106 (2), 265-276 (1998).
- Georgakopoulou, E. A., et al. Specific lipofuscin staining as a novel biomarker to detect replicative and stress-induced senescence. A method applicable in cryo-preserved and archival tissues. Aging. 5 (1), 37-50 (2013).
- Wang, B., Demaria, M. The quest to define and target cellular senescence in cancer. Pesquisa do Câncer. 81 (24), 6087-6089 (2021).
- Appelbe, O. K., Zhang, Q., Pelizzari, C. A., Weichselbaum, R. R., Kron, S. J. Image-guided radiotherapy targets macromolecules through altering the tumor microenvironment. Molecular Pharmaceutics. 13 (10), 3457-3467 (2016).
- Maciorowski, Z., Chattopadhyay, P. K., Jain, P. Basic multicolor flow cytometry. Current Protocols in Immunology. 117, 1-38 (2017).
- Fan, Y., Cheng, J., Zeng, H., Shao, L. Senescent cell depletion through targeting BCL-family proteins and mitochondria. Frontiers in Physiology. 11, 593630 (2020).
- Kim, K. M., et al. Identification of senescent cell surface targetable protein DPP4. Genes and Development. 31 (15), 1529-1534 (2017).
- Flor, A. C., Kron, S. J. Lipid-derived reactive aldehydes link oxidative stress to cell senescence. Cell Death Discovery. 7 (9), 2366 (2016).
- Jochems, F., et al. The Cancer SENESCopedia: A delineation of cancer cell senescence. Cell reports. 36 (4), 109441 (2021).
- Fallah, M., et al. Doxorubicin and liposomal doxorubicin induce senescence by enhancing nuclear factor kappa B and mitochondrial membrane potential. Life Sciences. 232, 116677 (2019).
- Kasper, M., Barth, K. Bleomycin and its role in inducing apoptosis and senescence in lung cells – modulating effects of caveolin-1. Current Cancer Drug Targets. 9 (3), 341-353 (2009).
- Muthuramalingam, K., Cho, M., Kim, Y. Cellular senescence and EMT crosstalk in bleomycin-induced pathogenesis of pulmonary fibrosis-an in vitro analysis. Cell Biology International. 44 (2), 477-487 (2020).
- Flor, A. C., Wolfgeher, D., Wu, D., Kron, S. J. A signature of enhanced lipid metabolism, lipid peroxidation and aldehyde stress in therapy-induced senescence. Cell Death Discovery. 3, 17075 (2017).
- Burd, C. E., et al. Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model. Cell. 152 (1-2), 340-351 (2013).
- Liu, J. Y., et al. Cells exhibiting strong p16 (INK4a) promoter activation in vivo display features of senescence. Proceedings of the National Academy of Sciences of the United States of America. 116 (7), 2603-2611 (2019).
- Wang, L., Lankhorst, L., Bernards, R. Exploiting senescence for the treatment of cancer. Nature Reviews Cancer. 22 (6), 340-355 (2022).
- Baek, K. -. H., Ryeom, S. Detection of oncogene-induced senescence in vivo. Methods in Molecular Biology. 1534, 185-198 (2017).
- González-Gualda, E., Baker, A. G., Fruk, L., Muñoz-Espín, D. A guide to assessing cellular senescence in vitro and in vivo. The FEBS Journal. 288 (1), 56-80 (2021).

