Creazione di un ginocchio joint-on-a-chip per la modellazione delle malattie articolari e la sperimentazione di farmaci
Summary
Forniamo metodi dettagliati per generare quattro tipi di tessuti da cellule staminali mesenchimali umane, che vengono utilizzate per ricapitolare la cartilagine, l’osso, il cuscinetto adiposo e la sinovia nell’articolazione del ginocchio umano. Questi quattro tessuti sono integrati in un bioreattore personalizzato e collegati attraverso la microfluidica, generando così un’articolazione del ginocchio su un chip.
Abstract
L’elevata prevalenza di malattie articolari debilitanti come l’osteoartrite (OA) rappresenta un elevato onere socioeconomico. Attualmente, i farmaci disponibili che colpiscono i disturbi articolari sono per lo più palliativi. Il bisogno insoddisfatto di farmaci OA modificanti la malattia (DMOAD) efficaci è stato causato principalmente dall’assenza di modelli appropriati per studiare i meccanismi della malattia e testare potenziali DMOAD. Qui descriviamo la creazione di un sistema microfisiologico che imita l’articolazione sinoviale in miniatura (miniJoint) comprendente componenti del tessuto adiposo, fibroso e osteocondrale derivati da cellule staminali mesenchimali umane (MSC). Per ottenere i microtessuti tridimensionali (3D), le MSC sono state incapsulate in gelatina metacrilata fotocrosslinkabile prima o dopo la differenziazione. I costrutti tissutali carichi di cellule sono stati quindi integrati in un bioreattore stampato in 3D, formando il miniJoint. Sono stati introdotti flussi separati di mezzi osteogenici, fibrogenici e adipogeni per mantenere i rispettivi fenotipi tissutali. Un flusso comunemente condiviso è stato perfuso attraverso la cartilagine, la sinoviale e i tessuti adiposi per consentire la diafonia tissutale. Questo modello di flusso consente l’induzione di perturbazioni in uno o più componenti tissutali per studi meccanicistici. Inoltre, i potenziali DMOAD possono essere testati tramite “somministrazione sistemica” attraverso tutti i flussi di mezzo o “somministrazione intraarticolare” aggiungendo i farmaci solo al flusso di simulazione del “liquido sinoviale” condiviso. Pertanto, il miniJoint può fungere da piattaforma versatile in vitro per studiare de modo efficiente i meccanismi della malattia e testare i farmaci nella medicina personalizzata.
Introduction
Le malattie articolari come l’osteoartrite (OA) sono altamente diffuse e debilitanti e rappresentano una delle principali cause di disabilità in tutto il mondo1. Si stima che solo negli Stati Uniti, l’OA colpisca 27 milioni di pazienti e si verifichi nel 12,1% degli adulti di età pario superiore a 60 anni. Sfortunatamente, la maggior parte dei farmaci attualmente utilizzati per gestire le malattie articolari sono palliativi e non sono disponibili farmaci OA modificanti la malattia (DMOAD) efficaci3. Questo bisogno medico insoddisfatto deriva principalmente dall’assenza di un modello efficace per studiare i meccanismi della malattia e sviluppare potenziali DMOAD. La coltura cellulare bidimensionale convenzionale (2D) non riflette la natura 3D dei tessuti articolari e la coltura degli espianti tissutali è spesso ostacolata da una significativa morte cellulare e di solito non riesce a replicare le interconnessioni tissutali dinamiche4. Inoltre, le differenze genetiche e anatomiche riducono significativamente la rilevanza fisiologica dei modelli animali4.
Gli organi su chip (OoC), o sistemi microfisiologici, sono un campo di ricerca promettente all’interfaccia tra ingegneria, biologia e medicina. Queste piattaforme in vitro sono unità funzionali minime che replicano caratteristiche sane o patologiche definite delle loro controparti in vivo 5. Inoltre, questi sistemi miniaturizzati possono ospitare diverse cellule e matrici e simulare le interazioni biofisiche e biochimiche tra diversi tessuti. Pertanto, un sistema microfisiologico in grado di ricapitolare fedelmente l’articolazione sinoviale nativa promette di offrire una piattaforma efficace per modellare le malattie articolari e sviluppare potenziali DMOAD.
Le cellule staminali mesenchimali umane (MSC) possono essere isolate da molti tessuti in tutto il corpo e differenziate in linee osteogeniche, condrogeniche e adipogeniche6. Le MSC sono state utilizzate con successo per ingegnerizzare vari tessuti, tra cui ossa, cartilagine e tessuto adiposo6, il che significa che rappresentano una fonte cellulare promettente per l’ingegneria dei componenti tissutali dell’articolazione del ginocchio. Recentemente abbiamo sviluppato un sistema microfisiologico miniaturizzato che imita le articolazioni, chiamato miniJoint, che comprende ossa, cartilagine, tessuti fibrosi e adiposi derivati da MSC7. In particolare, il nuovo design consente la diafonia tissutale mediante flusso microfluidico o permeazione (Figura 1). Qui presentiamo i protocolli per la fabbricazione dei componenti del chip, l’ingegneria dei componenti tissutali, la coltura dei tessuti ingegnerizzati nel chip e la raccolta dei tessuti per le analisi a valle.
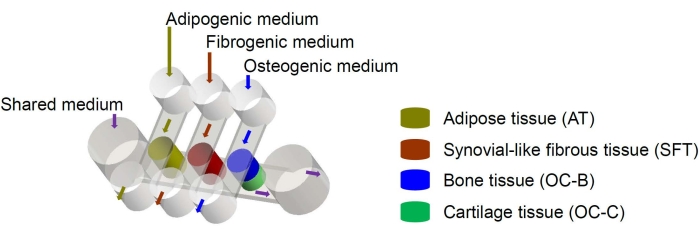
Figura 1: Schema del chip miniJoint che mostra la disposizione dei diversi componenti tissutali e dei flussi del mezzo. OC = tessuto osteocondrale. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Protocol
Representative Results
Discussion
In questo articolo, presentiamo un protocollo per la creazione di un sistema articolato del ginocchio su un chip, in cui ossa, cartilagine, tessuto adiposo e tessuti simil-sinoviali sono formati da MSC e co-coltivati all’interno di un bioreattore personalizzato. Questo sistema multicomponente derivato da cellule umane con funzionalità plug-and-play rappresenta un nuovo strumento per lo studio della patogenesi delle malattie articolari e lo sviluppo di farmaci.
Dato che tessuti diversi favori…
Declarações
The authors have nothing to disclose.
Acknowledgements
Questa ricerca è stata sostenuta principalmente dal finanziamento del National Institutes of Health (UG3 / UH3TR002136, UG3 / UH3TR003090). Inoltre, ringraziamo il Dr. Paul Manner (Università di Washington) per aver fornito i campioni di tessuto umano e il Dr. Jian Tan per il loro aiuto nell’isolamento delle MSC e nella creazione del pool cellulare.
Materials
| 3-isobutyl-1-methylxanthine | Sigma -Aldrich | I17018-1G | |
| 6 well non-tissue culture plate | Corning Falcon® Plates | 351146 | |
| 24 well non-tissue culture plate | Corning Falcon® Plates | 351147 | |
| 30 mL syringes | BD Syringe Luer Lock Cascade Health | 302832 | |
| Alcian blue stain | EK Industries | 1198 | 1% w/v, pH 1.0 |
| Advanced DMEM | Gibco | 12491-015 | |
| αMEM | Gibco | 12571-063 | |
| Antibiotic-antimycotic | Gibco | 15240-062 | |
| Biopsy punch | Integra Miltex | 12-460-407 | |
| BODIPY® fluorophore | Molecular Probes | ||
| Bone morphogenic protein 7 (BMP7) | Peprotech | ||
| Curved forceps | Fisher Brand | 16100110 | |
| DMEM | Gibco | 11995-065 | Dulbecco’s Modified Eagle Medium |
| Dexmethasome | Sigma -Aldrich | 02-05-2002 | |
| E-Shell 450 photopolymer in | EnvisionTec | RES-01-4022 | |
| Fetal Bovine Serum | Gemini-Bio Products | 900-208 | |
| GlutaMAX | Gibco | 3505-061 | |
| gelatin from bovine skin | Hyclone | 1003372809 | |
| Hank’s Balanced Salt Solution | Sigma -Aldrich | SH30588.02 | |
| indomethacin | Sigma -Aldrich | I7378-56 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS) | Gibco | 51500-056 | |
| interleukin 1β | Peprotech | 200-01B | |
| Leur-loc connectors | Cole-Parmer Instruments | 45508-50 | |
| L-proline | Sigma -Aldrich | 115388-93-7 | |
| β-glycerophosphate | Sigma -Aldrich | 1003129352 | |
| Medium bags | KiYATEC | FC045 | |
| Methacrylic Anhydride | Sigma -Aldrich | 102378580 | |
| Phosphate buffered Saline | Corning | 21-040-CM | |
| Pointed forceps | Fisher Brand | 12000122 | |
| Silicon mold | McMaster-Carr | RC00114P | |
| Silicon o-rings | McMaster-Carr | ZMCCs1X5 | 1mm x 5mm |
| SolidWorks | Dassault Systèmes SE, Vélizy-Villacoublay, France | ||
| Surgical Blades | Integra Miltex | 4-122 | |
| Syringe pump | Lagato210P, KD Scientific | Z569631 | 10 syringe racks |
| T-182 tissue culture flasks | Fisher Brand | FB012939 | |
| Tissue Culture Dish 150 mm | Fisher Brand | FB012925 | |
| Transforming Growth Factor Beta (TGF-β3) | Peprotech | 100-36E | |
| Trypsin | Gibco | 25200-056 | |
| UV Flashlight | KBS | KB70109 | 395 nm |
| Vida Desktop 3D Printer | EnvisionTec | ||
| Vitamin D3 | Sigma -Aldrich | 32222-06-3 | 1,25-dihydroxyvitamin D3 |
Referências
- Safiri, S., et al. Global, regional and national burden of osteoarthritis 1990-2017: A systematic analysis of the Global Burden of Disease Study 2017. Annals of the Rheumatic Diseases. 79 (6), 819-828 (2020).
- Lawrence, R. C., et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States: Part II. Arthritis and Rheumatism. 58 (1), 26-35 (2008).
- Makarczyk, M. J., et al. Current models for development of disease-modifying osteoarthritis drugs. Tissue Engineering. Part C, Methods. 27 (2), 124-138 (2021).
- He, Y., et al. Pathogenesis of osteoarthritis: risk factors, regulatory pathways in chondrocytes, and experimental models. Biologia. 9 (8), 194 (2020).
- Ronaldson-Bouchard, K., Vunjak-Novakovic, G. Organs-on-a-chip: A fast track for engineered human tissues in drug development. Cell Stem Cell. 22 (3), 310-324 (2018).
- Lin, H., Sohn, J., Shen, H., Langhans, M. T., Tuan, R. S. Bone marrow mesenchymal stem cells: aging and tissue engineering applications to enhance bone healing. Biomaterials. 203, 96-110 (2019).
- Li, Z., et al. Human mesenchymal stem cell-derived miniature joint system for disease modeling and drug testing. Advanced Science. 9 (21), 2105909 (2022).
- Lin, H., Cheng, A. W., Alexander, P. G., Beck, A. M., Tuan, R. S. Cartilage tissue engineering application of injectable gelatin hydrogel with in situ visible-light-activated gelation capability in both air and aqueous solution. Tissue Engineering. Part A. 20 (17-18), 2402-2411 (2014).
- Fairbanks, B. D., Schwartz, M. P., Bowman, C. N., Anseth, K. S. Photoinitiated polymerization of PEG-diacrylate with lithium phenyl-2,4,6-trimethylbenzoylphosphinate: polymerization rate and cytocompatibility. Biomaterials. 30 (35), 6702-6707 (2009).
- Lin, H., Lozito, T. P., Alexander, P. G., Gottardi, R., Tuan, R. S. Stem cell-based microphysiological osteochondral system to model tissue response to interleukin-1β. Molecular Pharmaceutics. 11 (7), 2203-2212 (2014).
- Yin, B., et al. Hybrid macro-porous titanium ornamented by degradable 3D gel/nHA micro-scaffolds for bone tissue regeneration. International Journal of Molecular Sciences. 17 (4), 575 (2016).
- Lin, Z., et al. Osteochondral tissue chip derived from iPSCs: Modeling OA pathologies and testing drugs. Frontiers in Bioengineering and Biotechnology. 7, 411 (2019).
- Atukorala, I., et al. Synovitis in knee osteoarthritis: A precursor of disease. Annals of the Rheumatic Diseases. 75 (2), 390-395 (2016).
- Occhetta, P., et al. Hyperphysiological compression of articular cartilage induces an osteoarthritic phenotype in a cartilage-on-a-chip model. Nature Biomedical Engineering. 3 (7), 545-557 (2019).
- He, C., et al. Modeling early changes associated with cartilage trauma using human-cell-laden hydrogel cartilage models. Stem Cell Research and Therapy. 13 (1), 400 (2022).
- Elsissy, J. G., et al. Bacterial septic arthritis of the adult native knee joint: A review. JBJS Reviews. 8 (1), 0059 (2020).
- Romero-Lopez, M., et al. Macrophage effects on mesenchymal stem cell osteogenesis in a three-dimensional in vitro bone model. Tissue Engineering. Part A. 26 (19-20), 1099-1111 (2020).

