Modellering van hersenmetastase door interne halsslagaderinjectie van kankercellen
Summary
Hersenmetastase is een oorzaak van ernstige morbiditeit en mortaliteit bij kankerpatiënten. De meeste muismodellen voor hersenmetastasen worden gecompliceerd door systemische metastasen die de analyse van mortaliteit en therapeutische interventie-uitkomsten verstoren. Hier gepresenteerd is een protocol voor interne carotisinjectie van kankercellen dat consistente intracraniale tumoren produceert met minimale systemische tumoren.
Abstract
Hersenmetastase is een oorzaak van ernstige morbiditeit en mortaliteit bij kankerpatiënten. Kritische aspecten van gemetastaseerde ziekten, zoals de complexe neurale micro-omgeving en stromale celinteractie, kunnen niet volledig worden gerepliceerd met in vitro assays; diermodellen zijn dus van cruciaal belang voor het onderzoeken en begrijpen van de effecten van therapeutische interventie. De meeste xenotransplantatiemethoden voor hersentumoren produceren echter niet consistent hersenmetastasen in termen van het tijdsbestek en de tumorlast. Hersenmetastasemodellen gegenereerd door intracardiale injectie van kankercellen kunnen leiden tot onbedoelde extracraniële tumorbelasting en leiden tot niet-hersenmetastase morbiditeit en mortaliteit. Hoewel intracraniale injectie van kankercellen de extracraniële tumorvorming kan beperken, heeft het verschillende kanttekeningen, zoals de geïnjecteerde cellen vormen vaak een enkelvoudige tumormassa op de injectieplaats, hoge leptomeningeale betrokkenheid en schade aan de vasculatuur van de hersenen tijdens naaldpenetratie. Dit protocol beschrijft een muismodel van hersenmetastasen gegenereerd door interne halsslagaderinjectie. Deze methode produceert intracraniale tumoren consequent zonder de betrokkenheid van andere organen, waardoor de evaluatie van therapeutische middelen voor hersenmetastase mogelijk wordt.
Introduction
Hersenmetastase is een veel voorkomende maligniteit geassocieerd met een zeer slechte prognose 1,2. De standaardzorg voor patiënten met hersenmetastase is multimodaal, bestaande uit neurochirurgie, radiotherapie van de hele hersenen en / of stereotactische radiochirurgie, afhankelijk van de algemene gezondheidstoestand van de patiënt, extracraniële ziektelast en het aantal en de locatie van tumoren in de hersenen 3,4. Patiënten met maximaal drie intracraniale laesies komen in aanmerking voor chirurgische resectie of stereotactische radiochirurgie, terwijl bestralingstherapie van de hele hersenen wordt aanbevolen voor patiënten met meerdere laesies om het risico op operatiegerelateerde infectie en oedeem te voorkomen5. Radiotherapie van de hele hersenen kan echter schade toebrengen aan radiogevoelige hersenstructuren, wat bijdraagt aan een slechte kwaliteit van leven6.
Systemische therapie is een niet-invasieve alternatieve en logische benadering voor de behandeling van patiënten met meerdere laesies7. Het wordt echter minder overwogen vanwege het al lang bestaande idee dat systemische therapieën een slechte werkzaamheid hebben omdat de passieve toediening van cytotoxische geneesmiddelen via de bloedbaan geen therapeutische niveaus in de hersenen kan bereiken zonder het risico op onveilige toxiciteit8. Dit paradigma begint te veranderen met de onlangs door de Amerikaanse Food and Drug Administration (FDA) goedgekeurde systemische therapie (tucatinib met trastuzumab en capecitabine geïndiceerd voor gemetastaseerde HER2 + borstkanker hersenmetastase)9,10,11,12 en de update in behandelingsrichtlijnen om rekening te houden met systemische therapieopties voor hersenmetastasen patiënten 13,14.
In deze context kunnen ontwikkelingen op het gebied van moleculaire gerichte therapie, immunotherapie en alternatieve toedieningssystemen voor geneesmiddelen, zoals een gerichte nanogeneesmiddeldrager, mogelijk de uitdagingen van de behandeling van hersenmetastasen overwinnen 15,16,17,18. Daarnaast worden ook chemische en mechanische benaderingen onderzocht om de medicijnafgifte te verbeteren via permeabilisatie van de hersentumorbarrière19,20. Om dergelijke benaderingen te bestuderen en te optimaliseren om geschikt te zijn voor het doel, is het cruciaal om preklinische modellen te gebruiken die niet alleen de complexe fysiologie van hersenmetastase weerspiegelen, maar ook een objectieve analyse van intracraniale geneesmiddelrespons mogelijk maken.
In grote lijnen omvatten de huidige benaderingen om hersenmetastasen in vivo te modelleren intracardiale (linker ventrikel), intraveneuze (meestal staartader), intracraniale of intracarotis (gemeenschappelijke halsslagader) injectie van kankercellen bij muizen 21,22,23,24,25,26,27 . Afgezien van tumortransplantatiestrategieën, zijn genetisch gemanipuleerde muismodellen waarbij tumorvorming wordt geactiveerd door de verwijdering van tumorsuppressorgenen of activering van oncogenen nuttig voor tumormodellering. Er wordt echter gemeld dat slechts een paar genetisch gemanipuleerde muismodellen secundaire tumoren produceren en nog minder die betrouwbaar hersenmetastasen produceren 28,29,30.
Engraftmentmethoden zoals intracardiale (linker ventrikel) en intraveneuze (meestal staartader) injectie bootsen de systemische verspreiding van kanker na. Deze modellen produceren meestal laesies in meerdere organen (bijv. Hersenen, longen, lever, nieren, milt), afhankelijk van het capillaire bed dat de meeste tumorcellen gevangen houdt tijdens hun circulerende ‘first pass’31. Inconsistente snelheden van hersentransplantatie zullen echter meer dieren vereisen om de steekproefgrootte voor de gewenste statistische kracht te bereiken. Het aantal tumorcellen dat zich uiteindelijk via deze intracardiale en intraveneuze injectiemethoden in de hersenen nestelt, is variabel. Vandaar dat de tumorlast van hersenmetastase kan variëren tussen dieren en het verschil in progressie kan het standaardiseren van de experimentele tijdlijn en interpretatie van resultaten een uitdaging maken. De extracraniële tumorlast kan leiden tot niet-hersenmetastasesterfte, waardoor deze modellen ongeschikt zijn voor het evalueren van intracraniale werkzaamheid. Hersentropencellijnen zijn vastgesteld met behulp van kunstmatige klonale selectieprocessen om extracraniële vestiging te verminderen, maar de opnamesnelheden zijn inconsistent geweest en het klonale selectieproces kan de heterogeniteit verminderen die normaal wordt aangetroffen in menselijke tumoren32.
Hersenspecifieke engraftmentmethoden zoals de intracraniale en intracarotide-injectie zorgen voor een consistentere en efficiëntere modellering van hersenmetastase. In de intracraniale methode33 worden kankercellen meestal geïnjecteerd in de frontale hersenschors, die een snelle en reproduceerbare tumoruitgroei genereert met een lage systemische betrokkenheid. Hoewel de procedure goed wordt verdragen met een lage mortaliteit33, zijn de kanttekeningen dat het een relatief ruwe benadering is die snel een (gelokaliseerde) bolus van cellen in de hersenen introduceert en geen vroege pathogenese van hersenmetastase modelleert. De naald beschadigt de vasculatuur van hersenweefsel, wat vervolgens een gelokaliseerde ontsteking veroorzaakt 5,34. Uit ervaring is er een tendens voor tumorcelinjectaat tot reflux tijdens het verwijderen van de naald, wat leidt tot leptomeningeale betrokkenheid. Als alternatief levert de intracarotidemethode cellen in de gemeenschappelijke halsslagader met hersenmicrovasculatuur als het eerste capillaire bed dat wordt aangetroffen, waarbij overleving in circulatie, extravasatie en kolonisatie wordt gemodelleerd24. In overeenstemming met anderen25, bleek uit onze ervaring met deze methode dat het kan resulteren in gezichtstumoren als gevolg van onbedoelde afgifte van kankercellen via de externe halsslagader naar capillaire bedden in deze weefsels (ongepubliceerde gegevens). Het is mogelijk om gezichtstumoren te voorkomen door eerst de uitwendige halsslagader te bruinen voordat de gemeenschappelijke injectie van de halsslagader wordt geadopteerd (figuur 1). In de rest van het artikel wordt deze methode de ‘interne halsslagaderinjectie’ genoemd. Uit ervaring blijkt dat de interne carotisslagaderinjectiemethode consequent hersenmetastasen genereert met zeer weinig systemische gebeurtenissen en succesvol is geweest in het genereren van hersenmetastasemodellen van verschillende primaire kankers (bijv. Melanoom, borst- en longkanker) (figuur 1). De nadelen zijn dat het technisch uitdagend, tijdrovend, invasief is en een zorgvuldige optimalisatie van celaantallen en een monitoringtijdlijn vereist. Samenvattend produceren zowel de intracraniale als de interne carotisslagaderinjectiemethoden muismodellen die geschikt zijn voor het evalueren van de therapeutische impact op het overlevingsvoordeel van hersentumoren.
Dit protocol beschrijft de interne halsslagaderinjectiemethode om een muismodel van hersenmetastase te produceren met bijna geen systemische betrokkenheid en daarom geschikt voor preklinische evaluatie van medicijndistributie en werkzaamheid van experimentele therapieën.
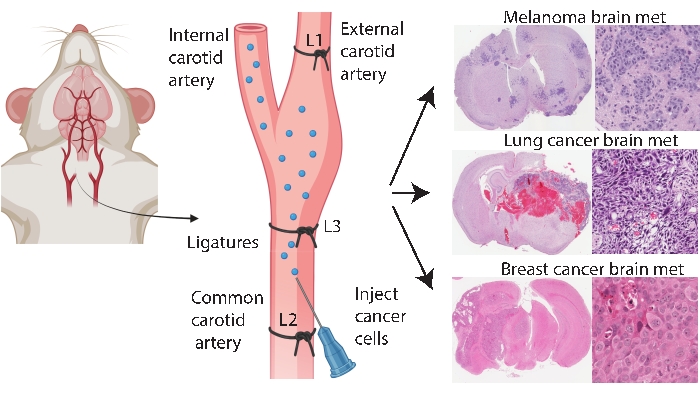
Figuur 1: Schematische weergave van het interne carotisslagaderinjectieprotocol voor hersenmetastasen. Interne halsslagaderinjectie met externe ligatie van de halsslagader kan op betrouwbare wijze een hersenmetastasemodel produceren van verschillende primaire kankers. In dit protocol worden drie ligaturen op de halsslagader geplaatst (geannoteerd als L1-L3 in de figuur). Klik hier om een grotere versie van deze figuur te bekijken.
Protocol
Representative Results
Discussion
Hersenmetastase is een complex proces van kankercellen die zich verspreiden van hun primaire plaats naar de hersenen. Er zijn verschillende diermodellen beschikbaar die bepaalde stadia van dit meerstappenproces weerspiegelen en er zijn fysiologische en praktische overwegingen voor het ontwerpen van preklinische metastasestudies41,42. De meeste gepubliceerde studies die het gebruik van nanogeneeskunde voor de behandeling van hersenmetastase onderzoeken, hebben<sup…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dit onderzoek werd gefinancierd door de Australian National Health and Medical Research Council (NHMRC), subsidienummer APP1162560. ML werd gefinancierd door een UQ postdoctorale onderzoeksbeurs. We willen iedereen bedanken die heeft geholpen met het houden van dieren en in vivo beeldvorming van de dieren. We bedanken het Royal Brisbane and Women’s Hospital voor het doneren van aliquots zirkonium voor deze studie.
Materials
| 100µm cell strainer | Corning | CLS431752 | |
| 30G Microlance needle | BD | 23748 | |
| 31G Ultra-Fine II insulin syringe | BD | 326103 | |
| Angled forceps | Proscitech | T67A-SS | Fine pointed, angled without serrations, 18mm tip, length 128 mm |
| Animal heat mat | |||
| Antibiotic and antimycotic | ThermoFisher Scientific | 15240062 | |
| Autoclave bags | |||
| BT-474 (HTB-20) breast cancer cell line | ATCC | HTB-20 | |
| Buprenorphine (TEMGESIC) | |||
| Countess cell counter | ThermoFisher Scientific | C10227 | |
| Diet-76A | ClearH2O | 72-07-5022 | |
| Dissection microscope | |||
| Ear puncher | |||
| Electric clippers | |||
| Fine angled forceps | Proscitech | DEF11063-07 | Angled 45°, Tip smooth, Tip width: 0.4 mm, Tip dimension: 0.4 x 0.3 mm, length 9cm |
| Fine tubing for cannula, Tubing OD (in) 1/32, Tubing ID (in) 1/100in | Cole Parmer | EW-06419-00 | |
| Foetal bovine serum | ThermoFisher Scientific | 26140079 | |
| Hank's Balanced Salt Solution without calcium and magnesium | ThermoFisher Scientific | 14170120 | |
| Hydrogel | ClearH2O | 70-01-5022 | |
| Isoflurane | |||
| Kimwipes Low lint disposable wipers | Kimberly Clark- Kimwipes | Z188964 | |
| Mashed mouse chow | |||
| Meloxicam (METACAM) | |||
| Nose cone | Fashioned out of a microfuge tube | ||
| PAA ocular lubricant (Carbomer 2mg/g) | Bausch and lomb | ||
| Povidone-iodine solution | Betadine | 2505692 | |
| PPE (glove, mask, gown, hairnet) | |||
| Retractors | Kent Scientific | SURGI-5001 | |
| RPMI 1640 Media | ThermoFisher Scientific | 11875093 | |
| Silk suture 13mm 5-0, P3, 45cm | Ethicon | JJ-640G | |
| Sterile normal saline | ThermoFisher Scientific | TM4469 | |
| Sticky tape | |||
| Surgical board | A chopping board wrapped with autoclavable bag. | ||
| Surgical scissors | Proscitech | T104 | Tip Dimensions (LxD): 38x7mm, Length 115mm |
| Suture forcep/ Curved Brophy forceps | Proscitech | T113C | Curved, Rounded narrow 2 mm tip, with serrations, length 165 mm |
| Suture needle holder (Olsen Hegar needle holder) | Proscitech | TC1322-180 | length 190 mm, ratchet clamp |
| Syringe driver with foot pedal/ UMP3 Ultra micro pump | World Precision Instruments | UMP3-3 | |
| T75 tissue culture flask | ThermoFisher Scientific | 156499 | |
| Thread | |||
| Trigene II surface disinfectant | Ceva | ||
| Trypan Blue and Cell Counting Chamber Slides | ThermoFisher Scientific | C10228 | |
| TrypLE Express dissociating medium | ThermoFisher Scientific | 12605010 |
Referências
- Nayak, L., Lee, E. Q., Wen, P. Y. Epidemiology of brain metastases. Current Oncology Reports. 14 (1), 48-54 (2012).
- . Australian Institute of Health and Welfare. Cancer in Australia. , (2017).
- Maher, E. A., Mietz, J., Arteaga, C. L., DePinho, R. A., Mohla, S. Brain metastasis: opportunities in basic and translational research. Pesquisa do Câncer. 69 (15), 6015-6020 (2009).
- Lin, N. U. Breast cancer brain metastases: new directions in systemic therapy. Ecancermedicalscience. 7, (2013).
- Zimmer, A. S., Van Swearingen, A. E. D., Anders, C. K. HER2-positive breast cancer brain metastasis: A new and exciting landscape. Cancer Reports. 5 (4), (2020).
- Brown, P. D., et al. Postoperative stereotactic radiosurgery compared with whole brain radiotherapy for resected metastatic brain disease (NCCTG N107C/CEC·3): a multicentre, randomised, controlled, phase 3 trial. Lancet Oncology. 18 (8), 1049-1060 (2017).
- Murrell, J., Board, R. The use of systemic therapies for the treatment of brain metastases in metastatic melanoma: Opportunities and unanswered questions. Cancer Treatment Reviews. 39 (8), 833-838 (2013).
- Stemmler, H. J., et al. Ratio of trastuzumab levels in serum and cerebrospinal fluid is altered in HER2-positive breast cancer patients with brain metastases and impairment of blood-brain barrier. Anticancer Drugs. 18 (1), 23-28 (2007).
- Venur, V. A., Leone, J. P. Targeted therapies for brain metastases from breast cancer. International Journal of Molecular Sciences. 17 (9), 1543 (2016).
- Murthy, R., et al. Tucatinib with capecitabine and trastuzumab in advanced HER2-positive metastatic breast cancer with and without brain metastases: a non-randomised, open-label, phase 1b study. The Lancet Oncology. 19 (7), 880-888 (2018).
- Murthy, R. K., et al. trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. New England Journal of Medicine. 382 (7), 597-609 (2019).
- Shah, M., et al. FDA approval summary: Tucatinib for the treatment of patients with advanced or metastatic HER2-positive breast cancer. Clinical Cancer Research. 27 (5), 1220-1226 (2021).
- Vogelbaum, M. A., et al. Treatment for brain metastases: ASCO-SNO-ASTRO guideline. Journal of Clinical Oncology. 40 (5), 492-516 (2021).
- Ramakrishna, N., et al. Management of advanced human epidermal growth factor receptor 2-positive breast cancer and brain metastases: ASCO guideline update. Journal of Clinical Oncology. 10, (2022).
- Li, J., et al. A multifunctional polymeric nanotheranostic system delivers doxorubicin and imaging agents across the blood-brain barrier targeting brain metastases of breast cancer. ACS Nano. 8 (10), 9925-9940 (2014).
- Mittapalli, R. K., et al. Paclitaxel-hyaluronic nanoconjugates prolong overall survival in a preclinical brain metastases of breast cancer model. Molecular Cancer Therapeutics. 12 (11), 2389-2399 (2013).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Patil, R., et al. MRI virtual biopsy and treatment of brain metastatic tumors with targeted nanobioconjugates: nanoclinic in the brain. ACS Nano. 9 (5), 5594-5608 (2015).
- Brighi, C., et al. MR-guided focused ultrasound increases antibody delivery to non-enhancing high-grade glioma. Neuro-Oncology Advances. 2 (1), (2020).
- Inamura, T., Black, K. L. Bradykinin selectively opens blood-tumor barrier in experimental brain tumors. Journal of Cerebral Blood Flow & Metabolism. 14 (5), 862-870 (1994).
- Priego, N., et al. Abstract 2746: Stat3 labels a subpopulation of reactive astrocytes required for brain metastasis. Pesquisa do Câncer. 79, 2746 (2019).
- Wyatt, E. A., Davis, M. E. Method of establishing breast cancer brain metastases affects brain uptake and efficacy of targeted, therapeutic nanoparticles. Bioengineering & Translational Medicine. 4 (1), 30-37 (2018).
- Nakayama, J., et al. The in vivo selection method in breast cancer metastasis. International Journal of Molecular Sciences. 22 (4), 1886 (2021).
- Zhang, C., Lowery, F. J., Yu, D. Intracarotid cancer cell injection to produce mouse models of brain metastasis. Journal of Visualized Experiments. 120, 55085 (2017).
- Liu, Z., et al. Improving orthotopic mouse models of patient-derived breast cancer brain metastases by a modified intracarotid injection method. Scientific Reports. 9 (1), 622 (2019).
- Bos, P. D., et al. Genes that mediate breast cancer metastasis to the brain. Nature. 459, 1005-1009 (2009).
- Hu, X., Villodre, E. S., Woodward, W. A., Debeb, B. G. Modeling brain metastasis via tail-vein injection of inflammatory breast cancer cells. Journal of Visualized Experiments. 168, (2021).
- Cho, J. H., et al. AKT1 activation promotes development of melanoma metastases. Cell Reports. 13 (5), 898-905 (2015).
- Meuwissen, R., et al. Induction of small cell lung cancer by somatic inactivation of both Trp53 and Rb1 in a conditional mouse model. Cancer Cell. 4 (3), 181-189 (2003).
- Kato, M., et al. Transgenic mouse model for skin malignant melanoma. Oncogene. 17 (14), 1885-1888 (1998).
- Khanna, C., Hunter, K. Modeling metastasis in vivo. Carcinogenesis. 26 (3), 513-523 (2005).
- Sulaiman, A., Wang, L. Bridging the divide: preclinical research discrepancies between triple-negative breast cancer cell lines and patient tumors. Oncotarget. 8 (68), 113269-113281 (2017).
- Pierce, A. M., Keating, A. K. Creating anatomically accurate and reproducible intracranial xenografts of human brain tumors. Journal of Visualized Experiments. 91, 52017 (2014).
- Geisler, J. A., et al. Modeling brain metastases through intracranial injection and magnetic resonance imaging. Journal of Visualized Experiments. 160, (2020).
- Reid, Y., Storts, D., Riss, T., Minor, L., et al. . in Assay Guidance Manual. eds Markossian, S. et al.) Eli Lilly & Company and the National Center for Advancing Translational Sciences. , (2004).
- Janowicz, P. W., et al. Understanding nanomedicine treatment in an aggressive spontaneous brain cancer model at the stage of early blood brain barrier disruption. Biomaterials. , 283 (2022).
- Houston, Z. H., et al. Understanding the Uptake of Nanomedicines at Different Stages of Brain Cancer Using a Modular Nanocarrier Platform and Precision Bispecific Antibodies. ACS Cent Sci. 6 (5), 727-738 (2020).
- Matsumura, Y., Maeda, H. A new concept for macromolecular therapeutics in cancer chemotherapy: mechanism of tumoritropic accumulation of proteins and the antitumor agent smancs. Pesquisa do Câncer. 46, 6387-6392 (1986).
- Clemons, T. D., et al. Distinction between active and passive targeting of nanoparticles dictate their overall therapeutic efficacy. Langmuir. 34 (50), 15343-15349 (2018).
- Wu, J., et al. Transcardiac perfusion of the mouse for brain tissue dissection and fixation. Bio-Protocol. 11 (5), (2021).
- Masmudi-Martín, M., et al. Brain metastasis models: What should we aim to achieve better treatments. Advanced Drug Delivery Reviews. 169 (20), 79-99 (2021).
- Carney, C. P., et al. Harnessing nanomedicine for enhanced immunotherapy for breast cancer brain metastases. Drug Delivery and Translational Research. 11 (6), 2344-2370 (2021).
- Hamilton, A. M., et al. Nanoparticles coated with the tumor-penetrating peptide iRGD reduce experimental breast cancer metastasis in the brain. Journal of Molecular Medicine. 93 (9), 991-1001 (2015).
- Bao, Y., et al. Synergistic chemotherapy for breast cancer and breast cancer brain metastases via paclitaxel-loaded oleanolic acid nanoparticles. Molecular Pharmaceutics. 17 (4), 1343-1351 (2020).
- Kotb, S., et al. Gadolinium-based nanoparticles and radiation therapy for multiple brain melanoma metastases: Proof of concept before phase I trial. Theranostics. 6 (3), 418-427 (2016).
- Zhang, T., et al. Multitargeted nanoparticles deliver synergistic drugs across the blood-brain barrier to brain metastases of triple negative breast cancer cells and tumor-associated macrophages. Advanced Healthcare Materials. 8 (18), 1900543 (2019).
- He, C., et al. Blood-brain barrier-penetrating amphiphilic polymer nanoparticles deliver docetaxel for the treatment of brain metastases of triple negative breast cancer. Journal of Controlled Release. 246, 98-109 (2017).
- Wang, X., et al. Enhanced anti-brain metastasis from non-small cell lung cancer of osimertinib and doxorubicin co-delivery targeted nanocarrier. International Journal of Nanomedicine. 15, 5491-5501 (2020).
- Gries, M., et al. Multiscale selectivity and in vivo biodistribution of NRP-1-targeted theranostic AGuIX nanoparticles for PDT of glioblastoma. International Journal of Nanomedicine. 15, 8739-8758 (2020).

