טיהור פוליזום מגושים סימביוטיים של פולי סויה
Summary
פרוטוקול זה מתאר שיטה לטיהור פוליזום אאוקריוטי מגושי סויה שלמים. לאחר הריצוף, ניתן להשתמש בצינורות סטנדרטיים לניתוח ביטוי גנים כדי לזהות גנים המתבטאים באופן דיפרנציאלי ברמות השעתוק והטרנסלטום.
Abstract
מטרת פרוטוקול זה היא לספק אסטרטגיה לחקר הטרנסלטום האאוקריוטי של הגולם הסימביוטי של פולי הסויה (גליצין מקס). מאמר זה מתאר שיטות הממוטבות לבידוד פוליריבוזומים שמקורם בצמחים ואת ה-mRNA הקשורים אליהם לניתוח באמצעות ריצוף RNA. ראשית, ליזאטים ציטופלסמיים מתקבלים באמצעות הומוגניזציה בתנאים משמרים פוליזום ורנ”א מגושים שלמים וקפואים של פולי סויה. לאחר מכן, הליזטים מנוקים על ידי צנטריפוגה במהירות נמוכה, ו-15% מהסופר-נאטנט משמש לבידוד RNA כולל (TOTAL). הליזאט המנוקה הנותר משמש לבידוד פוליזומים על ידי אולטרה-צנטריפוגציה באמצעות כרית סוכרוז דו-שכבתית (12% ו-33.5%). mRNA הקשור לפוליזום (PAR) מטוהר מכדורים פוליסומליים לאחר חידוש. הן TOTAL והן PAR מוערכים על ידי אלקטרופורזה נימית רגישה ביותר כדי לעמוד בתקני האיכות של ספריות ריצוף עבור RNA-seq. כדוגמה ליישום במורד הזרם, לאחר ריצוף, ניתן להשתמש בצינורות סטנדרטיים לניתוח ביטוי גנים כדי לקבל גנים המתבטאים באופן דיפרנציאלי ברמות השעתוק והטרנסלטום. לסיכום, שיטה זו, בשילוב עם RNA-seq, מאפשרת לחקור את הוויסות התרגומי של mRNA אאוקריוטי ברקמה מורכבת כגון הגולם הסימביוטי.
Introduction
צמחים קטניים, כגון סויה (גליצין מקס), יכולים לבסס סימביוזה עם חיידקי אדמה ספציפיים הנקראים ריזוביה. מערכת יחסים הדדית זו מעוררת את היווצרותם של איברים חדשים, הגושים הסימביוטיים, על שורשי הצמח. הגושים הם האיברים הצמחיים המארחים את החיידקים ומורכבים מתאים מארחים שהציטופלסמה שלהם מיושבת עם צורה מיוחדת של ריזוביה הנקראת חיידקים. חיידקים אלה מזרזים את הפחתת החנקן האטמוספרי (N 2) לאמוניה, אשר מועבר לצמח בתמורה לפחמימות 1,2.
אף על פי שסימביוזה זו של קיבוע חנקן היא אחת הסימביוזה בין צמחים למיקרובים הנחקרים ביותר, היבטים רבים עדיין צריכים להיות מובנים טוב יותר, כגון כיצד צמחים הנתונים לתנאי עקה אביוטיים שונים מווסתים את האינטראקציה שלהם עם השותף הסימביוטי שלהם וכיצד זה משפיע על חילוף החומרים של הגולם. ניתן היה להבין טוב יותר תהליכים אלה על ידי ניתוח טרנסלטום הגולם (כלומר, תת-הקבוצה של רנ”א שליח [mRNAs] המתורגמת באופן פעיל). פוליריבוזומים או פוליזומים הם קומפלקסים של ריבוזומים מרובים הקשורים ל-mRNA, המשמשים בדרך כלל לחקר תרגום3. שיטת פרופיל הפוליזום מורכבת מניתוח ה-mRNA הקשורים לפוליזומים ושימשה בהצלחה לחקר המנגנונים הפוסט-טרנספורמטיביים השולטים בביטוי גנים המתרחשים בתהליכים ביולוגיים מגוונים 4,5.
מבחינה היסטורית, ניתוח ביטוי הגנום התמקד בעיקר בקביעת שפע mRNA 6,7,8,9. עם זאת, קיים חוסר מתאם בין רמות התעתיק לרמות החלבון בשל השלבים השונים של ויסות פוסט-טרנספורמטיבי של ביטוי גנים, במיוחד תרגום10,11,12. יתר על כן, לא נצפתה תלות בין השינויים ברמת התעתיק לבין אלה המתרחשים ברמה של translatome13. הניתוח הישיר של קבוצת ה-mRNA המתורגמת מאפשר מדידה מדויקת ומלאה יותר של ביטוי הגנים בתאים (שנקודת הקצה שלהם היא שפע חלבונים) מזו המתקבלת כאשר מנותחות רק רמות mRNA14,15,16.
פרוטוקול זה מתאר כיצד פוליזומים ממקור צמחי מטוהרים מגושי סויה שלמים על-ידי צנטריפוגה דיפרנציאלית באמצעות כרית סוכרוז דו-שכבתית (איור 1). עם זאת, מכיוון שריבוזומים שמקורם בבקטרואיד נמצאים גם בגושים, תערובת של ריבוזומים ומיני RNA מטוהרים, למרות שהאאוקריוטים מייצגים את החלק העיקרי (90%-95%). כמו כן מתוארים הבידוד, הכימות ובקרת האיכות של הרנ”א הבאים (איור 1). פרוטוקול זה, בשילוב עם RNA-seq, אמור לספק תוצאות ניסיוניות על הוויסות התרגומי של mRNA אאוקריוטי ברקמה מורכבת כגון הגולם הסימביוטי.
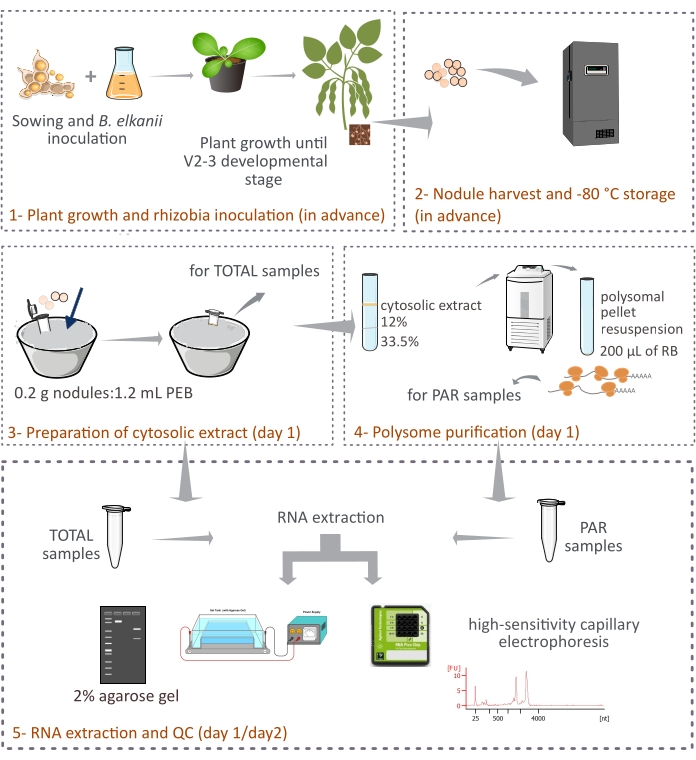
איור 1: סקירה סכמטית של המתודולוגיה המוצעת לטיהור פוליזום אאוקריוטי מגושים סימביוטיים. התוכנית נותנת סקירה של השלבים הבאים בפרוטוקול מ-(1) גידול צמחים ו-(2) קציר גולמים ועד (3) הכנת התמציות הציטוזוליות, (3) קבלת דגימות TOTAL ו-(4) דגימות PAR, ו-(5) מיצוי RNA ובקרת איכות. קיצורים: PEB = מאגר מיצוי פוליזום; RB = חיץ resuspension; סה”כ = סך רנ”א; PAR = mRNA הקשור לפוליזום. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Protocol
Representative Results
Discussion
חקר ויסות ביטוי גנים ברמת התרגום הוא קריטי להבנה טובה יותר של תהליכים ביולוגיים שונים, שכן נקודת הקצה של ביטוי גנים בתאים היא שפע חלבונים13,14. ניתן להעריך זאת על ידי ניתוח הטרנסלטום של הרקמה או האורגניזם המעניין שעבורו יש לטהר את השבר הפוליסומלי ואת ה- mRNAs הקש…
Declarações
The authors have nothing to disclose.
Acknowledgements
מחקר זה מומן על ידי מענק CSIC I+D 2020 מס ‘ 282, מענק FVF 2017 מס ‘ 210, ו- PEDECIBA (מריה מרתה סיינז).
Materials
| Plant growth and rhizobia inoculation | |||
| Orbital shaker | Daihan Scientific | Model SHO-1D | |
| YEM-medium | Amresco | J850 (yeast extract) 0122 (mannitol) | |
| Water deficit treatment | |||
| KNO3 | Merck | 221295 | |
| Porometer | Decagon Device | Model SC-1 | |
| Scalpel | |||
| Preparation of cytosolic extracts | |||
| Brij L23 | Sigma-Aldrich | P1254 | |
| Centrifuge | Sigma | Model 2K15 | |
| Chloranphenicol | Sigma-Aldrich | C0378 | |
| Cycloheximide | Sigma-Aldrich | C7698 | |
| DOC | Sigma-Aldrich | 30970 | |
| DTT | Sigma-Aldrich | D9779 | |
| EGTA | Sigma-Aldrich | E3889 | |
| Igepal CA 360 | Sigma-Aldrich | I8896 | |
| KCl | Merck | 1.04936 | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| Plastic tissue grinder | Fisher Scientific | 12649595 | |
| PMSF | Sigma-Aldrich | P7626 | |
| PTE | Sigma-Aldrich | P2393 | |
| Tris | Invitrogen | 15504-020 | |
| Triton X-100 | Sigma-Aldrich | T8787 | |
| Tween 20 | Sigma-Aldrich | P1379 | |
| Weighing dish | Deltalab | 1911103 | |
| Preparation of sucrose cushions | |||
| Sucrose | Invitrogen | 15503022 | |
| SW 40 Ti rotor | Beckman-Coulter | ||
| Ultracentrifuge | Beckman-Coulter | Optima L-100K | |
| Ultracentrifuge tubes | Beckman-Coulter | 344059 | 13.2 mL tubes |
| RNA extraction and quality control | |||
| Agarose | Thermo scientific | R0492 | |
| Bioanalyzer | Agilent | Model 2100. Eukaryote total RNA nano assay | |
| Chloroform | DI | 41191 | |
| Ethanol | Dorwil | UN1170 | |
| Isopropanol | Mallinckrodt | 3032-06 | |
| Glycogen | Sigma | 10814-010 | |
| TRIzol LS | Ambion | 102960028 | |
| Miscellaneous | |||
| Falcon tubes 15 mL | Biologix | 10-0152 | |
| Filter tips 10 µL | BioPointe Scientific | 321-4050 | |
| Filter tips 1000 µL | BioPointe Scientific | 361-1050 | |
| Filter tips 20 µL | BioPointe Scientific | 341-4050 | |
| Filter tips 200 µL | Tarsons | 528104 | |
| Microcentrifuge tubes 1.5 mL | Tarsons | 500010-N | |
| Microcentrifuge tubes 2.0 mL | Tarsons | 500020-N | |
| Sequencing company | Macrogen | ||
| Sterile 250 mL flask | Marienfeld | 4110207 |
Referências
- Limpens, E., et al. Cell- and tissue-specific transcriptome analyses of Medicago truncatula root nodules. PLoS ONE. 8 (5), 64377 (2013).
- Masson-Boivin, C., Giraud, E., Perret, X., Batut, J. Establishing nitrogen-fixing symbiosis with legumes: How many rhizobium recipes. Trends in Microbiology. 17 (10), 458-466 (2009).
- King, H. A., Gerber, A. P. Translatome profiling: Methods for genome-scale analysis of mRNA translation. Briefings in Functional Genomics. 15 (1), 22-31 (2014).
- Chassé, H., Boulben, S., Costache, V., Cormier, P., Morales, J. Analysis of translation using polysome profiling. Nucleic Acids Research. 45 (3), 15 (2017).
- Yángüez, E., Castro-Sanz, A. B., Fernández-Bautista, N., Oliveros, J. C., Castellano, M. M. Analysis of genome-wide changes in the translatome of Arabidopsis seedlings subjected to heat stress. PloS ONE. 8 (8), 71425 (2013).
- Brown, P. O., Botstein, D. Exploring the new world of the genome with DNA microarrays. Nature Genetics. 21, 33-37 (1999).
- Krishnamurthy, A., Ferl, R. J., Paul, A. -. L. Comparing RNA-Seq and microarray gene expression data in two zones of the Arabidopsis root apex relevant to spaceflight. Applications in Plant Sciences. 6 (11), 1197 (2018).
- Shulse, C. N., et al. High-throughput single-cell transcriptome profiling of plant cell types. Cell Reports. 27 (7), 2241-2247 (2019).
- Wang, Z., Gerstein, M., Snyder, M. RNA-Seq: A revolutionary tool for transcriptomics. Nature Reviews Genetics. 10 (1), 57-63 (2009).
- Kawaguchi, R., Girke, T., Bray, E. A., Bailey-Serres, J. Differential mRNA translation contributes to gene regulation under non-stress and dehydration stress conditions in Arabidopsis thaliana. The Plant Journal. 38 (5), 823-839 (2004).
- Larsson, O., Tian, B., Sonenberg, N. Toward a genome-wide landscape of translational control. Cold Spring Harbor Perspectives in Biology. 5 (1), 012302 (2013).
- Vogel, C., Marcotte, E. M. Insights into regulation of protein abundance from proteomics and transcriptomis analyses. Nature Reviews Genetics. 13 (4), 227-232 (2013).
- Tebaldi, T., et al. Widespread uncoupling between transcriptome and translatome variations after a stimulus in mammalian cells. BMC Genomics. 13 (220), 1-15 (2012).
- Wang, T., et al. Translating mRNAs strongly correlate to proteins in a multivariate manner and their translation ratios are phenotype specific. Nucleic Acids Research. 41 (9), 4743-4754 (2013).
- Ingolia, N. T. Ribosome profiling: New views of translation, from single codons to genome scale. Nature Reviews Genetics. 15 (3), 205-213 (2014).
- Lukoszek, R., Feist, P., Ignatova, Z. Insights into the adaptive response of Arabidopsis thaliana to prolonged thermal stress by ribosomal profiling and RNA-Seq. BMC Plant Biology. 16 (1), 1-13 (2016).
- Broughton, W. J., Dilworth, M. J. Control of leghaemoglobin synthesis in snake beans. Biochemical Journal. 125 (4), 1075-1080 (1971).
- Schroeder, A., et al. The RIN: An RNA integrity number for assigning integrity values to RNA measurements. BMC Molecular Biology. 7, 1-14 (2006).
- Rio, D. C., Ares, M., Hannon, G. J., Nilsen, T. W. Nondenaturing agarose gel electrophoresis of RNA nondenaturing agarose gel electrophoresis of RNA. Cold Spring Harbor Protocols. 2010 (6), 1-3 (2012).
- Ewels, P., Magnusson, M., Lundin, S., Käller, M. MultiQC: Summarize analysis results for multiple tools and samples in a single report. Bioinformatics. 32 (19), 3047-3048 (2016).
- Bolger, A. M., Lohse, M., Usadel, B. Trimmomatic: A flexible trimmer for Illumina sequence data. Bioinformatics. 30 (15), 2114-2120 (2014).
- Marcel, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet.journal. 17 (1), 10-12 (2011).
- . Sickle: A sliding-window, adaptive, quality-based trimming tool for FastQ files (Version 1.33) Available from: https://github.com/najoshi/sickle (2011)
- Langmead, B., Salzberg, S. L. Fast gapped-read alignment with Bowtie 2. Nature Methods. 9 (4), 357-359 (2012).
- Kim, D., et al. TopHat2: Accurate alignment of transcriptomes in the presence of insertions, deletions and gene fusions. Genome Biology. 14 (4), 1-13 (2013).
- Patro, R., Duggal, G., Love, M. I., Irizarry, R. A., Kingsford, C. Salmon provides fast and bias-aware quantification of transcript expression. Nature Methods. 14 (4), 417-419 (2017).
- Liao, Y., Smyth, G. K., Shi, W. featureCounts: An efficient general purpose program for assigning sequence reads to genomic features. Bioinformatics. 30 (7), 923-930 (2013).
- Robinson, M. D., McCarthy, D. J., Smyth, G. K. edgeR: A Bioconductor package for differential expression analysis of digital gene expression data. Bioinformatics. 26 (1), 139-140 (2010).
- Love, M. I., Huber, W., Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology. 15 (550), 1-21 (2014).
- Ritchie, M. E., et al. limma powers differential expression analyses for RNA-sequencing and microarray studies. Nucleic Acids Research. 43 (7), 47 (2015).
- Afgan, E., et al. The Galaxy platform for accessible, reproducible and collaborative biomedical analyses: 2018 update. Nucleic Acids Research. 46, 537-544 (2018).
- Hunt, G. P., et al. GEOexplorer: A webserver for gene expression analysis and visualisation. Nucleic Acids Research. , (2022).
- Imbeaud, S., et al. Towards standardization of RNA quality assessment using user-independent classifiers of microcapillary electrophoresis traces. Nucleic Acids Research. 33 (6), 1-12 (2005).
- Di Paolo, A., et al. PDCD4 regulates axonal growth by translational repression of neurite growth-related genes and is modulated during nerve injury responses. RNA. 26 (11), 1637-1653 (2020).
- Smircich, P., et al. Ribosome profiling reveals translation control as a key mechanism generating differential gene expression in Trypanosoma cruzi. BMC Genomics. 16 (1), 443 (2015).
- Eastman, G., Sharlow, E. R., Lazo, J. S., Bloom, G. S., Sotelo-Silveira, J. R. Transcriptome and translatome regulation of pathogenesis in Alzheimer’s disease model mice. Journal of Alzheimer’s Disease. 86 (1), 365-386 (2022).
- Zanetti, M. E., Chang, I. -. F., Gong, F., Galbraith, D. W., Bailey-Serres, J. Immunopurification of polyribosomal complexes of Arabidopsis for global analysis of gene expression. Plant physiology. 138 (2), 624-635 (2005).
- Mustroph, A., et al. Profiling translatomes of discrete cell populations resolves altered cellular priorities during hypoxia in Arabidopsis. Proceedings of the National Academy of Sciences of the United States of America. 106 (44), 18843-11848 (2009).
- Ingolia, N. T., Ghaemmaghami, S., Newman, J. R. S., Weissman, J. S. Genome-wide analysis in vivo of translation with nucleotide resolution using ribosome profiling. Science. 324 (5924), 218-223 (2009).
- Brar, G. A., Weissman, J. S. Ribosome profiling reveals the what, when, where and how of protein synthesis. Nature Reviews. Molecular Cell Biology. 16 (11), 651-664 (2015).
- Eastman, G., Smircich, P., Sotelo-Silveira, J. R. Following ribosome footprints to understand translation at a genome wide level. Computational and Structural Biotechnology Journal. 16, 167-176 (2018).
- Westermann, A. J., Gorski, S. A., Vogel, J. Dual RNA-seq of pathogen and host. Nature Reviews Microbiology. 10 (9), 618-630 (2012).

