Levande avbildning av tidiga hjärtprogenitorer i musembryot
Summary
Vi presenterar ett detaljerat protokoll för odling och avbildning av musembryon som möjliggör 3D + tidsavbildning av hjärtprogenitorceller. Denna videoverktygslåda tar upp de viktigaste färdigheterna som krävs för framgångsrik live-bildbehandling, annars svårt att förvärva från textpublikationer.
Abstract
De första stegen i hjärtutveckling innebär drastiska förändringar i cellbeteende och differentiering. Medan analys av fasta embryon gör det möjligt att studera i detalj specifika utvecklingsstadier i en stillbild, fångar levande avbildning dynamiska morfogenetiska händelser, såsom cellmigration, formförändringar och differentiering, genom att avbilda embryot när det utvecklas. Detta kompletterar fast analys och utvidgar förståelsen för hur organ utvecklas under embryogenesen. Trots sina fördelar används live-bildbehandling sällan i musmodeller på grund av dess tekniska utmaningar. Tidiga musembryon är känsliga när de odlas ex vivo och kräver effektiv hantering. För att underlätta en bredare användning av levande avbildning i musutvecklingsforskning presenterar detta dokument ett detaljerat protokoll för tvåfotons levande mikroskopi som möjliggör långsiktigt förvärv i musembryon. Utöver protokollet ges tips om embryohantering och odlingsoptimering. Detta kommer att hjälpa till att förstå viktiga händelser i tidig musorganogenes, vilket ökar förståelsen för kardiovaskulär stamfaderbiologi.
Introduction
Hjärtat bildas tidigt under embryogenesen för att börja pumpa näringsämnen till hela embryot, medan det fortsätter att utvecklas1. I musembryon samlas ett och ett halvt dygn efter inledandet av gastrulationen ett rudimentärt hjärtorgan vid den främre polen 2,3. Vid Early Streak (ES) -stadiet tränger hjärtprogenitorer i epiblasten genom den primitiva strimman till det begynnande mesodermala skiktet 4,5,6 och börjar migrera till den främre polen, där de differentierar för att bilda det primitiva hjärtröret. Under hela denna process genomgår tidiga hjärtprogenitorer cellomläggningar, formtransformationer och differentiering, förutom migration7 (figur 1).
Tidiga hjärtprogenitorer har lockat forskare i nästan ett sekel på grund av deras anmärkningsvärda förmåga att differentiera och bygga ett funktionellt organ samtidigt. Under de senaste två decennierna har klonal analys och villkorliga knockoutmodeller visat att tidig hjärtutveckling involverar distinkta cellkällor i en mycket dynamisk process 8,9,10. Men 3D-strukturen hos det primitiva hjärtröret och den dynamiska karaktären av dess morfogenes gör det utmanande att studera (figur 1), och vi är långt ifrån att förstå dess fulla komplexitet11.
För att studera dessa dynamiska cellulära processer erbjuder levande bildmetoder nu en oöverträffad detalj 7,12,13,14. I musmodellen har levande tillvägagångssätt varit nyckeln till att fråga utvecklingsämnen som är svåra att ta itu med genom statisk analys 7,13,15. Medan långsiktig ex vivo-kultur och robusta mikroskopuppsättningar går snabbtframåt 16,17, har få forskare expertisen för att framgångsrikt avbilda levande embryon. Även om pappersbaserade publikationer ger tillräckligt med tekniska detaljer för att reproducera levande bildexperiment, är vissa färdigheter och tricks svåra att förstå utan visuella exempel eller peer-to-peer-hjälp. För att påskynda denna inlärningsprocess och sprida användningen av levande bildbehandling bland laboratorier monterade vi ett videoprotokoll (figur 2) som samlar de nödvändiga färdigheterna för att utföra live-avbildning på gastrulerande musembryon.
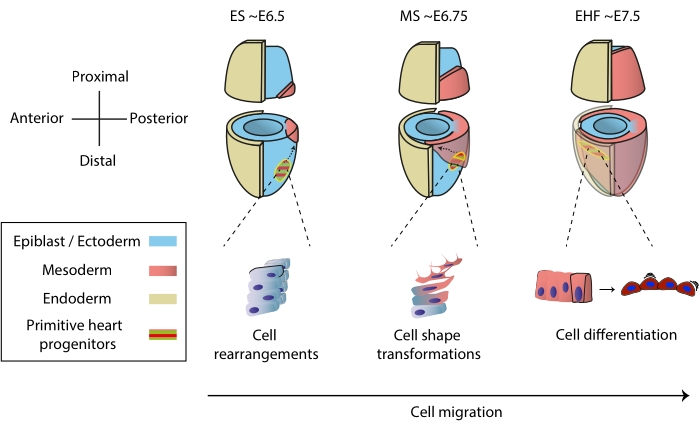
Figur 1: Tidig differentiering av hjärtprogenitorceller i musembryot från början av gastrulation till stadiet före primitiv hjärtrörsbildning. Hjärtstamceller tränger in i mesodermen strax efter gastrulationens början och migrerar till motsatt sida av embryot. Morfologiskt och embryonalt dag (E) stadium skrivs ovanpå diagrammen. Streckade pilar visar migrationsbanan för primitiva hjärtrörsprogenitorer under gastrulation. Denna siffra anpassades från11. Förkortningar: ES = Early Streak; MS = Mellanstreck; EHF = Tidig huvudveckning. Klicka här för att se en större version av denna figur.
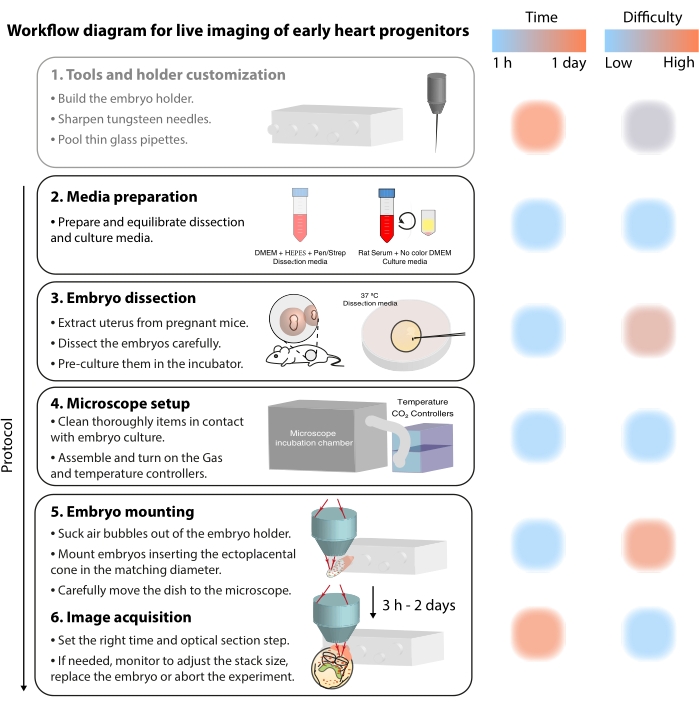
Figur 2: Arbetsflödesdiagram för levande avbildning av tidiga hjärtprogenitorer. Klicka här för att se en större version av denna figur.
Protocol
Representative Results
Discussion
Tidiga hjärtprogenitorer organiserar sig i ett primitivt hjärtrör som börjar slå medan det fortfarande bildas. Att förstå hur denna process sker är nyckeln till att fastställa det breda spektrumet av medfödda hjärtfel till specifika morfogenetiska händelser. För det erbjuder levande avbildning en möjlighet att studera normal och defekt embryonal utveckling med ökad tidsupplösning. Detta är särskilt användbart för att studera tidiga hjärtstamceller eftersom de snabbt övergår genom flera differentier…
Declarações
The authors have nothing to disclose.
Acknowledgements
Författarna erkänner Dr. Kenzo Ivanovitch för tidigare arbete med denna metod och gruppen av Dr. Shigenori Nonaka (National Institutes of Natural Sciences, Japan) för att tillhandahålla den första expertisen om embryomontering. Denna studie stöddes av Grant PGC2018-096486-B-I00 från spanska Ministerio de Ciencia e Innovación och Grant H2020-MSCA-ITN-2016-722427 från EU Horizon 2020-programmet till MT och Grant 1380918 från FEDER Andalucía 2014-2020 Operating Program till JND. MS stöddes av ett La Caixa Foundation PhD fellowship (LCF / BQ / DE18 / 11670014) och The Company of Biologists travelling fellowship (DEVTF181145). CNIC stöds av det spanska vetenskapsministeriet och ProCNIC Foundation.
Materials
| #55 Forceps | Dumont | 11295-51 | |
| 35 mm Dish with glass coverslip bottom 14 mm Diameter | Mattek | P35G-1.5-14-C | |
| 35 mm vise table | Grandado | SKU 8798771617573 | |
| 50 mL tubes | BD Falcon | 352070 | |
| Distilled water | |||
| DMEM – Dulbecco's Modified Eagle Medium | Gibco | 11966025 | with L-Glutamine, without Glucose, without Na Pyruvate |
| Fetal Bovine Serum | Invitrogen | 10438-026 | |
| Fluorescent reporter transgenic mice (Tg(CBF:H2BVenus,+) | JAX | ||
| Fluorobrite DMEM | ThermoFisher | A1896701 | DMEM for live-cell imaging |
| High-vacuum silicone grease | Dow Corning | Z273554-1EA | |
| Holder for wires | Perlen Pressen | pwb1 | |
| LSM 780 Upright microscope | Zeiss | ||
| MaiTai Deepsee far red pulsed-laser tuned at 980 nm | Spectra-Physics | ||
| Non Descanned Detectors equipped with the filter sets cyan-yellow (BP450-500/BP520-560), green-red (BP500-520/BP570-610) and yellow-red (BP520-560/BP645-710) |
Zeiss | ||
| Obj: 20x water dipping 1.0 NA, long working distance | Zeiss | ||
| P1000 and P200 pipettes | |||
| Paraffin Oil | Nidacon | VNI0049 | |
| Penicillin-streptomycin | Invitrogen | 15070-063 | (the final concentration should be 50 μg/mL penicillin and 50 μg/mL streptomycin) |
| Petri dishes 35 mm x 10 mm | BD Falcon | 351008 | |
| Pipette tips | |||
| Polymethyl methacrylate | Reused from old laboratory equipment | ||
| Rat Serum culture embryo, male rats SPRAGUE DAWLEY RjHan SD | Janvier Labs | 9979 | |
| Set of 160 mm fines | RS PRO | 541-6933 | |
| Standard 1.0 mm glass capillaries | Anima Lab | 1B100F-3 | |
| Sterile 0.22 μm syringe filter | Corning | 431218 | |
| Sterile 5 mL syringe | Fisher Scientific | 15809152 | |
| Tungsten needles | |||
| Ultrasonic homogeniser (sonicator) | Bandelin | BASO_17021 |
Referências
- Tyser, R. C. V., et al. Calcium handling precedes cardiac differentiation to initiate the first heartbeat. eLife. 5, 17113 (2016).
- Kelly, R. G., Buckingham, M. E., Moorman, A. F. Heart fields and cardiac morphogenesis. Cold Spring Harbor Perspectives in Medicine. 4 (10), 015750 (2014).
- Evans, S. M., Yelon, D., Conlon, F. L., Kirby, M. L. Myocardial lineage development. Circulation Research. 107 (12), 1428-1444 (2010).
- Tam, P. P., Parameswaran, M., Kinder, S. J., Weinberger, R. P. The allocation of epiblast cells to the embryonic heart and other mesodermal lineages: the role of ingression and tissue movement during gastrulation. Development. 124 (9), 1631-1642 (1997).
- Kinder, S. J., Loebel, D. A. F., Tam, P. P. L. Allocation and early differentiation of cardiovascular progenitors in the mouse embryo. Trends in Cardiovascular Medicine. 11 (5), 177-184 (2001).
- Lawson, K. A. Fate mapping the mouse embryo. International Journal of Developmental Biology. 43 (7), 773-775 (1999).
- Ivanovitch, K., Temiño, S., Torres, M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife. 6, 30668 (2017).
- Meilhac, S. M., Buckingham, M. E. The deployment of cell lineages that form the mammalian heart. Nature Reviews Cardiology. 15 (11), 705-724 (2018).
- Buckingham, M., Meilhac, S., Zaffran, S. Building the mammalian heart from two sources of myocardial cells. Nature Reviews Genetics. 6 (11), 826-835 (2005).
- Meilhac, S. M., Lescroart, F., Blanpain, C. D., Buckingham, M. E. Cardiac cell lineages that form the heart. Cold Spring Harbor Perspectives in Medicine. 4 (9), 013888 (2014).
- Sendra, M., Domínguez, J. N., Torres, M., Ocaña, O. H. Dissecting the complexity of early heart progenitor cells. Journal of Cardiovascular Development and Disease. 9 (1), 5 (2022).
- McDole, K., et al. In toto imaging and reconstruction of post-implantation mouse development at the single-cell level. Cell. 175 (3), 859-876 (2018).
- Saykali, B., et al. Distinct mesoderm migration phenotypes in extra-embryonic and embryonic regions of the early mouse embryo. eLife. 8, 42434 (2019).
- Ichikawa, T., et al. Live imaging of whole mouse embryos during gastrulation: Migration analyses of epiblast and mesodermal cells. PLoS ONE. 8 (7), 64506 (2013).
- Tyser, R. C. V., et al. Single-cell transcriptomic characterization of a gastrulating human embryo. Nature. 600 (7888), 285-289 (2021).
- Aguilera-Castrejon, A., et al. Ex utero mouse embryogenesis from pre-gastrulation to late organogenesis. Nature. 593 (7857), 119-124 (2021).
- Yue, Y., et al. in toto live imaging of cardiomyocyte behaviour during mouse ventricle chamber formation at single-cell resolution. Nature Cell Biology. 22 (3), 332-340 (2020).
- Nowotschin, S., Xenopoulos, P., Schrode, N., Hadjantonakis, A. K. A bright single-cell resolution live imaging reporter of Notch signaling in the mouse. BMC Developmental Biology. 13 (1), 15 (2013).
- Cold Spring Harbor Protocols. Sharpened tungsten needles. Cold Spring Harbor Protocols. , (2012).
- Tam, P. P., Snow, M. H. The in vitro culture of primitive-streak-stage mouse embryos. Journal of Embryology and Experimental Morphology. 59, 131-143 (1980).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Preparation of rat serum for culturing mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5593 (2011).
- Tam, P. P. L. Postimplantation mouse development: Whole embryo culture and micro- manipulation. International Journal of Developmental Biology. 42 (7), 895-902 (1998).
- Optimización de propiedades fisicoquímicas y medios de cultivo para el cultivo del embrión de ratón ex vivo. Universidad de Jaén. Biología Experimental Available from: https://hdl.handle.net/10953.1/1400 (2021)
- Behringer, R., Gertsenstein, M., Vintersen Nagy, K., Nagy, A. . Manipulating the mouse embryo: A laboratory manual, Fourth Edition. , 814 (2014).
- Shea, K., Geijsen, N. Dissection of 6.5 dpc mouse embryos. Journal of Visualized Experiments. (2), e160 (2006).
- Nonaka, S. Modification of mouse nodal flow by applying artificial flow. Methods in Cell Biology. 91, 287-297 (2009).
- Garcia, M. D., Udan, R. S., Hadjantonakis, A. K., Dickinson, M. E. Time-lapse imaging of postimplantation mouse embryos. Cold Spring Harbor Protocols. 2011 (4), 5595 (2011).
- Crainiciuc, G., et al. Behavioural immune landscapes of inflammation. Nature. 601 (7893), 415-421 (2022).

