アルデヒドデヒドロゲナーゼ1A1活性に基づく卵巣癌細胞の層別化へのAlDeSenseの応用
Summary
生細胞におけるALDH1A1活性を測定する方法は、幹細胞性のバイオマーカーとしての地位から、がん研究において極めて重要です。この研究では、アイソフォーム選択的蛍光発生プローブを使用して、5つの卵巣癌細胞株のパネルにおけるALDH1A1活性の相対レベルを決定しました。
Abstract
がん治療後の再発は、がん幹細胞(CSC)として知られる腫瘍細胞の亜集団の持続に起因することが多く、顕著な腫瘍開始能力と自己複製能力が特徴です。腫瘍の起源(卵巣など)に応じて、CSC表面バイオマーカープロファイルは劇的に異なる可能性があるため、免疫組織化学染色 による そのような細胞の同定は困難な作業になります。それどころか、アルデヒドデヒドロゲナーゼ1A1(ALDH1A1)は、CSCを含むほぼすべての前駆細胞で発現プロファイルが保存されているため、CSCを同定するための優れたマーカーとして浮上しています。ALDH1A1アイソフォームは、対応するカルボン酸生成物への様々な内因性および生体異物アルデヒドの酸化に関与する19の酵素のスーパーファミリーに属する。Chanらは最近、ALDH1A1活性を検出するためのアイソフォーム選択的「ターンオン」プローブであるAlDeSenseと、オフターゲット染色を説明するための非反応性マッチング制御試薬(Ctrl-AlDeSense)を開発しました。このアイソフォーム選択ツールは、K562骨髄性白血病細胞、マンモスフェア、および黒色腫由来のCSC異種移植片におけるALDH1A1活性の検出を通じて、汎用性の高い化学ツールであることがすでに実証されています。この記事では、プローブの有用性を、追加の蛍光測定、共焦点顕微鏡、およびフローサイトメトリー実験を通じて紹介し、5つの卵巣癌細胞株のパネルで相対的なALDH1A1活性を測定しました。
Introduction
がん幹細胞(CSC)は、幹細胞のような特性を示す腫瘍細胞の亜集団です1。非癌性の対応物と同様に、CSCは自己再生および増殖する並外れた能力を持っています。ATP結合カセットトランスポーターのアップレギュレーションなどの他の組み込みメカニズムとともに、CSCは、最初の外科的デバルキング作業やその後の補助療法から免れることがよくあります2。CSCは、治療抵抗性3、再発4、および転移5において重要な役割を果たすため、がん研究の優先事項となっています。CSCの同定に使用できる細胞表面抗原(CD133など)はさまざまですが6、細胞質に見られるアルデヒドデヒドロゲナーゼ(ALDH)の酵素活性を活用することは、魅力的な代替手段として浮上しています7。ALDHは、対応するカルボン酸生成物8への反応性内因性および生体異物アルデヒドの酸化を触媒する19の酵素のスーパーファミリーである。
一般に、アルデヒド解毒は、幹細胞の完全性を損なう可能性のある望ましくない架橋事象や酸化ストレスから細胞を保護する上で非常に重要です9。さらに、1A1アイソフォームはレチノイン酸代謝を制御し、レチノイン酸代謝はレチンアルデヒドシグナル伝達を介してステムネスに影響を与えます10。AlDeSense 11,12は、ALDH1A1活性を選択的に検出するための低分子活性ベースのセンシング(ABS)プローブであり、最近開発されました。ABS設計は、結合イベントではなく化学変化によって分析物検出を実現し、高い選択性とオフターゲット応答の減少を可能にします13,14,15,16。アイソフォーム選択的蛍光発生プローブの設計原理は、プローブ18の蛍光シグネチャを抑制するのに役立つアルデヒド官能基に由来するドナー光誘起電子移動(d-PeT)消光機構17に依存しています。ALDH1A1を介したカルボン酸への変換時に、放射緩和が解除され、蛍光性の高い生成物が得られます。d-PeT消光は100%効率的ではないため、このアッセイを確立する際には、細胞内で一致する光物理的特性(量子収率など)と同一の細胞質染色パターンを備えた非応答試薬であるCtrl-AlDeSenseの開発を通じて、偽陽性の結果につながる可能性のある残留蛍光が考慮されました。このユニークなペアリングを併用することで、蛍光測定、分子イメージング、フローサイトメトリーにより、ALDH1A1活性の高い細胞と低レベルを示す細胞を確実に区別することができます。いくつかの重要な利点は、従来の免疫組織化学的方法よりもアイソフォーム選択的活性化可能な色素を使用することに関連しています。たとえば、CSCは腫瘍の奥深くに埋もれていると仮定されているため、大きな抗体に比べて小分子にアクセスしやすくなります19。さらに、ターンオーバーした蛍光産物は細胞成分を共有結合的に修飾しないため、洗浄サイクルで容易に除去し、CSCを未修飾の状態のままにすることができます。最後に、ターンオン応答は、NAD+補因子に依存しているため、MTTアッセイと同様に、生細胞と機能のみを識別します。
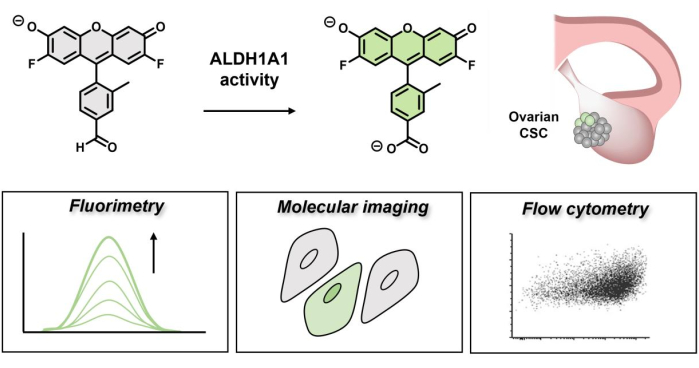
図1:AlDeSenseの蛍光ターンオンを示す回路図。 アイソフォーム選択的色素はALDH1A1によって活性化され、蛍光測定、分子イメージング、およびフローサイトメトリー を介して 卵巣癌細胞におけるALDH1A1活性の上昇を特定するために使用できます。 この図の拡大版を表示するには、ここをクリックしてください。
過去の研究では、アイソフォーム選択的蛍光発生プローブアッセイは、K562ヒト慢性白血病細胞、MDA-MB-231ヒト乳がん細胞、およびB16F0マウス黒色腫細胞において、ALDH低(ALDH-)細胞からALDH高(ALDH+)細胞を層別化することに成功しました。多くの種類のがんにとって、ALDH1A1タンパク質の発現が高いことは臨床予後が悪いことを意味するため、これは重要です20。これは、ALDH1A1のレベルの上昇が、治療を回避し、耐性を発達させ、全身に広がる可能性のあるCSCを示していると想定しています。しかし、卵巣がんの場合、反対の所見(ALDH1A1の高発現は患者の生存率の改善につながる)を報告する研究があります21,22,23,24。これは一見矛盾しているように見えるかもしれませんが、発現は必ずしも酵素活性と相関しているわけではなく、腫瘍微小環境の変化(pHフラックス、酸素勾配など)、NAD+補因子またはアルデヒド基質の利用可能性、カルボン酸のレベル(生成物阻害)、および酵素活性を変化させる可能性のある翻訳後修飾によって影響を受ける可能性があります25.さらに、卵巣がんは5つの主要な組織型(高悪性度漿液性、低悪性度漿液性、子宮内膜症、明細胞性、粘液性)に分けられ、ALDH1A1活性のさまざまなレベルを特徴とすると仮定します26。卵巣腫瘍におけるALDH1A1活性を調査することを目的として、アイソフォーム選択的蛍光発生プローブアッセイを使用して、上記の異なる組織型に属する5つの卵巣癌細胞株のパネルにおけるALDH1A1+集団を同定しました。この研究でテストされた細胞株には、BG-1、Caov-3、IGROV-1、OVCAR-3、およびPEO4細胞が含まれ、明細胞および漿液性組織型をカバーしています。ここでは、プローブの汎用性と一般化可能性が強調され、他の不死化癌細胞株および患者サンプルで同様の研究を実施しようとする研究者のためにCSCを同定しました。AlDeSenseの使用は、複雑な組織微小環境におけるCSC維持に関与する生化学的経路に光を当て、予後を決定し、癌の攻撃性を測定するための臨床ツールとして役立つ可能性があります。
Protocol
Representative Results
Discussion
汎選択性は、多くのALDHプローブの主要な制限です。しかしながら、いくつかのアイソフォーム選択的例が最近報告されている32、33、34、35、36、37、38、39、40、<sup cla…
Declarações
The authors have nothing to disclose.
Acknowledgements
この研究は、国立衛生研究所(R35GM133581からJC)およびイリノイ州がんセンター大学院奨学金(SGに授与)の支援を受けました。JCは、カミーユとヘンリー・ドレフュス財団の支援に感謝します。著者らは、AlDeSenseとAlDeSense AMの株式の準備に最初に貢献したThomas E. Bearrood博士に感謝しています。オリバー・D・ピチャルド・ペゲーロ氏とジョセフ・A・フォルツァーノ氏には、さまざまな合成前駆体の調製にご協力いただき、ありがとうございました。Caov-3、IGROV-1、およびPEO4細胞について、Erik Nelson教授(UIUC分子統合生理学部門)に感謝します。BG-1細胞を提供してくれたPaul Hergenrother教授(UIUC化学科)に感謝します。Zeiss LSM 700共焦点顕微鏡と対応するソフトウェアにアクセスしてくださったCarl R. Woese Institute for Genomic Biologyのコア施設に感謝します。BD LSR II CMtO Analyzerへのアクセスを提供してくださったフローサイトメトリー施設に感謝します。細胞培養培地の調製を支援してくれたサンドラ・マクマスターズ博士と細胞培地施設に感謝します。
Materials
| 0.25% Trypsin, 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate | Corning | 25-050-CI | |
| 1x Phosphate Buffer Saline | Corning | 21-040-CMX12 | |
| AccuSpin Micro 17R | Fisher Scientific | 13-100-675 | |
| AlDeSense | Synthesized in-house | ||
| BG-1 | A gift provided by the Prof. Paul Hergenrother Lab, University of Illinois Urbana-Champaign | ||
| BioLite 25cm2 Flask | Thermo Fisher Scientific | 130189 | |
| Biosafety Cabinet 1300 series A2 | Thermo Fisher Scientific | ||
| Caov-3 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Cell homogenizer | Fisher Scientific | ||
| Centrifuge 5180R | Eppendorf | 22627040 | |
| Contrl-AlDeSense | Synthesized in-house | ||
| DMEM, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5mL | Corning | 352003 | |
| FCS Express 6 | Provided by UIUC CMtO | ||
| FL microscope | EVOS | ||
| Fluorometer | Photon Technology International | ||
| Forma Series II Water-Jacketed CO2 Incubator | Fisher Scientific | 3110 | |
| IGROV-1 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| ImageJ | NIH | ||
| Innova 42R Incubated Shaker | |||
| LSM 700 | Zeiss | ||
| LSR II | BD | ||
| Nunc Lab-Tek Chambered #1.0 Borosicilate Coverglass System | Thermo Fisher Scientific | 155383 | |
| OVCAR-3 | ATCC | HTB-161 | |
| PEO4 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Pierce Protease Inhibitor Tablets | Thermo Scientific | A32963 | |
| Poly-L-Lysine | Cultrex | 3438-100-01 | |
| Rocker | VWR | ||
| RPMI, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| RPMI, 20% FBS, 1% P/S, 0.01 mg/mL Insulin | Prepared by UIUC cell media facility |
Referências
- Bonnet, D., Dick, J. E. Human acute myeloid leukaemia is organised as a heirarchy that originates from a primitive haematopoetic cell. Nature Medicine. 3 (7), 730-737 (1997).
- Begicevic, R. R., Falasca, M. ABC transporters in cancer stem cells: Beyond chemoresistance. International Journal of Molecular Sciences. 18 (11), 2362 (2017).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Islam, F., Gopalan, V., Smith, R. A., Lam, A. K. Y. Translational potential of cancer stem cells: A review of the detection of cancer stem cells and their roles in cancer recurrence and cancer treatment. Experimental Cell Research. 335 (1), 135-147 (2015).
- Li, F., Tiede, B., Massagué, J., Kang, Y. Beyond tumorigenesis: Cancer stem cells in metastasis. Cell Research. 17 (1), 3-14 (2007).
- Kim, W. T., Ryu, C. J. Cancer stem cell surface markers on normal stem cells. BMB Reports. 50 (6), 285-298 (2017).
- Pors, K., Moreb, J. S. Aldehyde dehydrogenases in cancer: An opportunity for biomarker and drug development. Drug Discovery Today. 19 (12), 1953-1963 (2014).
- Jackson, B., et al. Update on the aldehyde dehydrogenase gene (ALDH) superfamily. Human Genomics. 5 (4), 283-303 (2011).
- Vasiliou, V., Pappa, A., Petersen, D. R. Role of aldehyde dehydrogenases in endogenous and xenobiotic metabolism. Chemico-Biological Interactions. 129 (1-2), 1-19 (2000).
- Tomita, H., Tanaka, K., Tanaka, T., Hara, A. Aldehyde dehydrogenase 1A1 in stem cells and cancer. Oncotarget. 7 (10), 11018-11032 (2016).
- Anorma, C., et al. Surveillance of cancer stem cell plasticity using an isoform-selective fluorescent probe for aldehyde dehydrogenase 1A1. ACS Central Science. 4 (8), 1045-1055 (2018).
- Bearrood, T. E., Aguirre-Figueroa, G., Chan, J. Rational design of a red fluorescent sensor for ALDH1A1 displaying enhanced cellular uptake and reactivity. Bioconjugate Chemistry. 31 (2), 224-228 (2020).
- Chan, J., Dodani, S. C., Chang, C. J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging. Nature Chemistry. 4 (12), 973-984 (2012).
- East, A. K., Lucero, M. Y., Chan, J. New directions of activity-based sensing for in vivo NIR imaging. Chemical Science. 12 (10), 3393-3405 (2021).
- Yadav, A. K., et al. Activity-based NIR bioluminescence probe enables discovery of diet-induced modulation of the tumor microenvironment via nitric oxide. ACS Central Science. 8 (4), 461-472 (2022).
- Yadav, A. K., et al. An activity-based sensing approach for the detection of cyclooxygenase-2 in Live Cells. Angewandte Chemie. 59 (8), 3307-3314 (2020).
- Ueno, T., et al. Rational principles for modulating fluorescence properties of fluorescein. Journal of the American Chemical Society. 126 (43), 14079-14085 (2004).
- Tanaka, F., Mase, N., Barbas 3rd, C. F. Design and use of fluorogenic aldehydes for monitoring the progress of aldehyde transformations. Journal of the American Chemical Society. 126 (12), 3692-3693 (2004).
- Thurber, G. M., Schmidt, M. M., Wittrup, K. D. Antibody tumor penetration: transport opposed by systemic and antigen-mediated clearance. Advanced Drug Delivery Reviews. 60 (12), 1421-1434 (2008).
- Marcato, P., Dean, C. A., Giacomantonio, C. A., Lee, P. W. K. Aldehyde dehydrogenase its role as a cancer stem cell marker comes down to the specific isoform. Cell Cycle. 10 (9), 1378-1384 (2011).
- Meng, E., et al. ALDH1A1 maintains ovarian cancer stem cell-like properties by altered regulation of cell cycle checkpoint and DNA repair network signaling. PLoS One. 9 (9), e107142 (2014).
- Kaipio, K., et al. ALDH1A1-related stemness in high-grade serous ovarian cancer is a negative prognostic indicator but potentially targetable by EGFR/mTOR-PI3K/aurora kinase inhibitors. The Journal of Pathology. 250 (2), 159-169 (2020).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 (ALDH1), in human epithelial cancers. PLoS One. 5 (4), e10277 (2010).
- Chang, B., et al. ALDH1 expression correlates with favorable prognosis in ovarian cancers. Modern Pathology. 22 (6), 817-823 (2009).
- Gardner, S. H., Reinhardt, C. J., Chan, J. Advances in activity-based sensing probes for isoform-selective imaging of enzymatic activity. Angewandte Chemie. 60 (10), 5000-5009 (2021).
- Reid, B. M., Permuth, J. B., Sellers, T. A. Epidemiology of ovarian cancer: a review. Cancer Biology and Medicine. 14 (1), 9-32 (2017).
- Tulake, W., et al. Upregulation of stem cell markers ALDH1A1 and OCT4 as potential biomarkers for the early detection of cervical carcinoma. Oncology Letters. 16 (5), 5525-5534 (2018).
- Nwani, N. G., et al. A novel ALDH1A1 inhibitor targets cells with stem cell characteristics in ovarian cancer. Cancers. 11 (4), 502 (2019).
- Roy, M., Connor, J., Al-Niaimi, A., Rose, S. L., Mahajan, A. Aldehyde dehydrogenase 1A1 (ALDH1A1) expression by immunohistochemistry is associated with chemo-refractoriness in patients with high-grade ovarian serous carcinoma. Human Pathology. 73, 1-6 (2018).
- Landen Jr, C. N., et al. Targeting aldehyde dehydrogenase cancer stem cells in ovarian cancer. Molecular Cancer Therapeutics. 9 (12), 3186-3199 (2010).
- Condello, S., et al. β-catenin-regulated ALDH1A1 is a target in ovarian cancer spheroids. Oncogene. 34 (18), 2297-2308 (2015).
- Storms, R. W., et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proceedings of the National Academy of Sciences. 96 (16), 9118-9123 (1999).
- Duellman, S. J., et al. A bioluminescence assay for aldehyde dehydrogenase activity. Analytical Biochemistry. 434 (2), 226-232 (2013).
- Minn, I., et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase. Nature Communications. 5, 3662 (2014).
- Dollé, L., Boulter, L., Leclercq, I. A., van Grunsven, L. A. Next generation of ALDH substrates and their potential to study maturational lineage biology in stem and progenitor cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (7), 573-578 (2015).
- Yagishita, A., et al. Development of highly selective fluorescent probe enabling flow-cytometric isolation of ALDH3A1-positive viable cells. Bioconjugate Chemistry. 28 (2), 302-306 (2017).
- Maity, S., et al. Thiophene bridged aldehydes (TBAs) image ALDH activity in cells: Via modulation of intramolecular charge transfer. Chemical Science. 8 (10), 7143-7151 (2017).
- Koenders, S. T. A., et al. Development of a retinal-based probe for the profiling of retinaldehyde dehydrogenases in cancer cells. ACS Central Science. 5 (12), 1965-1974 (2019).
- Oe, M., et al. Deep-red/near-infrared turn-on fluorescence probes for aldehyde dehydrogenase 1A1 in cancer stem cells. ACS Sensors. 6 (9), 3320-3329 (2021).
- Yagishita, A., Ueno, T., Tsuchihara, K., Urano, Y. Amino BODIPY-based blue fluorescent probes for aldehyde dehydrogenase 1-expressing cells. Bioconjugate Chemistry. 32 (2), 234-238 (2021).
- Okamoto, A., et al. Identification of breast cancer stem cells using a newly developed long-acting fluorescence probe, C5S-A, targeting ALDH1A1. Anticancer Research. 42 (3), 1199-1205 (2022).

