Anvendelse av AlDeSense for å stratifisere eggstokkreftceller basert på aldehyddehydrogenase 1A1-aktivitet
Summary
Metoder for å måle ALDH1A1-aktivitet i levende celler er kritiske i kreftforskning på grunn av sin status som en biomarkør for stamme. I denne studien benyttet vi en isoform-selektiv fluorogen sonde for å bestemme de relative nivåene av ALDH1A1-aktivitet i et panel med fem eggstokkreftcellelinjer.
Abstract
Tilbakefall etter kreftbehandling tilskrives ofte utholdenheten til en underpopulasjon av tumorceller kjent som kreftstamceller (CSC), som er preget av deres bemerkelsesverdige tumorinitierende og selvfornyelseskapasitet. Avhengig av opprinnelsen til svulsten (f.eks. Eggstokkene), kan CSC-overflatens biomarkørprofil variere dramatisk, noe som gjør identifisering av slike celler via immunhistokjemisk farging en utfordrende innsats. Tvert imot har aldehyddehydrogenase 1A1 (ALDH1A1) dukket opp som en utmerket markør for å identifisere CSC, på grunn av sin konserverte ekspresjonsprofil i nesten alle stamceller, inkludert CSC. ALDH1A1-isoformen tilhører en superfamilie av 19 enzymer som er ansvarlige for oksydasjonen av forskjellige endogene og xenobiotiske aldehyder til de tilsvarende karboksylsyreproduktene. Chan et al. utviklet nylig AlDeSense, en isoform-selektiv “turn-on” sonde for påvisning av ALDH1A1-aktivitet, samt et ikke-reaktivt matchende kontrollreagens (Ctrl-AlDeSense) for å ta hensyn til farging utenfor målet. Dette isoformselektive verktøyet har allerede vist seg å være et allsidig kjemisk verktøy gjennom påvisning av ALDH1A1-aktivitet i K562 myelogene leukemiceller, mammosfærer og melanomavledede CSC-xenotransplantater. I denne artikkelen ble sondens nytte vist gjennom ytterligere fluorimetri, konfokalmikroskopi og flowcytometrieksperimenter der den relative ALDH1A1-aktiviteten ble bestemt i et panel med fem eggstokkreftcellelinjer.
Introduction
Kreft stamceller (CSC) er en underpopulasjon av tumorceller som viser stamcellelignende egenskaper1. I likhet med deres ikke-kreftfremkallende kolleger har CSC-er den ekstraordinære evnen til selvfornyelse og spredning. Sammen med andre innebygde mekanismer, som oppregulering av ATP-bindende kassetttransportører, blir CSC ofte spart for innledende kirurgisk debulking, så vel som påfølgende adjuvant behandling2. På grunn av deres kritiske rolle i behandlingsresistens3, tilbakefall4 og metastase5, har CSC blitt en prioritet i kreftforskning. Selv om det finnes en rekke celleoverflateantigener (f.eks. CD133) som kan brukes til å identifisere CSC6, har utnyttelse av den enzymatiske aktiviteten til aldehyddehydrogenaser (ALDH) funnet i cytoplasma dukket opp som et attraktivt alternativ7. ALDH er en superfamilie av 19 enzymer som er ansvarlige for å katalysere oksidasjonen av reaktive endogene og xenobiotiske aldehyder til de tilsvarende karboksylsyreproduktene8.
Generelt er aldehydavgiftning avgjørende for å beskytte celler mot uønskede kryssbindingshendelser og oksidativt stress som kan skade stamcellenes integritet9. Videre styrer 1A1-isoformen retinsyremetabolismen, som igjen påvirker stammen via retinaldehydsignalering10. AlDeSense 11,12, en liten molekylær aktivitetsbasert sensing (ABS) sonde for selektivt å oppdage ALDH1A1-aktivitet, ble nylig utviklet. ABS-design oppnår analyttdeteksjon gjennom en kjemisk endring i stedet for en bindingshendelse, noe som muliggjør høy selektivitet og reduserte responser utenfor målet13,14,15,16. Designprinsippet for den isoformselektive fluorogene sonden er avhengig av en donor-fotoinducert elektronoverføring (d-PeT) slukkemekanisme17, som stammer fra den aldehydfunksjonelle gruppen, som tjener til å undertrykke sondens fluorescerende signatur18. Ved ALDH1A1-mediert omdannelse til karboksylsyre låses strålingen opp for å gi et svært fluorescerende produkt. Fordi d-PeT-slukking aldri er 100% effektiv, ble den gjenværende fluorescensen som kan føre til mulige falske positive resultater vurdert ved etablering av denne analysen gjennom utvikling av Ctrl-AlDeSense, et ikke-responsivt reagens med matchende fotofysiske egenskaper (f.eks. kvanteutbytte) og et identisk cytoplasmatisk fargemønster i celler. Når den brukes i tandem, kan denne unike sammenkoblingen pålitelig skille celler med høy ALDH1A1-aktivitet fra de som viser lave nivåer via fluorimetri, molekylær avbildning og flowcytometri. Flere viktige fordeler er forbundet med bruk av isoformselektive aktiverbare fargestoffer i forhold til tradisjonelle immunhistokjemiske metoder. For eksempel antas CSC å bli begravet dypt inne i en svulst, og dermed er mer tilgjengelig for et lite molekyl i forhold til store antistoffer19. I tillegg modifiserer ikke det omslåtte fluorescerende produktet kovalent noen cellulær komponent, noe som betyr at det lett kan fjernes via vaskesykluser for å forlate en CSC i umodifisert tilstand. Til slutt identifiserer turn-on-responsen bare levedyktige celler og funksjoner, omtrent som MTT-analysen, på grunn av sin avhengighet av NAD + -kofaktoren.
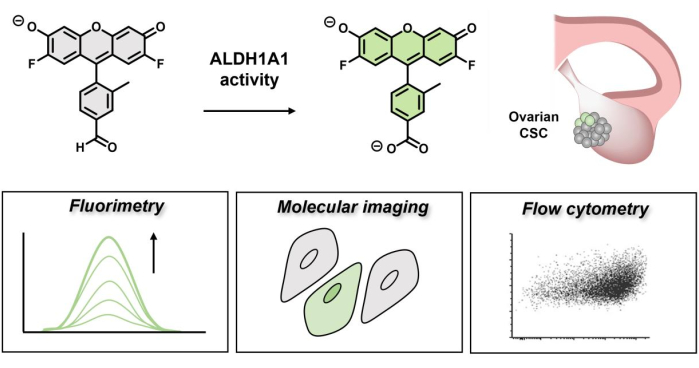
Figur 1: Skjematisk demonstrasjon av fluorescerende påkjøring av AlDeSense. Det isoformselektive fargestoffet aktiveres av ALDH1A1 og kan brukes til å identifisere forhøyet ALDH1A1-aktivitet i eggstokkreftceller via fluorimetri, molekylær avbildning og flowcytometri. Klikk her for å se en større versjon av denne figuren.
I tidligere arbeid har isoform-selektiv fluorogen sondeanalyse vellykket stratifisert ALDH høye (ALDH +) celler fra ALDH lave (ALDH-) celler i K562 humane kroniske leukemiceller, MDA-MB-231 humane brystkreftceller og B16F0 murine melanomceller. Dette er viktig fordi høyt ALDH1A1-proteinuttrykk for mange krefttyper betyr en dårligere klinisk prognose20. Dette forutsetter at forhøyede nivåer av ALDH1A1 er en indikasjon på CSC som kan unngå behandling, utvikle resistens og spre seg gjennom hele kroppen. Når det gjelder eggstokkreft, er det imidlertid studier som rapporterer motsatt funn (høyt ALDH1A1-uttrykk er knyttet til forbedret pasientoverlevelse)21,22,23,24. Selv om dette kan virke motstridende ved første øyekast, korrelerer ikke ekspresjon nødvendigvis med enzymaktivitet, som kan påvirkes av endringer i tumormikromiljøet (f.eks. pH-fluks, oksygengradienter), tilgjengeligheten av NAD + -kofaktoren eller aldehydsubstratene, nivåer av karboksylsyrer (produktinhibering) og posttranslasjonelle modifikasjoner som kan endre enzymaktivitet25 . I tillegg er eggstokkreft delt inn i fem hovedhistologiske typer (høygradig serøs, lavgradig serøs, endometrioid, klar celle og mucinøs), som vi antar vil inneholde variable nivåer av ALDH1A1-aktivitet26. Med mål om å undersøke ALDH1A1-aktivitet i eggstokktumorer, ble en isoform-selektiv fluorogen sondeanalyse ansatt for å identifisere ALDH1A1 + populasjoner i et panel av fem eggstokkreftcellelinjer som tilhører de forskjellige histologiske typene nevnt ovenfor. Cellelinjene som ble testet i denne studien inkluderer BG-1, Caov-3, IGROV-1, OVCAR-3 og PEO4-celler, som dekker klare celle- og serøse histotyper. Her ble sondens allsidighet og generaliserbarhet fremhevet for å identifisere CSC for forskerne som søker å utføre lignende studier i andre immortaliserte kreftcellelinjer samt pasientprøver. Bruken av AlDeSense vil kaste lys over de biokjemiske veiene som er involvert i CSC-vedlikehold i komplekse vevsmikromiljøer og potensielt tjene som et klinisk verktøy for å bestemme prognose og måle kreftaggressivitet.
Protocol
Representative Results
Discussion
Pan-selektivitet er en stor begrensning for mange ALDH-sonder; Imidlertid har flere isoform-selektive eksempler nylig blitt rapportert 32,33,34,35,36,37,38,39,40,41. Den isoformselektive …
Declarações
The authors have nothing to disclose.
Acknowledgements
Dette arbeidet ble støttet av The National Institutes of Health (R35GM133581 til JC) og Cancer Center ved Illinois Graduate Scholarship (tildelt SG). JC takker Camille og Henry Dreyfus Foundation for støtte. Forfatterne takker Dr. Thomas E. Bearrood for hans første bidrag til å forberede aksjer av AlDeSense og AlDeSense AM. Vi takker Oliver D. Pichardo Peguero og Joseph A. Forzano for deres hjelp med å forberede ulike syntetiske forløpere. Vi takker professor Erik Nelson (Institutt for molekylær og integrativ fysiologi, UIUC) for Caov-3, IGROV-1 og PEO4 celler. Vi takker Prof. Paul Hergenrother (Kjemisk institutt, UIUC) for BG-1 celler. Vi takker kjernefasilitetene ved Carl R. Woese Institute for Genomic Biology for tilgang til Zeiss LSM 700 Confocal Microscope og tilhørende programvare. Vi takker Flow Cytometry Facility for tilgang til BD LSR II CMtO Analyzer. Vi takker Dr. Sandra McMasters og Cell Media Facility for hjelp til å forberede cellekulturmedier.
Materials
| 0.25% Trypsin, 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate | Corning | 25-050-CI | |
| 1x Phosphate Buffer Saline | Corning | 21-040-CMX12 | |
| AccuSpin Micro 17R | Fisher Scientific | 13-100-675 | |
| AlDeSense | Synthesized in-house | ||
| BG-1 | A gift provided by the Prof. Paul Hergenrother Lab, University of Illinois Urbana-Champaign | ||
| BioLite 25cm2 Flask | Thermo Fisher Scientific | 130189 | |
| Biosafety Cabinet 1300 series A2 | Thermo Fisher Scientific | ||
| Caov-3 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Cell homogenizer | Fisher Scientific | ||
| Centrifuge 5180R | Eppendorf | 22627040 | |
| Contrl-AlDeSense | Synthesized in-house | ||
| DMEM, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5mL | Corning | 352003 | |
| FCS Express 6 | Provided by UIUC CMtO | ||
| FL microscope | EVOS | ||
| Fluorometer | Photon Technology International | ||
| Forma Series II Water-Jacketed CO2 Incubator | Fisher Scientific | 3110 | |
| IGROV-1 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| ImageJ | NIH | ||
| Innova 42R Incubated Shaker | |||
| LSM 700 | Zeiss | ||
| LSR II | BD | ||
| Nunc Lab-Tek Chambered #1.0 Borosicilate Coverglass System | Thermo Fisher Scientific | 155383 | |
| OVCAR-3 | ATCC | HTB-161 | |
| PEO4 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Pierce Protease Inhibitor Tablets | Thermo Scientific | A32963 | |
| Poly-L-Lysine | Cultrex | 3438-100-01 | |
| Rocker | VWR | ||
| RPMI, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| RPMI, 20% FBS, 1% P/S, 0.01 mg/mL Insulin | Prepared by UIUC cell media facility |
Referências
- Bonnet, D., Dick, J. E. Human acute myeloid leukaemia is organised as a heirarchy that originates from a primitive haematopoetic cell. Nature Medicine. 3 (7), 730-737 (1997).
- Begicevic, R. R., Falasca, M. ABC transporters in cancer stem cells: Beyond chemoresistance. International Journal of Molecular Sciences. 18 (11), 2362 (2017).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Islam, F., Gopalan, V., Smith, R. A., Lam, A. K. Y. Translational potential of cancer stem cells: A review of the detection of cancer stem cells and their roles in cancer recurrence and cancer treatment. Experimental Cell Research. 335 (1), 135-147 (2015).
- Li, F., Tiede, B., Massagué, J., Kang, Y. Beyond tumorigenesis: Cancer stem cells in metastasis. Cell Research. 17 (1), 3-14 (2007).
- Kim, W. T., Ryu, C. J. Cancer stem cell surface markers on normal stem cells. BMB Reports. 50 (6), 285-298 (2017).
- Pors, K., Moreb, J. S. Aldehyde dehydrogenases in cancer: An opportunity for biomarker and drug development. Drug Discovery Today. 19 (12), 1953-1963 (2014).
- Jackson, B., et al. Update on the aldehyde dehydrogenase gene (ALDH) superfamily. Human Genomics. 5 (4), 283-303 (2011).
- Vasiliou, V., Pappa, A., Petersen, D. R. Role of aldehyde dehydrogenases in endogenous and xenobiotic metabolism. Chemico-Biological Interactions. 129 (1-2), 1-19 (2000).
- Tomita, H., Tanaka, K., Tanaka, T., Hara, A. Aldehyde dehydrogenase 1A1 in stem cells and cancer. Oncotarget. 7 (10), 11018-11032 (2016).
- Anorma, C., et al. Surveillance of cancer stem cell plasticity using an isoform-selective fluorescent probe for aldehyde dehydrogenase 1A1. ACS Central Science. 4 (8), 1045-1055 (2018).
- Bearrood, T. E., Aguirre-Figueroa, G., Chan, J. Rational design of a red fluorescent sensor for ALDH1A1 displaying enhanced cellular uptake and reactivity. Bioconjugate Chemistry. 31 (2), 224-228 (2020).
- Chan, J., Dodani, S. C., Chang, C. J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging. Nature Chemistry. 4 (12), 973-984 (2012).
- East, A. K., Lucero, M. Y., Chan, J. New directions of activity-based sensing for in vivo NIR imaging. Chemical Science. 12 (10), 3393-3405 (2021).
- Yadav, A. K., et al. Activity-based NIR bioluminescence probe enables discovery of diet-induced modulation of the tumor microenvironment via nitric oxide. ACS Central Science. 8 (4), 461-472 (2022).
- Yadav, A. K., et al. An activity-based sensing approach for the detection of cyclooxygenase-2 in Live Cells. Angewandte Chemie. 59 (8), 3307-3314 (2020).
- Ueno, T., et al. Rational principles for modulating fluorescence properties of fluorescein. Journal of the American Chemical Society. 126 (43), 14079-14085 (2004).
- Tanaka, F., Mase, N., Barbas 3rd, C. F. Design and use of fluorogenic aldehydes for monitoring the progress of aldehyde transformations. Journal of the American Chemical Society. 126 (12), 3692-3693 (2004).
- Thurber, G. M., Schmidt, M. M., Wittrup, K. D. Antibody tumor penetration: transport opposed by systemic and antigen-mediated clearance. Advanced Drug Delivery Reviews. 60 (12), 1421-1434 (2008).
- Marcato, P., Dean, C. A., Giacomantonio, C. A., Lee, P. W. K. Aldehyde dehydrogenase its role as a cancer stem cell marker comes down to the specific isoform. Cell Cycle. 10 (9), 1378-1384 (2011).
- Meng, E., et al. ALDH1A1 maintains ovarian cancer stem cell-like properties by altered regulation of cell cycle checkpoint and DNA repair network signaling. PLoS One. 9 (9), e107142 (2014).
- Kaipio, K., et al. ALDH1A1-related stemness in high-grade serous ovarian cancer is a negative prognostic indicator but potentially targetable by EGFR/mTOR-PI3K/aurora kinase inhibitors. The Journal of Pathology. 250 (2), 159-169 (2020).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 (ALDH1), in human epithelial cancers. PLoS One. 5 (4), e10277 (2010).
- Chang, B., et al. ALDH1 expression correlates with favorable prognosis in ovarian cancers. Modern Pathology. 22 (6), 817-823 (2009).
- Gardner, S. H., Reinhardt, C. J., Chan, J. Advances in activity-based sensing probes for isoform-selective imaging of enzymatic activity. Angewandte Chemie. 60 (10), 5000-5009 (2021).
- Reid, B. M., Permuth, J. B., Sellers, T. A. Epidemiology of ovarian cancer: a review. Cancer Biology and Medicine. 14 (1), 9-32 (2017).
- Tulake, W., et al. Upregulation of stem cell markers ALDH1A1 and OCT4 as potential biomarkers for the early detection of cervical carcinoma. Oncology Letters. 16 (5), 5525-5534 (2018).
- Nwani, N. G., et al. A novel ALDH1A1 inhibitor targets cells with stem cell characteristics in ovarian cancer. Cancers. 11 (4), 502 (2019).
- Roy, M., Connor, J., Al-Niaimi, A., Rose, S. L., Mahajan, A. Aldehyde dehydrogenase 1A1 (ALDH1A1) expression by immunohistochemistry is associated with chemo-refractoriness in patients with high-grade ovarian serous carcinoma. Human Pathology. 73, 1-6 (2018).
- Landen Jr, C. N., et al. Targeting aldehyde dehydrogenase cancer stem cells in ovarian cancer. Molecular Cancer Therapeutics. 9 (12), 3186-3199 (2010).
- Condello, S., et al. β-catenin-regulated ALDH1A1 is a target in ovarian cancer spheroids. Oncogene. 34 (18), 2297-2308 (2015).
- Storms, R. W., et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proceedings of the National Academy of Sciences. 96 (16), 9118-9123 (1999).
- Duellman, S. J., et al. A bioluminescence assay for aldehyde dehydrogenase activity. Analytical Biochemistry. 434 (2), 226-232 (2013).
- Minn, I., et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase. Nature Communications. 5, 3662 (2014).
- Dollé, L., Boulter, L., Leclercq, I. A., van Grunsven, L. A. Next generation of ALDH substrates and their potential to study maturational lineage biology in stem and progenitor cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (7), 573-578 (2015).
- Yagishita, A., et al. Development of highly selective fluorescent probe enabling flow-cytometric isolation of ALDH3A1-positive viable cells. Bioconjugate Chemistry. 28 (2), 302-306 (2017).
- Maity, S., et al. Thiophene bridged aldehydes (TBAs) image ALDH activity in cells: Via modulation of intramolecular charge transfer. Chemical Science. 8 (10), 7143-7151 (2017).
- Koenders, S. T. A., et al. Development of a retinal-based probe for the profiling of retinaldehyde dehydrogenases in cancer cells. ACS Central Science. 5 (12), 1965-1974 (2019).
- Oe, M., et al. Deep-red/near-infrared turn-on fluorescence probes for aldehyde dehydrogenase 1A1 in cancer stem cells. ACS Sensors. 6 (9), 3320-3329 (2021).
- Yagishita, A., Ueno, T., Tsuchihara, K., Urano, Y. Amino BODIPY-based blue fluorescent probes for aldehyde dehydrogenase 1-expressing cells. Bioconjugate Chemistry. 32 (2), 234-238 (2021).
- Okamoto, A., et al. Identification of breast cancer stem cells using a newly developed long-acting fluorescence probe, C5S-A, targeting ALDH1A1. Anticancer Research. 42 (3), 1199-1205 (2022).

