Применение AlDeSense для стратификации раковых клеток яичников на основе активности альдегиддегидрогеназы 1A1
Summary
Методы измерения активности ALDH1A1 в живых клетках имеют решающее значение в исследованиях рака из-за его статуса биомаркера стволовости. В этом исследовании мы использовали изоформ-селективный флюорогенный зонд для определения относительных уровней активности ALDH1A1 в панели из пяти клеточных линий рака яичников.
Abstract
Рецидив после лечения рака часто связывают с сохранением субпопуляции опухолевых клеток, известных как раковые стволовые клетки (ЦСК), которые характеризуются своей замечательной способностью инициировать опухоль и самообновляться. В зависимости от происхождения опухоли (например, яичников) профиль поверхностных биомаркеров CSC может сильно различаться, что затрудняет идентификацию таких клеток с помощью иммуногистохимического окрашивания. Напротив, альдегиддегидрогеназа 1A1 (ALDH1A1) стала отличным маркером для идентификации ЦСК из-за ее консервативного профиля экспрессии почти во всех клетках-предшественниках, включая ЦСК. Изоформа ALDH1A1 принадлежит к суперсемейству из 19 ферментов, которые отвечают за окисление различных эндогенных и ксенобиотических альдегидов до соответствующих продуктов карбоновой кислоты. Chan et al. недавно разработали AlDeSense, изоформно-селективный «включающийся» зонд для обнаружения активности ALDH1A1, а также нереактивный контрольный реагент согласования (Ctrl-AlDeSense) для учета нецелевого окрашивания. Уже было продемонстрировано, что этот изоформоселективный инструмент является универсальным химическим инструментом благодаря обнаружению активности ALDH1A1 в клетках миелогенного лейкоза K562, маммосферах и ксенотрансплантатах CSC, полученных из меланомы. В этой статье полезность зонда была продемонстрирована с помощью дополнительных экспериментов по флуориметрии, конфокальной микроскопии и проточной цитометрии, где относительная активность ALDH1A1 была определена на панели из пяти клеточных линий рака яичников.
Introduction
Раковые стволовые клетки (ЦСК) представляют собой субпопуляцию опухолевых клеток, которые проявляют свойства, подобные стволовым клеткам1. Подобно своим нераковым аналогам, CSC обладают необычайной способностью к самообновлению и размножению. Вместе с другими встроенными механизмами, такими как активация АТФ-связывающих кассетных транспортеров, ЦСК часто избавлены от первоначальных хирургических усилий по удалению объема, а также от последующей адъювантной терапии2. Из-за их критической роли в резистентностик лечению 3, рецидива4 и метастазирования5 ЦСК стали приоритетом в исследованиях рака. Несмотря на то, что существует множество антигенов клеточной поверхности (например, CD133), которые могут быть использованы для идентификацииCSC6, использование ферментативной активности альдегиддегидрогеназ (ALDH), обнаруженных в цитоплазме, стало привлекательной альтернативой7. ALDH представляют собой суперсемейство из 19 ферментов, ответственных за катализ окисления реакционноспособных эндогенных и ксенобиотических альдегидов до соответствующих продуктов карбоновой кислоты8.
В целом, детоксикация альдегидами имеет решающее значение для защиты клеток от нежелательных событий сшивания и окислительного стресса, которые могут повредить целостность стволовых клеток9. Кроме того, изоформа 1А1 контролирует метаболизм ретиноевой кислоты, который, в свою очередь, влияет на стволовость через передачу сигналов10 ретинальдегида. Недавно был разработан датчик AlDeSense 11,12 на основе низкомолекулярной активности (ABS) для селективного обнаружения активности ALDH1A1. Конструкции ABS обеспечивают обнаружение аналита посредством химического изменения, а не связывания, что обеспечивает высокую селективность и снижает нецелевые реакции13,14,15,16. Принцип конструкции изоформ-селективного флюорогенного зонда основан на механизме17 гашения донорно-фотоиндуцированного переноса электрона (d-PeT), происходящего из альдегидной функциональной группы, который служит для подавления флуоресцентной сигнатуры зонда18. При опосредованном ALDH1A1 превращении в карбоновую кислоту разблокируется радиационная релаксация с образованием высокофлуоресцентного продукта. Поскольку гашение d-PeT никогда не бывает эффективным на 100%, остаточная флуоресценция, которая может привести к возможным ложноположительным результатам, учитывалась при создании этого анализа путем разработки Ctrl-AlDeSense, нечувствительного реагента с соответствующими фотофизическими характеристиками (например, квантовым выходом) и идентичным рисунком цитоплазматического окрашивания в клетках. При использовании в тандеме это уникальное сочетание может надежно отличать клетки с высокой активностью ALDH1A1 от тех, которые демонстрируют низкие уровни с помощью флуориметрии, молекулярной визуализации и проточной цитометрии. Несколько ключевых преимуществ связаны с использованием изоформселективных активируемых красителей перед традиционными иммуногистохимическими методами. Например, предполагается, что ЦСК похоронены глубоко внутри опухоли и, таким образом, более доступны для небольшой молекулы по сравнению с большими антителами19. Кроме того, перевернутый флуоресцентный продукт не ковалентно модифицирует какой-либо клеточный компонент, что означает, что его можно легко удалить с помощью циклов стирки, чтобы оставить CSC в неизмененном состоянии. Наконец, реакция включения идентифицирует только жизнеспособные клетки и функции, как и анализ МТТ, из-за его зависимости от кофактора NAD +.
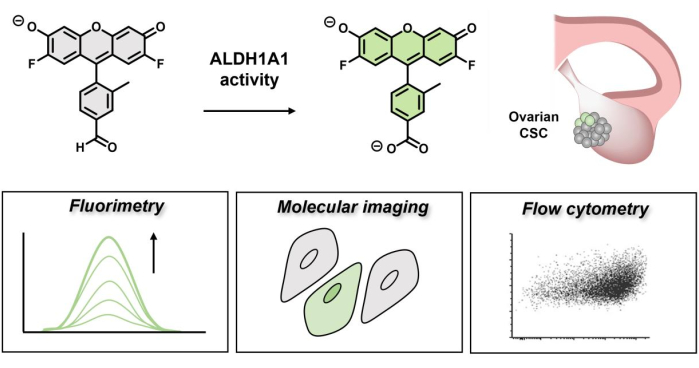
Рисунок 1: Схема, демонстрирующая флуоресцентное включение AlDeSense. Изоформселективный краситель активируется ALDH1A1 и может быть использован для выявления повышенной активности ALDH1A1 в клетках рака яичников с помощью флуориметрии, молекулярной визуализации и проточной цитометрии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
В прошлой работе изоформ-селективный флуорогенный зондовый анализ успешно стратифицировал клетки ALDH high (ALDH +) из клеток ALDH low (ALDH-) в клетках хронического лейкоза человека K562, клетках рака молочной железы человека MDA-MB-231 и клетках меланомы мыши B16F0. Это важно, потому что для многих типов рака высокая экспрессия белка ALDH1A1 означает худший клинический прогноз20. Это предполагает, что повышенные уровни ALDH1A1 указывают на CSCs, которые могут уклоняться от лечения, развивать резистентность и распространяться по всему телу. Однако в случае рака яичников есть исследования, сообщающие об обратном (высокая экспрессия ALDH1A1 связана с улучшением выживаемости пациентов)21,22,23,24. Хотя на первый взгляд это может показаться противоречивым, экспрессия не обязательно коррелирует с активностью фермента, на которую могут влиять изменения микроокружения опухоли (например, поток pH, градиенты кислорода), доступность кофактора NAD + или альдегидных субстратов, уровни карбоновых кислот (ингибирование продукта) и посттрансляционные модификации, которые могут изменять активность фермента25 . Кроме того, рак яичников делится на пять основных гистологических типов (серозный рак высокой степени злокачественности, серозный рак низкой степени злокачественности, эндометриоидный, светлоклеточный и муцинозный), которые, как мы предполагаем, будут иметь различные уровни активности ALDH1A126. С целью изучения активности ALDH1A1 в опухолях яичников был использован изоформ-селективный флюорогенный зондовый анализ для идентификации популяций ALDH1A1+ в панели из пяти клеточных линий рака яичников, принадлежащих к различным гистологическим типам, упомянутым выше. Клеточные линии, протестированные в этом исследовании, включают клетки BG-1, Caov-3, IGROV-1, OVCAR-3 и PEO4, охватывающие светлоклеточные и серозные гистотипы. При этом была подчеркнута универсальность и обобщаемость зонда для идентификации CSC для исследователей, которые стремятся провести аналогичные исследования на других иммортализированных линиях раковых клеток, а также на образцах пациентов. Использование AlDeSense прольет свет на биохимические пути, участвующие в поддержании CSC в сложных микроокружениях тканей, и потенциально послужит клиническим инструментом для определения прогноза и измерения агрессивности рака.
Protocol
Representative Results
Discussion
Панселективность является основным ограничением многих зондов ALDH; Однако недавно было зарегистрировано несколько изоформоселективных примеров 32,33,34,35,36,37,38,39,40,41.<sup class="xref"…
Declarações
The authors have nothing to disclose.
Acknowledgements
Эта работа была поддержана Национальными институтами здравоохранения (R35GM133581 для JC) и стипендией для выпускников Онкологического центра в Иллинойсе (присуждена SG). JC благодарит Фонд Камиллы и Генри Дрейфусов за поддержку. Авторы благодарят доктора Томаса Э. Беарруда за его первоначальный вклад в подготовку акций AlDeSense и AlDeSense AM. Мы благодарим г-на Оливера Д. Пичардо Пегеро и г-на Джозефа А. Форзано за их помощь в подготовке различных синтетических прекурсоров. Мы благодарим профессора Эрика Нельсона (Департамент молекулярной и интегративной физиологии, UIUC) за клетки Caov-3, IGROV-1 и PEO4. Мы благодарим профессора Пауля Хергенротера (химический факультет, UIUC) за клетки BG-1. Мы благодарим основные объекты Института геномной биологии им. Карла Р. Вёзе за доступ к конфокальному микроскопу Zeiss LSM 700 и соответствующему программному обеспечению. Мы благодарим Центр проточной цитометрии за доступ к анализатору BD LSR II CMtO. Мы благодарим доктора Сандру МакМастерс и Cell Media Facility за помощь в подготовке сред для клеточных культур.
Materials
| 0.25% Trypsin, 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate | Corning | 25-050-CI | |
| 1x Phosphate Buffer Saline | Corning | 21-040-CMX12 | |
| AccuSpin Micro 17R | Fisher Scientific | 13-100-675 | |
| AlDeSense | Synthesized in-house | ||
| BG-1 | A gift provided by the Prof. Paul Hergenrother Lab, University of Illinois Urbana-Champaign | ||
| BioLite 25cm2 Flask | Thermo Fisher Scientific | 130189 | |
| Biosafety Cabinet 1300 series A2 | Thermo Fisher Scientific | ||
| Caov-3 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Cell homogenizer | Fisher Scientific | ||
| Centrifuge 5180R | Eppendorf | 22627040 | |
| Contrl-AlDeSense | Synthesized in-house | ||
| DMEM, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5mL | Corning | 352003 | |
| FCS Express 6 | Provided by UIUC CMtO | ||
| FL microscope | EVOS | ||
| Fluorometer | Photon Technology International | ||
| Forma Series II Water-Jacketed CO2 Incubator | Fisher Scientific | 3110 | |
| IGROV-1 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| ImageJ | NIH | ||
| Innova 42R Incubated Shaker | |||
| LSM 700 | Zeiss | ||
| LSR II | BD | ||
| Nunc Lab-Tek Chambered #1.0 Borosicilate Coverglass System | Thermo Fisher Scientific | 155383 | |
| OVCAR-3 | ATCC | HTB-161 | |
| PEO4 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Pierce Protease Inhibitor Tablets | Thermo Scientific | A32963 | |
| Poly-L-Lysine | Cultrex | 3438-100-01 | |
| Rocker | VWR | ||
| RPMI, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| RPMI, 20% FBS, 1% P/S, 0.01 mg/mL Insulin | Prepared by UIUC cell media facility |
Referências
- Bonnet, D., Dick, J. E. Human acute myeloid leukaemia is organised as a heirarchy that originates from a primitive haematopoetic cell. Nature Medicine. 3 (7), 730-737 (1997).
- Begicevic, R. R., Falasca, M. ABC transporters in cancer stem cells: Beyond chemoresistance. International Journal of Molecular Sciences. 18 (11), 2362 (2017).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Islam, F., Gopalan, V., Smith, R. A., Lam, A. K. Y. Translational potential of cancer stem cells: A review of the detection of cancer stem cells and their roles in cancer recurrence and cancer treatment. Experimental Cell Research. 335 (1), 135-147 (2015).
- Li, F., Tiede, B., Massagué, J., Kang, Y. Beyond tumorigenesis: Cancer stem cells in metastasis. Cell Research. 17 (1), 3-14 (2007).
- Kim, W. T., Ryu, C. J. Cancer stem cell surface markers on normal stem cells. BMB Reports. 50 (6), 285-298 (2017).
- Pors, K., Moreb, J. S. Aldehyde dehydrogenases in cancer: An opportunity for biomarker and drug development. Drug Discovery Today. 19 (12), 1953-1963 (2014).
- Jackson, B., et al. Update on the aldehyde dehydrogenase gene (ALDH) superfamily. Human Genomics. 5 (4), 283-303 (2011).
- Vasiliou, V., Pappa, A., Petersen, D. R. Role of aldehyde dehydrogenases in endogenous and xenobiotic metabolism. Chemico-Biological Interactions. 129 (1-2), 1-19 (2000).
- Tomita, H., Tanaka, K., Tanaka, T., Hara, A. Aldehyde dehydrogenase 1A1 in stem cells and cancer. Oncotarget. 7 (10), 11018-11032 (2016).
- Anorma, C., et al. Surveillance of cancer stem cell plasticity using an isoform-selective fluorescent probe for aldehyde dehydrogenase 1A1. ACS Central Science. 4 (8), 1045-1055 (2018).
- Bearrood, T. E., Aguirre-Figueroa, G., Chan, J. Rational design of a red fluorescent sensor for ALDH1A1 displaying enhanced cellular uptake and reactivity. Bioconjugate Chemistry. 31 (2), 224-228 (2020).
- Chan, J., Dodani, S. C., Chang, C. J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging. Nature Chemistry. 4 (12), 973-984 (2012).
- East, A. K., Lucero, M. Y., Chan, J. New directions of activity-based sensing for in vivo NIR imaging. Chemical Science. 12 (10), 3393-3405 (2021).
- Yadav, A. K., et al. Activity-based NIR bioluminescence probe enables discovery of diet-induced modulation of the tumor microenvironment via nitric oxide. ACS Central Science. 8 (4), 461-472 (2022).
- Yadav, A. K., et al. An activity-based sensing approach for the detection of cyclooxygenase-2 in Live Cells. Angewandte Chemie. 59 (8), 3307-3314 (2020).
- Ueno, T., et al. Rational principles for modulating fluorescence properties of fluorescein. Journal of the American Chemical Society. 126 (43), 14079-14085 (2004).
- Tanaka, F., Mase, N., Barbas 3rd, C. F. Design and use of fluorogenic aldehydes for monitoring the progress of aldehyde transformations. Journal of the American Chemical Society. 126 (12), 3692-3693 (2004).
- Thurber, G. M., Schmidt, M. M., Wittrup, K. D. Antibody tumor penetration: transport opposed by systemic and antigen-mediated clearance. Advanced Drug Delivery Reviews. 60 (12), 1421-1434 (2008).
- Marcato, P., Dean, C. A., Giacomantonio, C. A., Lee, P. W. K. Aldehyde dehydrogenase its role as a cancer stem cell marker comes down to the specific isoform. Cell Cycle. 10 (9), 1378-1384 (2011).
- Meng, E., et al. ALDH1A1 maintains ovarian cancer stem cell-like properties by altered regulation of cell cycle checkpoint and DNA repair network signaling. PLoS One. 9 (9), e107142 (2014).
- Kaipio, K., et al. ALDH1A1-related stemness in high-grade serous ovarian cancer is a negative prognostic indicator but potentially targetable by EGFR/mTOR-PI3K/aurora kinase inhibitors. The Journal of Pathology. 250 (2), 159-169 (2020).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 (ALDH1), in human epithelial cancers. PLoS One. 5 (4), e10277 (2010).
- Chang, B., et al. ALDH1 expression correlates with favorable prognosis in ovarian cancers. Modern Pathology. 22 (6), 817-823 (2009).
- Gardner, S. H., Reinhardt, C. J., Chan, J. Advances in activity-based sensing probes for isoform-selective imaging of enzymatic activity. Angewandte Chemie. 60 (10), 5000-5009 (2021).
- Reid, B. M., Permuth, J. B., Sellers, T. A. Epidemiology of ovarian cancer: a review. Cancer Biology and Medicine. 14 (1), 9-32 (2017).
- Tulake, W., et al. Upregulation of stem cell markers ALDH1A1 and OCT4 as potential biomarkers for the early detection of cervical carcinoma. Oncology Letters. 16 (5), 5525-5534 (2018).
- Nwani, N. G., et al. A novel ALDH1A1 inhibitor targets cells with stem cell characteristics in ovarian cancer. Cancers. 11 (4), 502 (2019).
- Roy, M., Connor, J., Al-Niaimi, A., Rose, S. L., Mahajan, A. Aldehyde dehydrogenase 1A1 (ALDH1A1) expression by immunohistochemistry is associated with chemo-refractoriness in patients with high-grade ovarian serous carcinoma. Human Pathology. 73, 1-6 (2018).
- Landen Jr, C. N., et al. Targeting aldehyde dehydrogenase cancer stem cells in ovarian cancer. Molecular Cancer Therapeutics. 9 (12), 3186-3199 (2010).
- Condello, S., et al. β-catenin-regulated ALDH1A1 is a target in ovarian cancer spheroids. Oncogene. 34 (18), 2297-2308 (2015).
- Storms, R. W., et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proceedings of the National Academy of Sciences. 96 (16), 9118-9123 (1999).
- Duellman, S. J., et al. A bioluminescence assay for aldehyde dehydrogenase activity. Analytical Biochemistry. 434 (2), 226-232 (2013).
- Minn, I., et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase. Nature Communications. 5, 3662 (2014).
- Dollé, L., Boulter, L., Leclercq, I. A., van Grunsven, L. A. Next generation of ALDH substrates and their potential to study maturational lineage biology in stem and progenitor cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (7), 573-578 (2015).
- Yagishita, A., et al. Development of highly selective fluorescent probe enabling flow-cytometric isolation of ALDH3A1-positive viable cells. Bioconjugate Chemistry. 28 (2), 302-306 (2017).
- Maity, S., et al. Thiophene bridged aldehydes (TBAs) image ALDH activity in cells: Via modulation of intramolecular charge transfer. Chemical Science. 8 (10), 7143-7151 (2017).
- Koenders, S. T. A., et al. Development of a retinal-based probe for the profiling of retinaldehyde dehydrogenases in cancer cells. ACS Central Science. 5 (12), 1965-1974 (2019).
- Oe, M., et al. Deep-red/near-infrared turn-on fluorescence probes for aldehyde dehydrogenase 1A1 in cancer stem cells. ACS Sensors. 6 (9), 3320-3329 (2021).
- Yagishita, A., Ueno, T., Tsuchihara, K., Urano, Y. Amino BODIPY-based blue fluorescent probes for aldehyde dehydrogenase 1-expressing cells. Bioconjugate Chemistry. 32 (2), 234-238 (2021).
- Okamoto, A., et al. Identification of breast cancer stem cells using a newly developed long-acting fluorescence probe, C5S-A, targeting ALDH1A1. Anticancer Research. 42 (3), 1199-1205 (2022).

