Toepassing van AlDeSense om eierstokkankercellen te stratificeren op basis van aldehydedehydrogenase 1A1-activiteit
Summary
Methoden om ALDH1A1-activiteit in levende cellen te meten zijn van cruciaal belang in kankeronderzoek vanwege de status als biomarker van stam. In deze studie gebruikten we een isovormselectieve fluorogene sonde om de relatieve niveaus van ALDH1A1-activiteit te bepalen in een panel van vijf eierstokkankercellijnen.
Abstract
Terugval na kankerbehandeling wordt vaak toegeschreven aan de persistentie van een subpopulatie van tumorcellen die bekend staat als kankerstamcellen (CSC’s), die worden gekenmerkt door hun opmerkelijke tumor-initiërende en zelfvernieuwende vermogen. Afhankelijk van de oorsprong van de tumor (bijv. Eierstokken), kan het CSC-oppervlaktebiomarkerprofiel dramatisch variëren, waardoor de identificatie van dergelijke cellen via immunohistochemische kleuring een uitdagende onderneming wordt. Integendeel, aldehydedehydrogenase 1A1 (ALDH1A1) is naar voren gekomen als een uitstekende marker om CSC’s te identificeren, vanwege het geconserveerde expressieprofiel in bijna alle voorlopercellen, inclusief CSC’s. De ALDH1A1-isovorm behoort tot een superfamilie van 19 enzymen die verantwoordelijk zijn voor de oxidatie van verschillende endogene en xenobiotische aldehyden tot de overeenkomstige carbonzuurproducten. Chan et al. hebben onlangs AlDeSense ontwikkeld, een isovormselectieve “turn-on” probe voor de detectie van ALDH1A1-activiteit, evenals een niet-reactief matching control reagens (Ctrl-AlDeSense) om rekening te houden met off-target kleuring. Van dit isovormselectieve hulpmiddel is al aangetoond dat het een veelzijdig chemisch hulpmiddel is door de detectie van ALDH1A1-activiteit in K562 myelogene leukemiecellen, mammospheres en van melanoom afgeleide CSC-xenografts. In dit artikel werd het nut van de sonde aangetoond door middel van aanvullende fluorimetrie, confocale microscopie en flowcytometrie-experimenten waarbij de relatieve ALDH1A1-activiteit werd bepaald in een panel van vijf eierstokkankercellijnen.
Introduction
Kankerstamcellen (CSC’s) zijn een subpopulatie van tumorcellen die stamcelachtige eigenschappen vertonen1. Net als hun niet-kankerachtige tegenhangers bezitten CSC’s het buitengewone vermogen om zichzelf te vernieuwen en te vermenigvuldigen. Samen met andere ingebouwde mechanismen, zoals de upregulatie van ATP-bindende cassettetransporters, worden CSC’s vaak gespaard van initiële chirurgische debulking-inspanningen, evenals daaropvolgende adjuvante therapie2. Vanwege hun cruciale rol in behandelingsresistentie3, terugval4 en metastase5, zijn CSC’s een prioriteit geworden in kankeronderzoek. Hoewel er een verscheidenheid aan celoppervlakantigenen (bijv. CD133) zijn die kunnen worden gebruikt om CSC’s6 te identificeren, is het benutten van de enzymatische activiteit van aldehydedehydrogenasen (ALDHs) in het cytoplasma naar voren gekomen als een aantrekkelijk alternatief7. ALDH’s zijn een superfamilie van 19 enzymen die verantwoordelijk zijn voor het katalyseren van de oxidatie van reactieve endogene en xenobiotische aldehyden tot de overeenkomstige carbonzuurproducten8.
Over het algemeen is aldehyde-ontgifting cruciaal bij het beschermen van cellen tegen ongewenste crosslinking-gebeurtenissen en oxidatieve stress die de integriteit van stamcellen kunnen schaden9. Bovendien regelt de 1A1-isovorm het retinoïnezuurmetabolisme, dat op zijn beurt de stengelheid beïnvloedt via retinaldehyde-signalering10. AlDeSense 11,12, een kleine-molecuul activity-based sensing (ABS) sonde om selectief ALDH1A1-activiteit te detecteren, is onlangs ontwikkeld. ABS-ontwerpen bereiken analytdetectie door middel van een chemische verandering in plaats van een bindingsgebeurtenis, waardoor een hoge selectiviteit en verminderde off-target responsenmogelijk zijn 13,14,15,16. Het ontwerpprincipe van de isovormselectieve fluorogene sonde is gebaseerd op een donor-foto-geïnduceerde elektronenoverdracht (d-PeT) blusmechanisme17, afkomstig van de aldehyde-functionele groep, die dient om de fluorescerende handtekening van de sonde18 te onderdrukken. Bij ALDH1A1-gemedieerde omzetting naar carbonzuur wordt stralingsrelaxatie ontgrendeld om een zeer fluorescerend product te verkrijgen. Omdat d-PeT-blussing nooit 100% efficiënt is, werd de resterende fluorescentie die kan leiden tot mogelijke vals-positieve resultaten overwogen bij het vaststellen van deze test door de ontwikkeling van Ctrl-AlDeSense, een niet-responsief reagens met overeenkomende fotofysische kenmerken (bijv. Kwantumopbrengst) en een identiek cytoplasmatisch kleuringspatroon in cellen. Wanneer deze unieke koppeling in combinatie wordt gebruikt, kan deze op betrouwbare wijze cellen met een hoge ALDH1A1-activiteit onderscheiden van cellen die lage niveaus vertonen via fluorimetrie, moleculaire beeldvorming en flowcytometrie. Verschillende belangrijke voordelen zijn verbonden aan het gebruik van isoform-selectieve activatable kleurstoffen ten opzichte van traditionele immunohistochemische methoden. Er wordt bijvoorbeeld verondersteld dat CSC’s diep in een tumor worden begraven en dus toegankelijker zijn voor een klein molecuul in vergelijking met grote antilichamen19. Bovendien wijzigt het omgedraaide fluorescerende product geen enkele cellulaire component, wat betekent dat het gemakkelijk kan worden verwijderd via wascycli om een CSC in een ongewijzigde toestand te laten. Ten slotte identificeert de turn-on respons alleen levensvatbare cellen en functies, net als de MTT-test, vanwege de afhankelijkheid van de NAD + -cofactor.
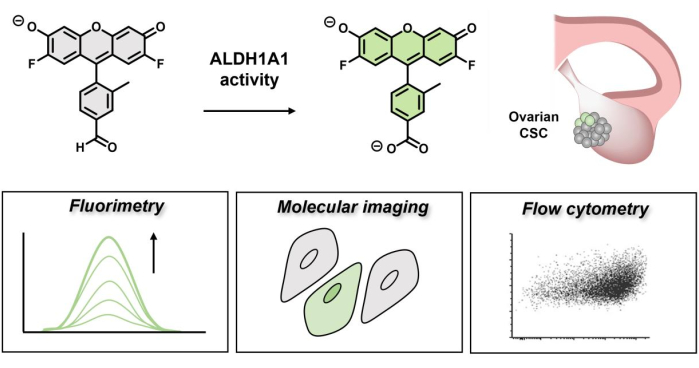
Figuur 1: Schematische weergave van de fluorescerende inschakeling van AlDeSense. De isovormselectieve kleurstof wordt geactiveerd door ALDH1A1 en kan worden gebruikt om verhoogde ALDH1A1-activiteit in eierstokkankercellen te identificeren via fluorimetrie, moleculaire beeldvorming en flowcytometrie. Klik hier om een grotere versie van deze figuur te bekijken.
In eerder werk heeft de isovormselectieve fluorogene sondetest met succes ALDH-hoge (ALDH +) -cellen gestratificeerd van ALDH-lage (ALDH-) cellen in K562 menselijke chronische leukemiecellen, MDA-MB-231 menselijke borstkankercellen en B16F0-muizenmelanoomcellen. Dit is belangrijk omdat, voor veel soorten kanker, een hoge ALDH1A1-eiwitexpressie een slechtere klinische prognose betekent20. Dit veronderstelt dat verhoogde niveaus van ALDH1A1 indicatief zijn voor CSC’s die de behandeling kunnen ontwijken, resistentie kunnen ontwikkelen en zich door het hele lichaam kunnen verspreiden. In het geval van eierstokkanker zijn er echter studies die de tegenovergestelde bevinding melden (hoge ALDH1A1-expressie is gekoppeld aan verbeterde overleving van de patiënt)21,22,23,24. Hoewel dit op het eerste gezicht tegenstrijdig lijkt, correleert expressie niet noodzakelijkerwijs met enzymactiviteit, die kan worden beïnvloed door veranderingen in de micro-omgeving van de tumor (bijv. pH-flux, zuurstofgradiënten), beschikbaarheid van de NAD + -cofactor of aldehydesubstraten, niveaus van carbonzuren (productremming) en posttranslationele modificaties die de enzymactiviteit kunnen veranderen25 . Bovendien is eierstokkanker verdeeld in vijf belangrijke histologische typen (hooggradig sereus, laaggradig sereus, endometrioïde, heldere cel en mucineus), waarvan we veronderstellen dat ze variabele niveaus van ALDH1A1-activiteit zullen hebben26. Met het doel om ALDH1A1-activiteit in eierstoktumoren te onderzoeken, werd een isovormselectieve fluorogene sondetest gebruikt om ALDH1A1 + -populaties te identificeren in een panel van vijf eierstokkankercellijnen die behoren tot de verschillende histologische typen die hierboven zijn genoemd. De cellijnen die in deze studie zijn getest, omvatten BG-1-, Caov-3-, IGROV-1-, OVCAR-3- en PEO4-cellen, die heldere cel- en sereuze histotypen omvatten. Hierin werd de veelzijdigheid en generaliseerbaarheid van de sonde benadrukt om CSC’s te identificeren voor de onderzoekers die vergelijkbare studies willen uitvoeren in andere vereeuwigde kankercellijnen en patiëntenmonsters. Het gebruik van AlDeSense zal licht werpen op de biochemische routes die betrokken zijn bij CSC-onderhoud in complexe weefselmicro-omgevingen en mogelijk dienen als een klinisch hulpmiddel voor het bepalen van de prognose en het meten van de agressiviteit van kanker.
Protocol
Representative Results
Discussion
Pan-selectiviteit is een belangrijke beperking van veel ALDH-sondes; Er zijn echter onlangs verschillende isovormselectieve voorbeelden gemeld 32,33,34,35,36,37,38,39,40,41. De isovormsel…
Declarações
The authors have nothing to disclose.
Acknowledgements
Dit werk werd ondersteund door The National Institutes of Health (R35GM133581 naar JC) en het Cancer Center at Illinois Graduate Scholarship (toegekend aan SG). JC bedankt de Camille and Henry Dreyfus Foundation voor de steun. De auteurs bedanken Dr. Thomas E. Bearrood voor zijn eerste bijdrage aan het voorbereiden van voorraden AlDeSense en AlDeSense AM. Wij danken de heer Oliver D. Pichardo Peguero en de heer Joseph A. Forzano voor hun hulp bij het bereiden van verschillende synthetische precursoren. We danken Prof. Erik Nelson (Department of Molecular and Integrative Physiology, UIUC) voor Caov-3, IGROV-1 en PEO4 cellen. Wij danken Prof. Paul Hergenrother (Vakgroep Chemie, UIUC) voor BG-1 cellen. We danken de Core Facilities van het Carl R. Woese Institute for Genomic Biology voor de toegang tot de Zeiss LSM 700 Confocal Microscope en bijbehorende software. We danken de Flow Cytometry Facility voor de toegang tot BD LSR II CMtO Analyzer. We danken Dr. Sandra McMasters en de Cell Media Facility voor hun hulp bij het voorbereiden van celkweekmedia.
Materials
| 0.25% Trypsin, 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate | Corning | 25-050-CI | |
| 1x Phosphate Buffer Saline | Corning | 21-040-CMX12 | |
| AccuSpin Micro 17R | Fisher Scientific | 13-100-675 | |
| AlDeSense | Synthesized in-house | ||
| BG-1 | A gift provided by the Prof. Paul Hergenrother Lab, University of Illinois Urbana-Champaign | ||
| BioLite 25cm2 Flask | Thermo Fisher Scientific | 130189 | |
| Biosafety Cabinet 1300 series A2 | Thermo Fisher Scientific | ||
| Caov-3 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Cell homogenizer | Fisher Scientific | ||
| Centrifuge 5180R | Eppendorf | 22627040 | |
| Contrl-AlDeSense | Synthesized in-house | ||
| DMEM, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5mL | Corning | 352003 | |
| FCS Express 6 | Provided by UIUC CMtO | ||
| FL microscope | EVOS | ||
| Fluorometer | Photon Technology International | ||
| Forma Series II Water-Jacketed CO2 Incubator | Fisher Scientific | 3110 | |
| IGROV-1 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| ImageJ | NIH | ||
| Innova 42R Incubated Shaker | |||
| LSM 700 | Zeiss | ||
| LSR II | BD | ||
| Nunc Lab-Tek Chambered #1.0 Borosicilate Coverglass System | Thermo Fisher Scientific | 155383 | |
| OVCAR-3 | ATCC | HTB-161 | |
| PEO4 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Pierce Protease Inhibitor Tablets | Thermo Scientific | A32963 | |
| Poly-L-Lysine | Cultrex | 3438-100-01 | |
| Rocker | VWR | ||
| RPMI, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| RPMI, 20% FBS, 1% P/S, 0.01 mg/mL Insulin | Prepared by UIUC cell media facility |
Referências
- Bonnet, D., Dick, J. E. Human acute myeloid leukaemia is organised as a heirarchy that originates from a primitive haematopoetic cell. Nature Medicine. 3 (7), 730-737 (1997).
- Begicevic, R. R., Falasca, M. ABC transporters in cancer stem cells: Beyond chemoresistance. International Journal of Molecular Sciences. 18 (11), 2362 (2017).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Islam, F., Gopalan, V., Smith, R. A., Lam, A. K. Y. Translational potential of cancer stem cells: A review of the detection of cancer stem cells and their roles in cancer recurrence and cancer treatment. Experimental Cell Research. 335 (1), 135-147 (2015).
- Li, F., Tiede, B., Massagué, J., Kang, Y. Beyond tumorigenesis: Cancer stem cells in metastasis. Cell Research. 17 (1), 3-14 (2007).
- Kim, W. T., Ryu, C. J. Cancer stem cell surface markers on normal stem cells. BMB Reports. 50 (6), 285-298 (2017).
- Pors, K., Moreb, J. S. Aldehyde dehydrogenases in cancer: An opportunity for biomarker and drug development. Drug Discovery Today. 19 (12), 1953-1963 (2014).
- Jackson, B., et al. Update on the aldehyde dehydrogenase gene (ALDH) superfamily. Human Genomics. 5 (4), 283-303 (2011).
- Vasiliou, V., Pappa, A., Petersen, D. R. Role of aldehyde dehydrogenases in endogenous and xenobiotic metabolism. Chemico-Biological Interactions. 129 (1-2), 1-19 (2000).
- Tomita, H., Tanaka, K., Tanaka, T., Hara, A. Aldehyde dehydrogenase 1A1 in stem cells and cancer. Oncotarget. 7 (10), 11018-11032 (2016).
- Anorma, C., et al. Surveillance of cancer stem cell plasticity using an isoform-selective fluorescent probe for aldehyde dehydrogenase 1A1. ACS Central Science. 4 (8), 1045-1055 (2018).
- Bearrood, T. E., Aguirre-Figueroa, G., Chan, J. Rational design of a red fluorescent sensor for ALDH1A1 displaying enhanced cellular uptake and reactivity. Bioconjugate Chemistry. 31 (2), 224-228 (2020).
- Chan, J., Dodani, S. C., Chang, C. J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging. Nature Chemistry. 4 (12), 973-984 (2012).
- East, A. K., Lucero, M. Y., Chan, J. New directions of activity-based sensing for in vivo NIR imaging. Chemical Science. 12 (10), 3393-3405 (2021).
- Yadav, A. K., et al. Activity-based NIR bioluminescence probe enables discovery of diet-induced modulation of the tumor microenvironment via nitric oxide. ACS Central Science. 8 (4), 461-472 (2022).
- Yadav, A. K., et al. An activity-based sensing approach for the detection of cyclooxygenase-2 in Live Cells. Angewandte Chemie. 59 (8), 3307-3314 (2020).
- Ueno, T., et al. Rational principles for modulating fluorescence properties of fluorescein. Journal of the American Chemical Society. 126 (43), 14079-14085 (2004).
- Tanaka, F., Mase, N., Barbas 3rd, C. F. Design and use of fluorogenic aldehydes for monitoring the progress of aldehyde transformations. Journal of the American Chemical Society. 126 (12), 3692-3693 (2004).
- Thurber, G. M., Schmidt, M. M., Wittrup, K. D. Antibody tumor penetration: transport opposed by systemic and antigen-mediated clearance. Advanced Drug Delivery Reviews. 60 (12), 1421-1434 (2008).
- Marcato, P., Dean, C. A., Giacomantonio, C. A., Lee, P. W. K. Aldehyde dehydrogenase its role as a cancer stem cell marker comes down to the specific isoform. Cell Cycle. 10 (9), 1378-1384 (2011).
- Meng, E., et al. ALDH1A1 maintains ovarian cancer stem cell-like properties by altered regulation of cell cycle checkpoint and DNA repair network signaling. PLoS One. 9 (9), e107142 (2014).
- Kaipio, K., et al. ALDH1A1-related stemness in high-grade serous ovarian cancer is a negative prognostic indicator but potentially targetable by EGFR/mTOR-PI3K/aurora kinase inhibitors. The Journal of Pathology. 250 (2), 159-169 (2020).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 (ALDH1), in human epithelial cancers. PLoS One. 5 (4), e10277 (2010).
- Chang, B., et al. ALDH1 expression correlates with favorable prognosis in ovarian cancers. Modern Pathology. 22 (6), 817-823 (2009).
- Gardner, S. H., Reinhardt, C. J., Chan, J. Advances in activity-based sensing probes for isoform-selective imaging of enzymatic activity. Angewandte Chemie. 60 (10), 5000-5009 (2021).
- Reid, B. M., Permuth, J. B., Sellers, T. A. Epidemiology of ovarian cancer: a review. Cancer Biology and Medicine. 14 (1), 9-32 (2017).
- Tulake, W., et al. Upregulation of stem cell markers ALDH1A1 and OCT4 as potential biomarkers for the early detection of cervical carcinoma. Oncology Letters. 16 (5), 5525-5534 (2018).
- Nwani, N. G., et al. A novel ALDH1A1 inhibitor targets cells with stem cell characteristics in ovarian cancer. Cancers. 11 (4), 502 (2019).
- Roy, M., Connor, J., Al-Niaimi, A., Rose, S. L., Mahajan, A. Aldehyde dehydrogenase 1A1 (ALDH1A1) expression by immunohistochemistry is associated with chemo-refractoriness in patients with high-grade ovarian serous carcinoma. Human Pathology. 73, 1-6 (2018).
- Landen Jr, C. N., et al. Targeting aldehyde dehydrogenase cancer stem cells in ovarian cancer. Molecular Cancer Therapeutics. 9 (12), 3186-3199 (2010).
- Condello, S., et al. β-catenin-regulated ALDH1A1 is a target in ovarian cancer spheroids. Oncogene. 34 (18), 2297-2308 (2015).
- Storms, R. W., et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proceedings of the National Academy of Sciences. 96 (16), 9118-9123 (1999).
- Duellman, S. J., et al. A bioluminescence assay for aldehyde dehydrogenase activity. Analytical Biochemistry. 434 (2), 226-232 (2013).
- Minn, I., et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase. Nature Communications. 5, 3662 (2014).
- Dollé, L., Boulter, L., Leclercq, I. A., van Grunsven, L. A. Next generation of ALDH substrates and their potential to study maturational lineage biology in stem and progenitor cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (7), 573-578 (2015).
- Yagishita, A., et al. Development of highly selective fluorescent probe enabling flow-cytometric isolation of ALDH3A1-positive viable cells. Bioconjugate Chemistry. 28 (2), 302-306 (2017).
- Maity, S., et al. Thiophene bridged aldehydes (TBAs) image ALDH activity in cells: Via modulation of intramolecular charge transfer. Chemical Science. 8 (10), 7143-7151 (2017).
- Koenders, S. T. A., et al. Development of a retinal-based probe for the profiling of retinaldehyde dehydrogenases in cancer cells. ACS Central Science. 5 (12), 1965-1974 (2019).
- Oe, M., et al. Deep-red/near-infrared turn-on fluorescence probes for aldehyde dehydrogenase 1A1 in cancer stem cells. ACS Sensors. 6 (9), 3320-3329 (2021).
- Yagishita, A., Ueno, T., Tsuchihara, K., Urano, Y. Amino BODIPY-based blue fluorescent probes for aldehyde dehydrogenase 1-expressing cells. Bioconjugate Chemistry. 32 (2), 234-238 (2021).
- Okamoto, A., et al. Identification of breast cancer stem cells using a newly developed long-acting fluorescence probe, C5S-A, targeting ALDH1A1. Anticancer Research. 42 (3), 1199-1205 (2022).

