एनेस्थेटाइज्ड चूहों में एक्स्ट्राक्रेनियल उत्तेजक इलेक्ट्रोड की नियुक्ति और सेरेब्रल रक्त प्रवाह और इंट्राक्रैनील विद्युत क्षेत्रों का माप
Summary
हम मस्तिष्क विद्युत क्षेत्र माप और एक प्रासंगिक बायोमार्कर-सेरेब्रल रक्त प्रवाह के संदर्भ में एक्स्ट्राक्रेनियल उत्तेजना के लिए खुराक-प्रतिक्रिया वक्रों का आकलन करने के लिए एक प्रोटोकॉल का वर्णन करते हैं। चूंकि इस प्रोटोकॉल में मस्तिष्क में इनवेसिव इलेक्ट्रोड प्लेसमेंट शामिल है, इसलिए सामान्य संज्ञाहरण की आवश्यकता होती है, जिसमें नियंत्रित श्वसन के बजाय सहज श्वास पसंद किया जाता है।
Abstract
न्यूरोनल सक्रियण के विभिन्न रूपों के लिए सेरेब्रल रक्त प्रवाह (सीबीएफ) प्रतिक्रियाओं का पता लगाना गतिशील मस्तिष्क समारोह और मस्तिष्क को सब्सट्रेट आपूर्ति में भिन्नता को समझने के लिए महत्वपूर्ण है। यह पेपर ट्रांसक्रैनियल अल्टरनेटिंग करंट स्टिमुलेशन (टीएसीएस) के लिए सीबीएफ प्रतिक्रियाओं को मापने के लिए एक प्रोटोकॉल का वर्णन करता है। खुराक-प्रतिक्रिया वक्रों का अनुमान टीएसीएस (एमए) और इंट्राक्रैनील इलेक्ट्रिक फील्ड (एमवी / मिमी) के साथ होने वाले सीबीएफ परिवर्तन दोनों से लगाया जाता है। हम मस्तिष्क के प्रत्येक पक्ष के भीतर ग्लास माइक्रोइलेक्ट्रोड द्वारा मापा गया विभिन्न आयामों के आधार पर इंट्राक्रैनील विद्युत क्षेत्र का अनुमान लगाते हैं। इस पेपर में, हम प्रयोगात्मक सेटअप का वर्णन करते हैं, जिसमें सीबीएफ को मापने के लिए द्विपक्षीय लेजर डॉपलर (एलडी) जांच या लेजर स्पॉट इमेजिंग (एलएसआई) का उपयोग करना शामिल है; नतीजतन, इस सेटअप को इलेक्ट्रोड प्लेसमेंट और स्थिरता के लिए संज्ञाहरण की आवश्यकता होती है। हम सीबीएफ प्रतिक्रिया और वर्तमान के बीच एक सहसंबंध प्रस्तुत करते हैं, जो पुराने जानवरों (28-32 सप्ताह) (पी < 0.005 अंतर) की तुलना में युवा नियंत्रण जानवरों (12-14 सप्ताह) में उच्च धाराओं (1.5 एमए और 2.0 एमए) पर काफी बड़ी प्रतिक्रिया दिखाते हैं। हम विद्युत क्षेत्र की ताकत < 5 एमवी / मिमी पर एक महत्वपूर्ण सीबीएफ प्रतिक्रिया भी प्रदर्शित करते हैं, जो अंतिम मानव अध्ययन के लिए एक महत्वपूर्ण विचार है। ये सीबीएफ प्रतिक्रियाएं जागृत जानवरों की तुलना में संज्ञाहरण के उपयोग, श्वसन नियंत्रण (यानी, इंटुबेटेड बनाम सहज श्वास), प्रणालीगत कारकों (यानी, सीओ2), और रक्त वाहिकाओं के भीतर स्थानीय चालन से भी प्रभावित होती हैं, जो पेरिसाइट्स और एंडोथेलियल कोशिकाओं द्वारा मध्यस्थता की जाती है। इसी तरह, अधिक विस्तृत इमेजिंग / रिकॉर्डिंग तकनीक पूरे मस्तिष्क से क्षेत्र के आकार को केवल एक छोटे से क्षेत्र तक सीमित कर सकती है। हम टीएसीएस उत्तेजना को लागू करने के लिए एक्स्ट्राक्रैनियल इलेक्ट्रोड के उपयोग का वर्णन करते हैं, जिसमें कृन्तकों के लिए घर का बना और वाणिज्यिक इलेक्ट्रोड डिजाइन दोनों शामिल हैं, द्विपक्षीय ग्लास डीसी रिकॉर्डिंग इलेक्ट्रोड का उपयोग करके सीबीएफ और इंट्राक्रैनील विद्युत क्षेत्र का समवर्ती माप, और इमेजिंग दृष्टिकोण। हम वर्तमान में अल्जाइमर रोग और स्ट्रोक के पशु मॉडल में सीबीएफ को बढ़ाने के लिए एक बंद-लूप प्रारूप को लागू करने के लिए इन तकनीकों को लागू कर रहे हैं।
Introduction
ट्रांसक्रैनियल इलेक्ट्रिकल उत्तेजना (टीईएस; साइन वेव उत्तेजना के साथ, टीएसीएस) मस्तिष्क न्यूरोमॉड्यूलेशन1,2 के लिए एक सामान्य, बाहरी, गैर-इनवेसिव दृष्टिकोण है। पहले, हमने अनुमान लगाया था कि कुछ खुराक पर, टीईएस (और विशेष रूप से टीएसीएस) अंतर्निहितमस्तिष्क क्षेत्रों में सेरेब्रल रक्त प्रवाह (सीबीएफ) को बढ़ा सकता है। इसके अलावा, बाहरी प्रवाह या इंट्राक्रैनील विद्युत क्षेत्र और परिणामस्वरूप सीबीएफ प्रतिक्रियाओं के बीच एक खुराक-प्रतिक्रिया संबंध मौजूद हो सकता है। हालांकि, अधिकांश नैदानिक उत्तेजना प्रोटोकॉल ने उपचार प्रोटोकॉल 4,5 के रूप में निर्धारित अवधि (यानी, 30-45 मिनट) के लिए उत्तेजना के अधिकतम आरामदायक त्वचा स्तर (यानी, ~ 2 एमए) पर ध्यान केंद्रित किया है। कृन्तकों में, टीईएस6 द्वारा प्रेरित मस्तिष्क में विद्युत क्षेत्रों की जांच के लिए सीधे खोपड़ी पर लागू आक्रामक, एक्स्ट्राक्रेनियल मस्तिष्क इलेक्ट्रोड का उपयोग करना संभव है। इसलिए, इस दृष्टिकोण का लक्ष्य खुराक-प्रतिक्रिया संबंध के संदर्भ में सीबीएफ परिवर्तनों पर प्रासंगिक आवृत्तियों पर टीएसीएस की तीव्रता के प्रभावों को निर्धारित करना है। यह खुराक-प्रतिक्रिया वक्र मस्तिष्क3 पर लगाए गए विद्युत क्षेत्र के संबंध में सीबीएफ के अल्पकालिक शारीरिक बायोमार्कर-प्रत्यक्ष माप पर आधारित है। हमने पहले दिखाया है कि, बड़े आयामों पर, आमतौर पर टीएसीएस द्वारा प्रेरित मस्तिष्क के भीतर विद्युत क्षेत्रों की सीमा से परे, कॉर्टेक्स3 में प्रेरित विद्युत क्षेत्र और सीबीएफ के बीच एक निकट-रैखिक सहसंबंध होता है। हालांकि, छोटे-क्षेत्र उत्तेजना (यानी, 1-5 एमवी / मिमी तीव्रता) मनुष्यों में उपयोग के लिए अधिक प्रासंगिक और व्यवहार्य हो सकती है; इसलिए, हमने छोटे सीबीएफ परिवर्तनों का पता लगाने के लिए अपनी तकनीकों को संशोधित किया है।
यह पेपर सीबीएफ (यानी, 0.5-2.0 एमए करंट, 1-5 एमवी / मिमी विद्युत क्षेत्र) पर निचले-क्षेत्र की ताकत टीईएस अल्टरनेटिंग साइन धाराओं (टीएसीएस) के प्रभावों का विश्लेषण करने के लिए एक प्रोटोकॉल का वर्णन करता है, जिसे जागृत कृन्तकों द्वारा सहन किया जासकता है। इस प्रोटोकॉल में टीएसीएस के दौरान नोवेल लेजर स्पॉट इमेजिंग के साथ-साथ दोहरे इंट्राक्रैनील ग्लास इलेक्ट्रोड का उपयोग शामिल है, ताकि मस्तिष्क के भीतर सक्रिय टीएसीएस के प्रसार (जैसा कि सीबीएफ द्वारा निगरानी की जाती है) और इंट्राक्रैनील इलेक्ट्रिकल फील्ड तीव्रता दोनों को निर्धारित किया जा सके, जिसे आरेख और वास्तविक प्रयोगात्मक तस्वीर (चित्रा 1) दोनों के रूप में दिखाया गया है। मस्तिष्क के भीतर टीईएस के कई संभावित शारीरिक प्रभाव हैं, जिनमें प्रत्यक्ष न्यूरोनल मॉड्यूलेशन, तंत्रिका प्लास्टिसिटी और एस्ट्रोसाइट सक्रियण 7,8 शामिल हैं। हालांकि सीबीएफ को टीडीसीएस 9,10 के साथ मापा गया है, ये माप मस्तिष्क में खुराक-प्रतिक्रिया समारोह का आकलन करने के लिए धीमा, अप्रत्यक्ष और अपर्याप्त थे। इसलिए, उचित अल्पकालिक बायोमाकर्स (यानी, सीबीएफ, विद्युत क्षेत्र) और टीएसीएस के तेजी से ऑन / ऑफ अनुक्रमों का उपयोग करके, अब हम खुराक-प्रतिक्रिया समारोह का अधिक सटीक अनुमान लगा सकते हैं। इसके अलावा, हम सीबीएफ को मापने के लिए विभिन्न तकनीकों को लागू कर सकते हैं, जिसमें फोकल लेजर डॉपलर प्रोब्स (एलडी) और लेजर स्पॉट इमेजिंग (एलएसआई) दोनों शामिल हैं।
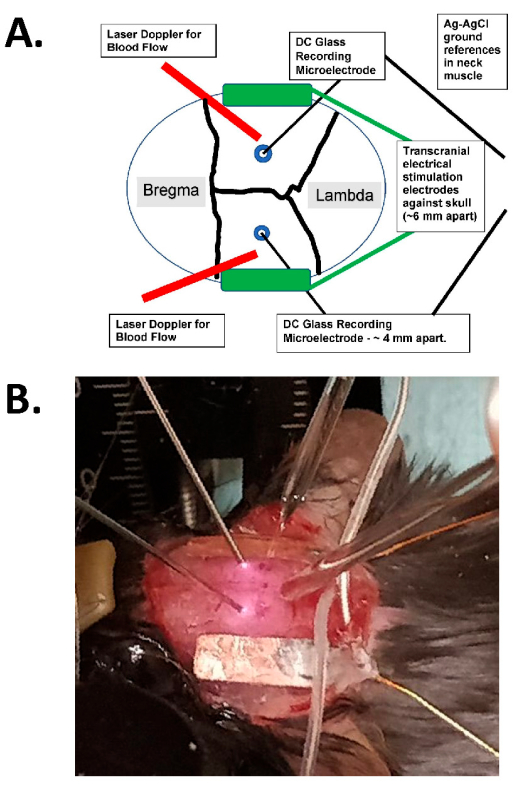
चित्र 1: ट्रांसक्रैनियल उत्तेजना आरेख और फोटोग्राफिक उदाहरण। (ए) ट्रांसक्रैनियल उत्तेजना सेटअप का आरेख। आरेख एक माउस खोपड़ी को कोरोनल और धनु सीवन के साथ दिखाता है। ट्रांसक्रैनियल इलेक्ट्रोड को खोपड़ी पर पार्श्व और सममित रूप से रखा जाता है और इलेक्ट्रोड और खोपड़ी के बीच सर्जिकल गोंद और प्रवाहकीय पेस्ट के साथ लगाया जाता है। ये इलेक्ट्रोड एक मानव-संगत, निरंतर-वर्तमान उत्तेजना उपकरण से जुड़े होते हैं, जो उत्तेजना की आवृत्ति, आयाम और अवधि को निर्दिष्ट कर सकते हैं। इंट्राक्रैनील विद्युत क्षेत्रों के मूल्यांकन के लिए, द्विपक्षीय ग्लास इलेक्ट्रोड (~ 2 एम) को सेरेब्रल कॉर्टेक्स (यानी, छोटे छेद के माध्यम से खोपड़ी के आंतरिक पहलू के 1 मिमी के भीतर) में रखा जाता है, और इन्हें खनिज तेल से सील किया जाता है और गर्दन की मांसपेशियों में एजीसीएल ग्राउंड होते हैं (चमड़े के नीचे गर्दन के ऊतकों में दफन केंद्र में बड़े तारों के रूप में दिखाया जाता है)। ये ग्लास इलेक्ट्रोड एक डीसी एम्पलीफायर से जुड़े होते हैं, और उनके आउटपुट कम से कम चार चैनलों के साथ डिजिटाइज़र के माध्यम से दर्ज किए जाते हैं। रिकॉर्डिंग के लिए खोपड़ी पर द्विपक्षीय लेजर डॉपलर प्रोब भी रखे गए हैं। आंतरिक ऑप्टिकल सिग्नल का पता लगाने के लिए पूरी खोपड़ी को लेजर स्पॉट इमेजिंग डिवाइस या उच्च-रिज़ॉल्यूशन (कम से कम 1,024 x 1,024 पिक्सेल, 12-14 बिट पिक्सेल गहराई) ठंडा कैमरे के साथ भी चित्रित किया गया है। हीमोग्लोबिन आइसोबेस्टिक आवृत्ति आमतौर पर रक्त प्रवाह इमेजिंग के लिए रोशनी के लिए (यानी, 562 एनएम) चुना जाता है। (बी) एक वास्तविक प्रयोग की एक क्लोज-अप छवि, जिसमें द्विपक्षीय लेजर डॉपलर प्रोब्स (बाईं ओर), (द्विपक्षीय) इंट्राक्रैनील ग्लास रिकॉर्डिंग माइक्रोइलेक्ट्रोड्स को होल के माध्यम से रखा गया है, और टीएसीएस उत्तेजक इलेक्ट्रोड के साथ पार्श्व रूप से दिखाया गया है। संक्षिप्त नाम: टीएसीएस = ट्रांसक्रैनियल अल्टरनेटिंग करंट उत्तेजना। कृपया इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहाँ क्लिक करें.
तंत्र का आकलन करने के एक तरीके के रूप में, हम अन्य शारीरिक प्रक्रियाओं के साथ बातचीत से भी पूछताछ कर सकते हैं जो सीबीएफ को भी बदलते हैं, जैसे कि के + प्रेरित प्रसार विध्रुवण11। इसके अलावा, नियमित समय पर निर्धारित सत्रों के बजाय, विभिन्न प्रकार की बीमारियों के लिए अतिरिक्त बायोमाकर्स के आधार पर एक बंद-लूप प्रणाली विकसित करना भी संभव है, जैसा कि मिर्गी के उपचार12 (यानी, नैदानिक न्यूरोपेस उपकरणों) के लिए प्रस्तावित किया गया है। उदाहरण के लिए, पार्किंसंस रोग के लिए बंद-लूप मस्तिष्क उत्तेजना आमतौर पर पर्याप्त डोपामाइन (आमतौर पर β-बैंड एलएफपी) की अनुपस्थिति में इस बीमारी के लिए आंतरिक आंतरिक, असामान्य स्थानीय क्षेत्र क्षमता (एलएफपी) पर आधारित होती है।
Protocol
Representative Results
Discussion
यह प्रोटोकॉल टीईएस14 के लिए मस्तिष्क की प्रतिक्रिया का अनुमान लगाने के लिए बायोमार्कर के रूप में सीबीएफ प्रतिक्रिया के इनविवो, एनेस्थेटाइज्ड माप पर केंद्रित है। टीईएस प्रतिक्रिया के दीर?…
Declarações
The authors have nothing to disclose.
Acknowledgements
इस अध्ययन को निम्नलिखित अनुदानों (डीएटी को) द्वारा समर्थित किया गया था: एनआईए आरओ 1 AG074999, एनआईए R21AG051103, वीए I21RX002223, और वीए आई 21 BX003023।
Materials
| Alcohol pads | HenryShein | 112-6131 | |
| Baby mineral oil | Johnson & Johnson | ||
| BD 1 mL syringe | Becton Dikinson | REF 305699 | |
| C3 Flat Surface Electrodes | Neuronexus | ||
| C57BI mice | from NIH colonies | ||
| Copper skull electrods | In house preparation | ||
| Digidata 1440, Clampex | Axon Instruments | ||
| Dumont #5 forceps | FST | #5 | |
| Dumont #7 forceps curved | Dumont | RS-5047 | |
| Eye ointment | Major | LubiFresh P.M. NDC-0904-6488-38 | |
| Flaming/Brown micropipette puller | Sutter instrument Co. | Model P-87 | |
| Forceps 11.5 cm slight curve serrated | Roboz | RS-8254 | |
| Intramedic needle 23 G | Becton Dikinson | REF 427565 | |
| KCl 1 M | In house preparation | ||
| Laser Doppler Probes | Moor Instruments | 0.46 mm laser doppler probes | |
| Laser Speckle Imaging Device | RWD | RFLSI-ZW | |
| Micro curette 13 cm | FST | 10080-05 | |
| Micro Dissecting Scissors, 11.5 cm | Roboz | RS-5914 | |
| Mouse anesthesia fixation | Stoelting | ||
| Neuroconn-DS | Neurocare | DC-Stimulator Plus | |
| PhysioSuite Monitoring | Kent Scientific | ||
| Q-tips | Fisherbrand | 22363167 | |
| Saline 0.9% NaCl solution | Baxter | 281322 | |
| Sensicam QE | PCO Instruments | ||
| Software | Axon Instruments Clampex | ||
| Surgical glue | Covetrus | 31477 | |
| Surgical tape | 3M Transpore | T9784 |
Referências
- Bestmann, S., Walsh, V. Transcranial electrical stimulation. Current Biology. 27 (23), R1258-R1262 (2017).
- Bikson, M., et al. Rigor and reproducibility in research with transcranial electrical stimulation: An NIMH-sponsored workshop. Brain Stimulation. 11 (3), 465-480 (2018).
- Turner, D. A., Degan, S., Galeffi, F., Schmidt, S., Peterchev, A. V. Rapid, dose-dependent enhancement of cerebral blood flow by transcranial AC stimulation in mouse. Brain Stimulation. 14 (1), 80-87 (2020).
- Shah, S., Chhatbar, P. Y., Feld, J. A., Feng, W. Integrating tDCS into routine inpatient rehabilitation practice to boost post-stroke recovery. Brain Stimulation. 13 (4), 953-954 (2020).
- Voroslakos, M., et al. Direct effects of transcranial electric stimulation on brain circuits in rats and humans. Nature Communications. 9 (1), 483 (2018).
- Alekseichuk, I., Mantell, K., Shirinpour, S., Opitz, A. Comparative modeling of transcranial magnetic and electric stimulation in mouse, monkey, and human. Neuroimage. 194, 136-148 (2019).
- Tavakoli, A. V., Yun, K. Transcranial alternating current stimulation (tACS) mechanisms and protocols. Frontiers in Cellular Neuroscience. 11, 214 (2017).
- Yavari, F., Jamil, A., Mosayebi Samani, M., Vidor, L. P., Nitsche, M. A. Basic and functional effects of transcranial electrical stimulation (tES)-An introduction. Neuroscience and Biobehavioral Reviews. 85, 81-92 (2018).
- Wachter, D., et al. Transcranial direct current stimulation induces polarity-specific changes of cortical blood perfusion in the rat. Experimental Neurology. 227 (2), 322-327 (2011).
- Han, C. H., et al. Hemodynamic responses in rat brain during transcranial direct current stimulation: A functional near-infrared spectroscopy study. Biomedical Optics Express. 5 (6), 1812-1821 (2014).
- Ayata, C., Lauritzen, M. Spreading depression, spreading depolarizations, and the cerebral vasculature. Physiological Reviews. 95 (3), 953-993 (2015).
- Berenyi, A., Belluscio, M., Mao, D., Buzsaki, G. Closed-loop control of epilepsy by transcranial electrical stimulation. Science. 337 (6095), 735-737 (2012).
- Hoang, K. B., Cassar, I. R., Grill, W. M., Turner, D. A. Biomarkers and stimulation algorithms for adaptive brain stimulation. Frontiers in Neuroscience. 11, 564 (2017).
- Turner, D., A, D. S., Hoffmann, U., Galleffi, F., Colton, C. A. CVN-AD Alzheimer’s mice show premature reduction in neurovascular coupling in response to spreading depression and anoxia compared to aged controls. Alzheimer’s and Dementia. 17 (7), 1109-1120 (2021).
- Colton, C. A., et al. mNos2 deletion and human NOS2 replacement in Alzheimer disease models. Journal of Neuropathology and Experimental Neurology. 73 (8), 752-769 (2014).
- Castano-Prat, P., et al. Altered slow (<1 Hz) and fast (beta and gamma) neocortical oscillations in the 3xTg-AD mouse model of Alzheimer’s disease under anesthesia. Neurobiology of Aging. 79, 142-151 (2019).
- Etter, G., et al. Optogenetic gamma stimulation rescues memory impairments in an Alzheimer’s disease mouse model. Nature Communications. 10 (1), 5322 (2019).
- Iaccarino, H. F., et al. Gamma frequency entrainment attenuates amyloid load and modifies microglia. Nature. 540 (7632), 230-235 (2016).
- Martorell, A. J., et al. Multi-sensory gamma stimulation ameliorates Alzheimer’s-associated pathology and improves cognition. Cell. 177 (2), 256-271 (2019).
- Dawson, J., et al. Vagus nerve stimulation paired with rehabilitation for upper limb motor function after ischaemic stroke (VNS-REHAB): A randomised, blinded, pivotal, device trial. Lancet. 397 (10284), 1545-1553 (2021).
- Hacker, M. L., et al. Deep brain stimulation in early-stage Parkinson disease: Five-year outcomes. Neurology. 95 (4), e393-e401 (2020).
- Duun-Henriksen, J., et al. A new era in electroencephalographic monitoring? Subscalp devices for ultra-long-term recordings. Epilepsia. 61 (9), 1805-1817 (2020).
- Haneef, Z., et al. Sub-scalp electroencephalography: A next-generation technique to study human neurophysiology. Clinical Neurophysiology. 141, 77-87 (2022).

