Биоанализ гидратации пыльцы in vivo с высоким разрешением для гидратации пыльцы Arabidopsis thaliana
Summary
Улучшенный метод измерения профилей гидратации пыльцы у Arabidopsis thaliana описан здесь. Новый метод предлагает более высокое разрешение, является неинвазивным и легко воспроизводимым. Протокол представляет собой новый инструмент для более тонкого вскрытия процессов, регулирующих ранние стадии опыления.
Abstract
Половое размножение у цветковых растений требует начального взаимодействия между пыльцевым зерном и стигматической поверхностью, где между взаимодействующими партнерами устанавливается молекулярный диалог. Исследования на различных видах показали, что ряд молекулярных контрольных точек регулируют взаимодействие пыльцы и стигмы, чтобы гарантировать, что только совместимая, как правило, внутривидовая пыльца успешно осуществляет оплодотворение. У видов, обладающих «сухим рыльцем», таких как модельное растение Arabidopsis thaliana, первой контрольной точкой после опыления презиготической совместимости является установление гидратации пыльцы.
Эта фаза опыления жестко регулируется, в результате чего сигналы от пыльцевого зерна вызывают высвобождение воды из рыльца, тем самым обеспечивая гидратацию пыльцы. Способность точно измерять и отслеживать гидратацию пыльцы с течением времени является ключом к разработке экспериментов, направленных на понимание регуляции этого важного этапа размножения. В опубликованных протоколах часто используются цветы, которые были вырезаны из материнского растения, содержались на жидких или твердых средах и опылялись в больших количествах.
В этой статье описывается неинвазивный биоанализ опыления in vivo , который позволяет поминутно отслеживать гидратацию отдельных пыльцевых зерен A. thaliana с высоким разрешением. Анализ обладает высокой воспроизводимостью, способен обнаруживать очень тонкие вариации профилей гидратации пыльцы и, таким образом, подходит для анализа мутантов, влияющих на пути, регулирующие опыление. Хотя протокол длиннее, чем те, которые описаны для объемного опыления, точность и воспроизводимость, которые он обеспечивает, наряду с его природой in vivo , делают его идеальным для детального вскрытия фенотипов опыления.
Introduction
Успешное половое размножение у покрытосеменных обычно зависит от переноса внутривидовых пыльцевых зерен от пыльника к рыльцу, либо внутри, либо между особями (т.е. опыление). Этот перенос пыльцевых зерен на восприимчивый цветок обычно опосредован опылителями или абиотическими факторами; Таким образом, это также часто приводит к отложению гетероспецифической пыльцы в естественных условиях. За некоторыми исключениями, прогрессирование опыления гетероспецифической пыльцой является эволюционно невыгодным, снижая репродуктивную пригодность из-за утраченных возможностей спаривания, при этом большинство полученного гибридного потомства либо не развиваются должным образом, либо являются стерильными1. Таким образом, развились механизмы, блокирующие опыление «несовместимой» гетероспецифической пыльцой2. Таким образом, быстрое распознавание совместимой пыльцы является, пожалуй, наиболее важным процессом на ранних стадиях полового размножения у многих цветковых растений.
В семействе Brassicaceae, где рыльца относятся к «сухому» типу, ряд молекулярных контрольных точек действует на нескольких стадиях репродуктивного процесса, регулируя опыление, так что только совместимая пыльца является успешной. Гидратация пыльцы является одной из наиболее важных контрольных точек (рис. 1), поскольку пыльца, которая не гидратируется, не может прогрессировать, образуя пыльцевую трубку и впоследствии доставляя сперму женскому гаметофите. Часто несовместимые зерна не проходят этот первый контрольный пункт опыления и, таким образом, не получают доступа к стигматической воде3. Среди представителей семейства Brassicaceae распознавание пыльцы происходит быстро, при этом совместимость устанавливается в течение нескольких минут после прикрепления пыльцевого зерна к пестику 4,5. В последние годы был достигнут большой прогресс, и теперь мы начинаем понимать молекулярные механизмы, которые регулируют ключевые контрольные точки опыления.
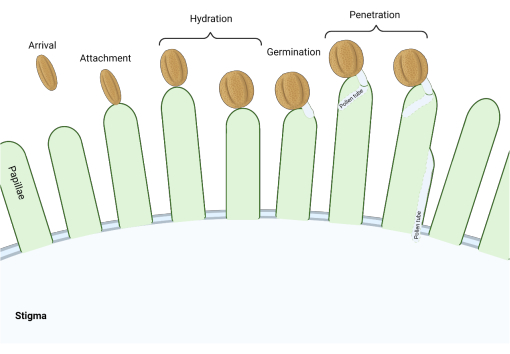
Рисунок 1: Обзор ключевых событий во время совместимого опыления. Эти стадии, такие как гидратация пыльцы и прорастание пыльцевых трубок, также являются «контрольными точками» опыления, которые необходимо успешно преодолеть, чтобы обеспечить совместимое опыление. На диаграмме представлено рыльце «сухого» типа, характерное для видов семейства Brassicaceae 2,20. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Новаторские исследования системы самонесовместимости (SI) Brassica, в которой «самостоятельная» пыльца распознается и отклоняется, установили парадигму распознавания пыльцы-стигмы у Brassicaceae 6,7,8,9,10. СИ у Brassica и его родственников опосредован белками «распознавания», которые находятся на поверхности пыльцы и на стигматической плазматической мембране, которые при взаимодействии приводят к отторжению пыльцы. Отторжение пыльцы СИ происходит за счет нарушения системы совместимости базальной пыльцы и стигмы, которая при полной активации восприятием совместимой пыльцы приводит к целенаправленной секреции стигмой, тем самым стимулируя гидратацию пыльцы (обзоры механизма совместимости пыльцы см.11,12). В примере SI переносимый пыльцой лиганд представляет собой небольшой богатый цистеином белок, богатый S-локусом цистеином (SCR/SP11), а стигматический рецептор представляет собой киназу S-локуса рецептора (SRK).
Недавно было обнаружено, что у Arabidopsis thaliana другая группа небольших белков, богатых цистеином, переносимых пыльцой, белков пыльцевой оболочки класса B (AtPCP-Bs), является важным регулятором принятия пыльцы посредством активации гидратации пыльцы13. Также недавно были описаны стигматические рецепторы AtPCP-B и аспекты нисходящего регуляторного пути14,15. Интересно, что мутационные исследования генов, кодирующих потенциальные пыльцевые и стигматические сигнальные медиаторы гидратации пыльцы (включая AtPCP-Bs), не смогли создать растения, которые полностью блокируют контрольную точку гидратации пыльцы. Это убедительно свидетельствует о том, что множество других, еще не открытых, факторов играют роль в регуляции гидратации пыльцы. Основываясь на методе, впервые описанном Wang et al.13, здесь мы описываем улучшенный биоанализ in vivo с высоким разрешением, подходящий для идентификации тонких дефектов гидратации пыльцы в линиях мутантов-кандидатов A. thaliana.
Protocol
Representative Results
Discussion
Для цветковых растений самые ранние стадии полового размножения, пожалуй, самые важные. На уровне пыльцево-стигматического взаимодействия принимаются молекулярные решения, определяющие «совместимость» взаимодействующих партнеров. Такие решения, если они приняты правильно, позволяют избежать потерь ресурсов, которые могут повлиять на репродуктивную пригодность21. Таким образом, разрешение только совместимой пыльцы для оплодотворения является одним из важных компонентов поддержания хорошо адаптированных генотипов и, следовательно, эволюционного успеха видов. Исследования, проведенные с модельным растением A. thaliana, были чрезвычайно ценными для углубления нашего понимания этого процесса. Ряд исследований, проведенных за последние несколько десятилетий, выявил наличие факторов в пыльцевой оболочке, которые действуют на первой «контрольной точке» совместимости, где пыльца получает доступ к стигматической воде, чтобы обеспечить гидратацию пыльцы13. Несмотря на это первое понимание механизмов, регулирующих совместимость пыльцы и стигмы, все еще существует много пробелов в нашем понимании этого процесса. На сегодняшний день никакие мутанты переносимых пыльцой лигандов или стигматических рецепторов, которые, как известно, влияют на гидратацию пыльцы, не могут полностью блокировать совместимое опыление, что свидетельствует о наличии других неоткрытых детерминант гидратации пыльцы. Имея возможность легко наблюдать интересующий фенотип, биоанализ гидратации пыльцы, описанный здесь, является одним из самых простых методов изучения потенциальных мутантов, которые регулируют опыление.
Существующие методики измерения гидратации пыльцы обычно используют массовое опыление и сообщают о меньшем количестве временных точек 14,22,23 и, таким образом, могут упускать важные фенотипы тонкого профиля гидратации. Например, исследование Wang et al.13, наряду с работой над другими мутантами белка пыльцевой оболочки в нашей лаборатории (неопубликованные наблюдения), выявило интригующие различия в профилях гидратации между мутантами. Такие тонкие различия могут содержать важные ключи к регуляторным механизмам, лежащим в основе совместимого опыления.
Описанный здесь метод фокусируется на получении относительно небольшого количества измерений между мутантными и WT линиями растений с акцентом на методологическую точность для уменьшения вариаций в наборах данных. Несмотря на то, что этот метод обладает высокой воспроизводимостью (как показано на рисунке 7), при условии, что температура и влажность адекватно контролируются, важно собрать данные о гидратации для почти равного количества WT и мутантной пыльцы в один и тот же день, чтобы еще больше снизить вероятность вариаций. При необходимости данные могут быть объединены в разные дни. Кроме того, выбор подходящих контрольных установок WT имеет жизненно важное значение для правильной интерпретации результатов гидратации. Для реципиента пыльцы следует использовать одну и ту же линию растений для получения как контрольных WT, так и мутантных пыльцевых зерен.
Например, мы используем линию стерильных растений мужского пола pA9-барназы, которая также фигурирует в видеопротоколе, в качестве реципиента пыльцы как для WT (контрольной), так и для мутантной (экспериментальной) пыльцы при исследовании мутантных линий пыльцы Т-ДНК (таких как мутант «KD», описанный на рисунке 8). Следует избегать смешивания данных из такой мужской стерильной линии, которые не должны быть выхолощены, с данными, собранными из выхолощенной вручную контрольной линии, поскольку эти стигмы, вероятно, будут вести себя по-разному. Аналогичным образом, выхолощенные мутантные линии следует использовать в сочетании с выхолощенной WT (контрольной) линией, когда это возможно. Такую же осторожность следует проявлять и при рассмотрении генетического фона исследуемых растений. В то время как большинство популярных коллекций мутантов Т-ДНК были созданы на фоне Col-0, другие, такие как коллекция FLAG от Национального института агрономических исследований (INRA), доступны в генетическом фоне Вассилевской (WS)24,25. В таких случаях целесообразно использовать линии растений WT соответствующего экотипа в качестве контроля.
Хотя здесь мы сосредоточились на гидратации пыльцы в течение первых 10 минут взаимодействия пыльцы и стигмы, этот метод также может быть адаптирован для охвата профилей гидратации, которые охватывают более длительный период времени. Ключевая особенность протокола заключается в том, что цветы остаются прикрепленными к родительскому растению – опубликованные протоколы обычно требуют вырезания пестика и помещения в среду для поддержания ткани на время эксперимента14,18,26. Хотя нет прямых доказательств того, что такой полу-природный подход влияет на гидратацию пыльцы или действительно изменяет регуляцию этого процесса in vivo, вполне возможно, что удаление цветов из родительского растения может повлиять на опыление. Таким образом, этот протокол обеспечивает истинную среду in vivo для изучения взаимодействия пыльцы и стигмы, где сохраняется структурная целостность растения.
Перенос одиночных пыльцевых зерен на «девственные» стигматические сосочки, возможно, является одной из самых сложных операций, описанных в этом протоколе. Нередки случаи ошибочного переноса гроздей пыльцевых зерен. Однако вероятность того, что это произойдет, можно значительно уменьшить, убедившись, что на щипцах присутствует только монослой пыльцы (рис. 3А) (или даже только одно пыльцевое зерно; Рисунок 5) и/или путем использования пыльцевых зерен, которые уже ориентированы таким образом, что они «выступают» из других на кончиках щипцов. Мы обнаружили, что опытный оператор может успешно завершить перенос одной пыльцы в клетку стигматического сосочка примерно за 3 минуты и записать данные до пяти пыльцевых зерен в течение 1 часа. Таким образом, в течение 2-4 дней может быть накоплено достаточно данных для содержательного статистического анализа исследуемых линий растений.
Человеческая ошибка потенциально является самым большим источником различий в анализе наборов данных, полученных в результате исследований с использованием этого протокола. Например, определение «границы пыльцы» при анализе изображений сводится к суждению отдельного исследователя. Таким образом, существует вероятность того, что измерения, сделанные разными исследователями, даже на одном и том же наборе данных, могут привести к изменениям. Там, где это возможно, один исследователь должен проводить измерения, чтобы свести к минимуму ошибки выборки. Кроме того, объединение анализа WT и мутантных наборов данных одним и тем же оператором сводит на нет потенциально субъективное определение «границы пыльцы» и межоператорной вариации.
В заключение описан сложный, но точный метод измерения профилей гидратации пыльцы в модельном организме A. thaliana. Мы продемонстрировали, что, используя этот протокол, можно легко получить высокосогласованные данные о гидратации пыльцы A. thaliana. Три независимые партии данных об опылении WT, полученные в разные дни, показали последовательные небольшие отклонения в размере <3% во все моменты времени (рис. 7 и дополнительная таблица S1). Хотя биоанализ, представленный здесь, немного сложнее, чем большинство существующих протоколов, разрешение полученных данных превосходит и подходит для идентификации и характеристики новых мутантов, которые влияют на пути, регулирующие совместимое опыление.
Declarações
The authors have nothing to disclose.
Acknowledgements
Это исследование было поддержано стипендиями аспирантуры Университета Бата (University of Bath, Bath, UK, BA2 7AY) для аспирантов Y.-L.L. и L.W. Рисунок 1 был создан с помощью BioRender.com (https://biorender.com/).
Materials
| A9-barnase line | University of Bath | Courtsey of Prof. Rod Scott | Male sterile Arabidopsis thaliana wildtype equivalent line of the ecotype Columbia-0 |
| Dumont Tweezer, Dumont #5 Inox 11cm | Fisher | Dumont 500342 | Tweezer uses for transfer of pollen grain |
| GraphPad Prsim (version 8.0.2) | Dotmatics | Prism | Comprehensive data analysis, graphing and statistics software |
| JMP (version 17) | JMP Statistical Discovery LLC | JMP 17 | Statistical analysis software |
| Levington F2S seed & modular compost (with sand) | Levington | LEV75F2SMS | General-purpose compost for plant growth |
| Micromanipulator | Singer instrument Co. LTD. | Singer Micromanipulator | Micromanipulator to aid transfer of pollen grain |
| Nikon Digit sight DS-U1 | Nikon | DS-U1 | Microscope camera (coupletd to SMZ1500) |
| Nikon Eclipse TE2000-S Inverted Microscope | Nikon | TE2000-S | Inverted microscope |
| Nikon SMZ1500 Stereomicroscope | Nikon | SMZ1500 | Stereomicroscope |
| Nikon DS-Fi3 microscope camera | Nikon | DS-Fi3 | Microscope camera (coupletd to TE2000-S) |
| Nikon NIS-Elements Basic Research | Nikon | NIS-Elements BR | Image accquisition and analysis software (for DS-Fi3) |
| Nikon NIS-Elements F | Nikon | NIS-Elements F | Image accquisition and analysis software (for DS-U1) |
| WT Col-0 plant line | NASC | N700000 | Wildtype Arabidopsis thaliana, ecotype Columbia-0 |
Referências
- Rieseberg, L. H., Willis, J. H. Plant speciation. Science. 317 (5840), 910-914 (2007).
- Hiscock, S. J., Allen, A. M. Diverse cell signalling pathways regulate pollen-stigma interactions: the search for consensus. New Phytologist. 179 (2), 286-317 (2008).
- Kandasamy, M. K., Nasrallah, J. B., Nasrallah, M. E. Pollen pistil interactions and developmental regulation of pollen-tube growth in Arabidopsis. Development. 120 (12), 3405-3418 (1994).
- Bosch, M., Wang, L. Pollen-stigma interactions in Brassicaceae: complex communication events regulating pollen hydration. Journal of Experimental Botany. 71 (9), 2465-2468 (2020).
- Rozier, F., et al. Live-cell imaging of early events following pollen perception in self-incompatible Arabidopsis thaliana. Journal of Experimental Botany. 71 (9), 2513-2526 (2020).
- Dickinson, H. Dry stigmas, water and self-incompatibility in Brassica. Sexual Plant Reproduction. 8, 1-10 (1995).
- Takasaki, T., et al. The S receptor kinase determines self-incompatibility in Brassica stigma. Nature. 403 (6772), 913-916 (2000).
- Schopfer, C. R., Nasrallah, M. E., Nasrallah, J. B. The male determinant of self-incompatibility in Brassica. Science. 286 (5445), 1697-1700 (1999).
- Takayama, S., et al. Direct ligand-receptor complex interaction controls Brassica self-incompatibility. Nature. 413 (6855), 534-538 (2001).
- Shiba, H., et al. A pollen coat protein, SP11/SCR, determines the pollen S-specificity in the self-incompatibility of Brassica species. Plant Physiology. 125 (4), 2095-2103 (2001).
- Broz, A. K., Bedinger, P. A. Pollen-pistil interactions as reproductive barriers. Annual Review of Plant Biology. 72 (1), 615-639 (2021).
- Cheung, A. Y., Duan, Q., Li, C., James Liu, M. -. C., Wu, H. -. M. Pollen-pistil interactions: It takes two to tangle but a molecular cast of many to deliver. Current Opinion in Plant Biology. 69, 102279 (2022).
- Wang, L. D., et al. PCP-B class pollen coat proteins are key regulators of the hydration checkpoint in Arabidopsis thaliana pollen-stigma interactions. New Phytologist. 213 (2), 764-777 (2017).
- Liu, C., et al. Pollen PCP-B peptides unlock a stigma peptide-receptor kinase gating mechanism for pollination. Science. 372 (6538), 171-175 (2021).
- Bordeleau, S. J., Sanchez, L. E. C., Goring, D. R. Finding new Arabidopsis receptor kinases that regulate compatible pollen-pistil interactions. Frontiers in Plant Science. 13, 1022684 (2022).
- Suwabe, K., et al. Double-locking mechanism of self-compatibility in Arabidopsis thaliana: the synergistic effect of transcriptional depression and disruption of coding region in the male specificity gene. Frontiers in Plant Science. 11, 576140 (2020).
- Smyth, D. R., Bowman, J. L., Meyerowitz, E. M. Early flower development in Arabidopsis. Plant Cell. 2 (8), 755-767 (1990).
- Lee, H. K., Macgregor, S., Goring, D. R. A toolkit for teasing apart the early stages of pollen-stigma interactions in Arabidopsis thaliana. Pollen and Pollen Tube Biology. 2160, 13-28 (2020).
- Dilkes, B. P., et al. The maternally expressed WRKY transcription factor TTG2 controls lethality in interploidy crosses of Arabidopsis. PLoS Biology. 6 (12), 2707-2720 (2008).
- Riglet, L., et al. KATANIN-dependent mechanical properties of the stigmatic cell wall mediate the pollen tube path in Arabidopsis. eLife. 9, e57282 (2020).
- Zhou, L. Z., Dresselhaus, T. Friend or foe: Signaling mechanisms during double fertilization in flowering seed plants. Plant Development and Evolution. 131, 453-496 (2019).
- Gao, X. -. Q., et al. The Arabidopsis KINβγ subunit of the SnRK1 complex regulates pollen hydration on the stigma by mediating the level of reactive oxygen species in pollen. PLoS Genetics. 12 (7), e1006228 (2016).
- Lee, H. K., Goring, D. R. Two subgroups of receptor-like kinases promote early compatible pollen responses in the Arabidopsis thaliana pistil. Journal of Experimental Botany. 72 (4), 1198-1211 (2021).
- O’Malley, R. C., Barragan, C. C., Ecker, J. R. A user’s guide to the Arabidopsis T-DNA insertion mutant collections. Pollen and Pollen Tube Biology. 1284, 323-342 (2015).
- Samson, F., et al. FLAGdb++: a database for the functional analysis of the Arabidopsis genome. Nucleic Acids Research. 32, D347-D350 (2004).
- Doucet, J., et al. Investigations into a putative role for the novel BRASSIKIN pseudokinases in compatible pollen-stigma interactions in Arabidopsis thaliana. BMC Plant Biology. 19 (1), 549 (2019).

