在自动化细胞处理器上制造嵌合抗原受体T细胞
Summary
本文详细介绍了临床使用的嵌合抗原受体T细胞的制造过程,特别是使用能够进行病毒转导和T细胞培养的自动化细胞处理器。我们提供建议并描述在早期临床试验的工艺开发和实施过程中应考虑的陷阱。
Abstract
嵌合抗原受体(CAR)-T细胞代表了一种很有前途的免疫治疗方法,用于治疗各种恶性和非恶性疾病。CAR-T细胞是转基因T细胞,其表达嵌合蛋白,该嵌合蛋白可识别并与细胞表面靶标结合,从而杀死靶细胞。传统的CAR-T细胞制造方法劳动密集、成本高昂,并且可能存在污染风险。CliniMACS Prodigy是一种自动化细胞处理器,允许在封闭系统中以临床规模生产细胞治疗产品,从而最大限度地降低污染风险。处理在计算机的控制下半自动进行,从而最大限度地减少了人为参与该过程,从而节省了时间并减少了可变性和错误。
本手稿和视频描述了使用该处理器制造 CAR-T 细胞的 T 细胞转导 (TCT) 过程。TCT 过程涉及 CD4+/CD8+ T 细胞富集、活化、病毒载体转导、扩增和收获。使用活动矩阵(一种允许对这些步骤进行排序和计时的功能),可以广泛地定制 TCT 流程。我们根据现行药品生产质量管理规范 (cGMP) 提供 CAR-T 细胞生产的演练,并讨论支持研究性新药 (IND) 申请所需的放行测试和临床前实验。我们论证了使用半自动工艺进行临床CAR-T细胞生产的可行性,并讨论了其优缺点。最后,我们描述了一项正在进行的针对小儿B细胞恶性肿瘤的研究者发起的临床试验[NCT05480449],作为如何在临床环境中应用这种制造工艺的一个例子。
Introduction
经改造表达嵌合抗原受体 (CAR) 的 T 细胞的过继转移在治疗难治性 B 细胞恶性肿瘤患者方面显示出显着的疗效 1,2,3,4,5。然而,CAR-T细胞的传统制造方法是劳动密集型的,耗时的,并且需要训练有素的技术人员来执行高度专业化的步骤。例如,自体CAR-T细胞产品的传统制造工艺包括密度梯度离心、洗脱或磁分离以富集T细胞,在无菌烧瓶中用病毒载体进行活化和转导,以及在收获和配制之前在生物反应器中扩增。最近出现了各种系统,旨在使这一过程部分自动化。例如,Miltenyi CliniMACS Prodigy(以下简称“处理器”)是一种自动化细胞处理设备,可以以自动化方式执行其中的许多步骤6,7,8,9。对传统和自动化CAR-T制造方法的深入讨论在最近的综述文章10中提出。
该处理器建立在 CliniMACS Plus 的功能之上,CliniMACS Plus 是美国食品和药物管理局 (FDA) 批准的用于处理造血祖细胞的医疗设备。该处理器包括一个细胞培养单元,可自动清洗、分离和培养细胞(图 1)。T 细胞转导 (TCT) 过程是处理器设备中的预设程序,可在很大程度上复制手动 CAR-T 细胞制造。TCT 允许使用图形用户界面(“活动矩阵”, 图 2)进行可定制的单元格处理。由于该处理器可自动执行许多步骤并将多个设备的功能整合到一台机器中,因此需要技术人员的培训和专业故障排除技能较少。由于所有步骤都是在封闭的一次性管道套件中执行的,因此处理器可以在空气处理基础设施不那么严格的设施中运行,这比开放式制造工艺可接受的要低。例如,我们在经过 ISO 8 级认证(与欧盟 C 级相当)的设施中操作处理器。
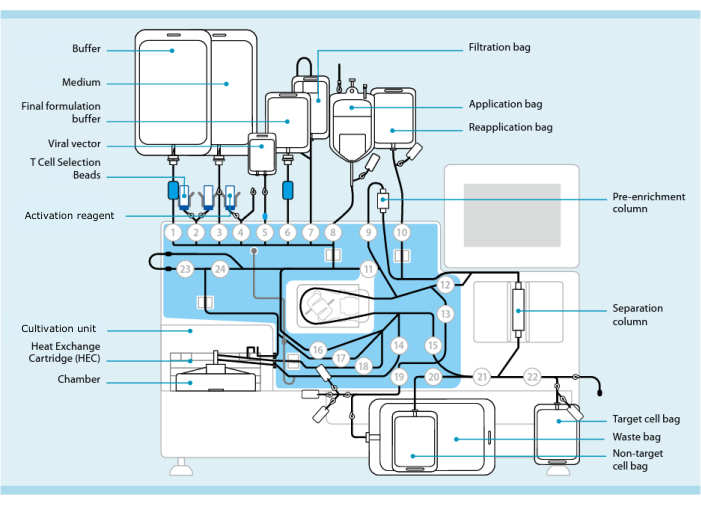
图 1:使用 T 细胞转导系统生产 CAR-T 细胞。 显示的是安装了管路组的处理器。管路套件允许通过无菌焊接连接其他组件,例如装有处理缓冲液、培养基和慢病毒载体的袋子。将白细胞分离术产品添加到应用袋中后,可以用 T 细胞选择微球标记,通过分离柱,然后转移到再应用袋中。然后将选定的细胞引导至仪器的培养单元进行培养,并用活化试剂活化(参见 材料表)。最终产物被收集在目标细胞袋中。在整个过程中,可以无菌地取出样品进行质量控制。圆圈内的灰色数字表示处理器上引导液体路径通过管路组的编号阀门。经 11 许可转载。请点击这里查看此图的较大版本.
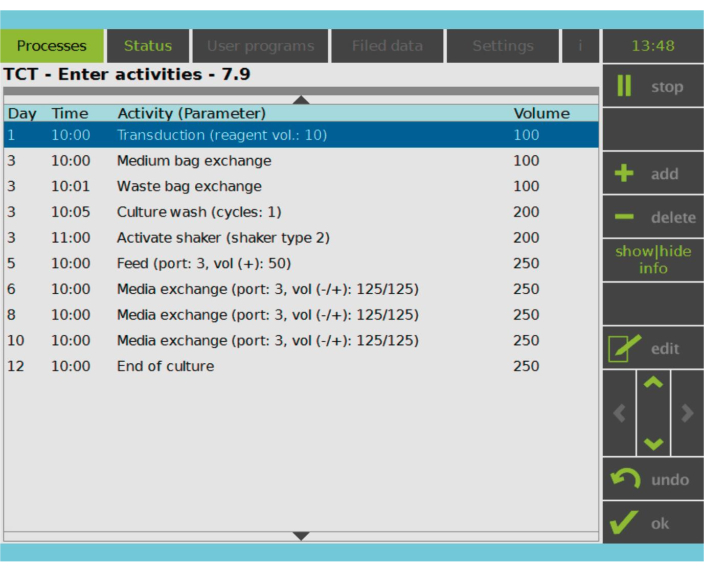
图 2:活动矩阵。 在T细胞选择和激活后,CAR-T细胞制造过程的其余部分是完全可定制的。可以添加或删除活动并安排在适当的日期和时间,并且可以指定活动后的培养体积(Volume)。例如,转导活动配置为在第 1 天上午 10:00 开始,活动结束时的培养体积设置为 100 mL。活性矩阵可以在整个培养期间进行编辑。过程状态可以在处理设备的集成屏幕上进行监控。 请点击这里查看此图的较大版本.
本手稿的目的是提供使用处理器制造 CAR-T 细胞的详细演练,并就监管机构批准研究性新药 (IND) 申请可能需要的过程和产品放行测试提供指导。所提出的方案接近供应商推荐的方法,是IND 28617的基础方案,目前正在单中心研究者发起的I/II期临床试验中进行评估。该试验旨在确定使用该处理器为B细胞急性淋巴细胞白血病(B-ALL)或B系淋巴母细胞淋巴瘤(B-Lly)患者制造人源化CD19定向自体CAR-T细胞的安全性和有效性[NCT05480449]。该试验于 2022 年 9 月开始,计划招募多达 89 名 0-29 岁的 B-ALL 或 B-Lly 患者。我们在手稿中报告了试验的一些制造结果。
我们想指出的是,尽管该手稿是作为协议提出的,并有可遵循的步骤,但它应该被视为其他人开始优化自己的CAR-T细胞制造工艺的起点。所提出的方案的可能变化的不完整列表包括:使用新鲜而不是冷冻保存的T细胞作为起始材料;使用不同的 T 细胞富集方法或完全省略它;使用不同的培养基和细胞因子混合物,例如 IL7/IL15 而不是 IL2;改变人 AB 血清的浓度或完全省略;转导的时间;使用“多命中”转导;不同的搅拌、培养体积和喂养时间表;使用不同的基因转移方法,包括核酸或非慢病毒载体的电穿孔;使用不同的最终配方缓冲液和/或冷冻保护剂;并新鲜输注CAR-T细胞,而不是冷冻保存以备日后输注。这些变化可能对治疗产品的细胞组成和效力产生重大影响。
| 整个过程步骤 | 流程日 | 技术细节 | |||
| 细胞富集 | 第 0 天 | CD4+/CD8+ T细胞的选择 | |||
| 细胞活化 | T细胞培养接种和活化 | ||||
| 细胞转导 | 第1天 | 慢病毒转导(100 mL 培养体积) | |||
| 细胞扩增(随后进行细胞配方) | 第2天 | — | |||
| 第3天 | 培养液洗涤(1个周期);振动器激活;培养体积增加到 200 mL | ||||
| 第4天 | — | ||||
| 第5天 | 补料 (50 mL);培养体积达到 250 mL 的最终体积 | ||||
| 第6天 | 过程中样品;培养基更换 (-125 mL / +125 mL) | ||||
| 第7天 | 培养基置换 (-150 mL / +150 mL) 或收获 | ||||
| 第8天 | 过程中样品;培养基置换 (-150 mL / +150 mL) 或收获 | ||||
| 第9天 | 培养基置换 (-180 mL / +180 mL) 或 Harvest | ||||
| 第10天 | 过程中样品;培养基置换 (-180 mL / +180 mL) 或 Harvest | ||||
| 第11天 | 培养基置换 (-180 mL / +180 mL) 或 Harvest | ||||
| 第12天 | 培养基置换 (-180 mL / +180 mL) 或 Harvest | ||||
| 第13天 | 收获 | ||||
表 1:流程时间表和概述。 下表总结了当前临床试验中采用的TCT工艺步骤[NCT05480449]。该过程从第 0 天通过 CD4+/CD8+ 选择、培养接种和激活来富集 T 细胞开始,然后在第 1 天进行转导。细胞静置48小时,然后进行培养洗涤,将培养体积增加至200mL,并使用振荡机制进行搅拌。在第 6 天,采集第一个过程中样品。一旦有足够的细胞可用于至少三个全剂量的CAR-T细胞(如果患者为<50kg,则为5×106 个CAR-T细胞/kg,否则为2.5×108 个CAR-T细胞)和质量控制测试(~2 × 106 个CAR-T细胞),就收获细胞;或者一旦培养物达到总共 4-5 x 109 个细胞。缩写:TCT=T细胞转导;CAR-T=嵌合抗原受体T细胞;MACS = 磁激活细胞分选。
Protocol
Representative Results
Discussion
CAR-T细胞疗法已成为B细胞和其他恶性肿瘤的一种有前途的治疗方法。然而,传统的CAR-T细胞制造方法存在一些局限性,例如成本高、劳动密集型生产以及增加污染风险的开放步骤。最近,出现了几个半自动化平台,包括Miltenyi CliniMACS Prodigy(“处理器”),以解决这些限制。T细胞转导(TCT)过程集成到本手稿中描述的处理器中,包括封闭系统中的T细胞富集、活化、病毒转导、培养扩增和收获。目?…
Declarações
The authors have nothing to disclose.
Acknowledgements
作者要感谢一些个人和组织对这项工作的贡献。细胞和基因治疗实验室以及宾夕法尼亚大学转化和相关研究实验室在工艺开发和IND提交准备方面提供了宝贵的帮助。Melissa Varghese 和 Amanda DiNofia 为本手稿基础的 IND 提交的工艺开发和准备做出了贡献。这项工作得到了费城儿童医院细胞和基因治疗合作组织的加速资助。作者还要感谢Miltenyi Biotec的技术和研究支持。 图 1 版权归 2023 Miltenyi Biotec B.V. & Co. KG 所有©;保留所有权利。
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
Referências
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

