Tillverkning av chimär antigenreceptor T-cell på en automatiserad cellprocessor
Summary
Den här artikeln beskriver tillverkningsprocessen för chimära antigenreceptor-T-celler för klinisk användning, särskilt med hjälp av en automatiserad cellprocessor som kan utföra viral transduktion och odling av T-celler. Vi ger rekommendationer och beskriver fallgropar som bör beaktas under processutveckling och genomförande av en klinisk studie i tidig fas.
Abstract
Chimära antigenreceptorer (CAR)-T-celler representerar en lovande immunterapeutisk metod för behandling av olika maligna och icke-maligna sjukdomar. CAR-T-celler är genetiskt modifierade T-celler som uttrycker ett chimärt protein som känner igen och binder till ett cellytemål, vilket resulterar i att målcellen dödas. Traditionella tillverkningsmetoder för CAR-T-celler är arbetskrävande, dyra och kan medföra risk för kontaminering. CliniMACS Prodigy, en automatiserad cellprocessor, gör det möjligt att tillverka cellterapiprodukter i klinisk skala i ett slutet system, vilket minimerar risken för kontaminering. Bearbetningen sker halvautomatiskt under kontroll av en dator och minimerar därmed mänsklig inblandning i processen, vilket sparar tid och minskar variabilitet och fel.
Detta manuskript och video beskriver processen för T-cellstransduktion (TCT) för tillverkning av CAR-T-celler med hjälp av denna processor. TCT-processen involverar CD4+/CD8+ T-cellsberikning, aktivering, transduktion med en viral vektor, expansion och skörd. Med hjälp av aktivitetsmatrisen, en funktion som gör det möjligt att ordna och tajma dessa steg, kan TCT-processen anpassas i stor utsträckning. Vi ger en genomgång av CAR-T-celltillverkning i enlighet med nuvarande Good Manufacturing Practice (cGMP) och diskuterar nödvändiga frisättningstester och prekliniska experiment som kommer att stödja en Investigational New Drug (IND)-ansökan. Vi demonstrerar genomförbarheten och diskuterar för- och nackdelar med att använda en halvautomatisk process för klinisk CAR-T-celltillverkning. Slutligen beskriver vi en pågående prövarinitierad klinisk studie som riktar sig mot pediatriska B-cellsmaligniteter [NCT05480449] som ett exempel på hur denna tillverkningsprocess kan tillämpas i en klinisk miljö.
Introduction
Adoptiv överföring av T-celler konstruerade för att uttrycka en chimär antigenreceptor (CAR) har visat anmärkningsvärd effekt vid behandling av patienter med refraktära B-cellsmaligniteter 1,2,3,4,5. De traditionella tillverkningsmetoderna för CAR-T-celler är dock arbetsintensiva, tidskrävande och kräver högutbildade tekniker för att utföra högspecialiserade steg. Till exempel involverar den traditionella tillverkningsprocessen för en autolog CAR-T-cellprodukt densitetsgradientcentrifugering, eluering eller magnetisk separation för att anrika T-celler, aktivering och transduktion med en viral vektor i en steril kolv och expansion i en bioreaktor före skörd och formulering. Olika system har nyligen dykt upp som syftar till att delvis automatisera denna process. Till exempel är Miltenyi CliniMACS Prodigy (hädanefter kallad “processorn”) en automatiserad cellbearbetningsenhet som kan utföra många av dessa steg på ett automatiserat sätt 6,7,8,9. En djupgående diskussion om traditionella och automatiserade CAR-T-tillverkningsmetoder presenteras i en nyligen publicerad översiktsartikel10.
Processorn bygger på funktionaliteten hos CliniMACS Plus, en medicinteknisk produkt som godkänts av U.S. Food and Drug Administration (FDA) för bearbetning av hematopoetiska stamceller. Processorn innehåller en cellodlingsenhet som möjliggör automatiserad tvättning, fraktionering och odling av celler (figur 1). Processen för T-cellstransduktion (TCT) är ett förinställt program i processorenheten som till stor del replikerar manuell tillverkning av CAR-T-celler. TCT möjliggör anpassningsbar cellbearbetning med hjälp av ett grafiskt användargränssnitt (“Aktivitetsmatrisen”, figur 2). Eftersom processorn automatiserar många steg och konsoliderar funktionaliteten hos flera enheter till en maskin, kräver den mindre utbildning och specialiserade felsökningsfärdigheter från tekniker. Eftersom alla steg utförs i en sluten slangsats för engångsbruk kan processorn användas i anläggningar med mindre sträng luftbehandlingsinfrastruktur än vad som skulle anses acceptabelt för en öppen tillverkningsprocess. Till exempel driver vi processorn i en anläggning som är certifierad som ISO-klass 8 (jämförbar med EU-klass C).
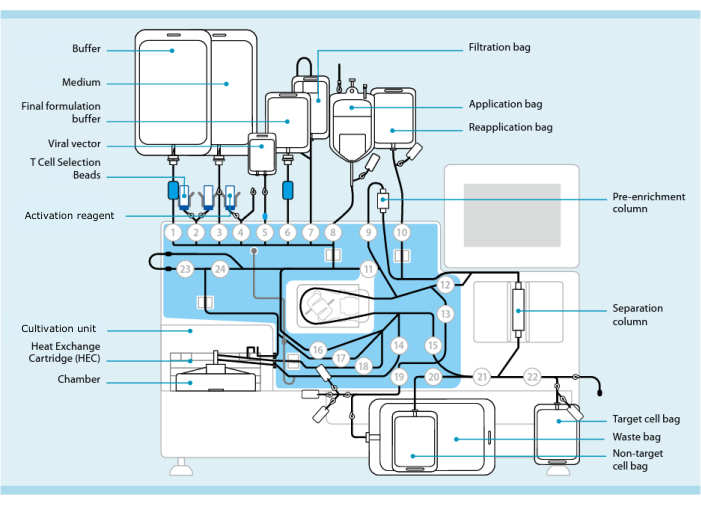
Figur 1: Tillverkning av CAR-T-celler med hjälp av T-cellstransduktionssystemet. Processorn med slangsatsen installerad visas. Slangsatsen gör det möjligt att ansluta andra komponenter, t.ex. påsar som innehåller processbuffert, odlingsmedium och lentiviral vektor, via steril svetsning. När leukaferesprodukten har lagts till i applikationspåsen kan den märkas med T-cellvalspärlor, passera genom separationskolonnen och sedan överföras till återappliceringspåsen. Valda celler dirigeras sedan till odlingsenheten på instrumentet för odling och aktiveras med aktiveringsreagenset (se materialtabell). Slutprodukten samlas i Target-cellpåsen. Under hela processen är det möjligt att ta prover för kvalitetskontroll aseptiskt. Grå siffror inuti cirklarna representerar de numrerade ventilerna på processorn som leder vätskevägen genom slangsatsen. Återges med tillstånd från 11. Klicka här för att se en större version av denna figur.
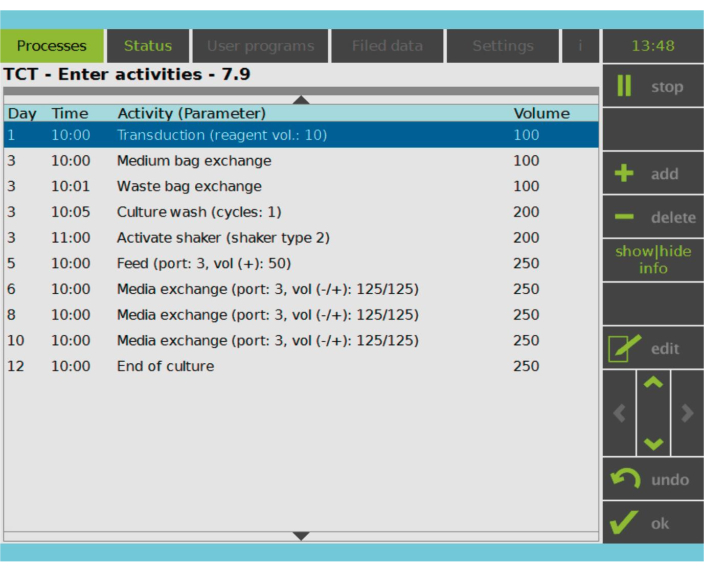
Figur 2: Aktivitetsmatris. Efter val och aktivering av T-celler är resten av tillverkningsprocessen för CAR-T-celler helt anpassningsbar. Aktiviteter kan läggas till eller tas bort och schemaläggas för lämplig dag och tid, och kulturvolymen efter aktiviteten kan anges (volym). Till exempel konfigurerades transduktionsaktiviteten för att börja kl. 10:00 dag 1 och kulturvolymen i slutet av aktiviteten angavs till 100 ml. Aktivitetsmatrisen kan redigeras under hela odlingsperioden. Processens status kan övervakas på den integrerade skärmen på bearbetningsenheten. Klicka här för att se en större version av denna figur.
Syftet med detta manuskript är att ge en detaljerad genomgång av tillverkningen av CAR-T-celler med hjälp av processorn och dessutom ge vägledning om de tester i processen och produktfrisläppning som sannolikt kommer att krävas av tillsynsmyndigheter för att godkänna en IND-ansökan (Investigational New Drug). Det presenterade protokollet ligger nära leverantörens rekommenderade tillvägagångssätt och är det underliggande protokollet för IND 28617, som för närvarande utvärderas i en prövarinitierad fas I/II-studie initierad av ett enda center. Denna studie syftar till att fastställa säkerheten och effekten av att använda denna processor för att tillverka humaniserade CD19-riktade autologa CAR-T-celler för patienter med B-cellsakut lymfatisk leukemi (B-ALL) eller B-linjelymfoblastiskt lymfom (B-Lly) [NCT05480449]. Studien startade i september 2022 och är planerad att inkludera upp till 89 patienter i åldrarna 0-29 år med B-ALL eller B-Lly. Vi redovisar några tillverkningsresultat från försöket i manuskriptet.
Vi vill påpeka att även om manuskriptet presenteras som ett protokoll med steg att följa, bör det ses som en startpunkt för andra att börja optimera sin egen tillverkningsprocess för CAR-T-celler. En icke-uttömmande lista över möjliga variationer av det presenterade protokollet inkluderar: användning av färska istället för kryokonserverade T-celler som utgångsmaterial; Användning av en annan metod för anrikning av T-celler eller utelämnande av den helt och hållet. Användning av olika medier och cytokincocktails såsom IL7/IL15 i stället för IL2. Att variera koncentrationen av AB-serum från människa eller att utesluta det helt och hållet. Tidpunkt för transduktion. med hjälp av “multi-hit”-transduktioner; varierande agitation, odlingsvolymer och utfodringsschema; Användning av olika metoder för genetisk överföring, inklusive elektroporering av nukleinsyror eller icke-lentivirala vektorer. Användning av en annan buffert och/eller kryoprotektivt medel för den slutliga formuleringen. och infundera CAR-T-celler färska istället för kryokonserverande för infusion vid ett senare tillfälle. Dessa variationer kan ha en betydande inverkan på den cellulära sammansättningen och styrkan hos den terapeutiska produkten.
| Övergripande processteg | Process Dag | Teknisk information | |||
| Berikning av celler | Dag 0 | Val av CD4+/CD8+ T-celler | |||
| Aktivering av celler | Sådd och aktivering av T-cellsodling | ||||
| Celltransduktion | Dag 1 | Lentiviral transduktion (100 ml odlingsvolym) | |||
| Cellexpansion (följt av cellformulering) | Dag 2 | — | |||
| Dag 3 | Kulturtvätt (1 cykel); Shaker aktiverad; Odlingsvolymen ökar till 200 ml | ||||
| Dag 4 | — | ||||
| Dag 5 | matning (50 ml); Odlingsvolymen når en slutlig volym på 250 ml | ||||
| Dag 6 | Prov under processen; Medieutbyte (-125 ml/+125 ml) | ||||
| Dag 7 | Mediebyte (-150 ml/+150 ml) eller skörd | ||||
| Dag 8 | Prov under processen; Mediebyte (-150 ml/+150 ml) eller skörd | ||||
| Dag 9 | Medieutbyte (-180 ml/+180 ml) eller skörd | ||||
| Dag 10 | Prov under processen; Medieutbyte (-180 ml/+180 ml) eller skörd | ||||
| Dag 11 | Medieutbyte (-180 ml/+180 ml) eller skörd | ||||
| Dag 12 | Medieutbyte (-180 ml/+180 ml) eller skörd | ||||
| Dag 13 | Skörd | ||||
Tabell 1: Tidslinje och översikt över processen. Denna tabell sammanfattar de TCT-processteg som används i en aktuell klinisk prövning [NCT05480449]. Processen börjar med T-cellsberikning genom CD4+/CD8+-selektion, odlingssådd och aktivering på dag 0, följt av transduktion på dag 1. Cellerna vilar i 48 timmar, följt av en odlingstvätt, en ökning av odlingsvolymen till 200 ml och omrörning med hjälp av en skakmekanism. På dag 6 tas det första provet i processen. Cellerna skördas när det finns tillräckligt med celler tillgängliga för minst tre fulla doser av CAR-T-celler (5 × 10 6 CAR-T-celler/kg om patienten väger <50 kg, annars 2,5 × 108 CAR-T-celler) och kvalitetskontrolltestning (~2 × 106 CAR-T-celler). eller när kulturen når totalt 4-5 x 109 celler. Förkortningar: TCT = T-cellstransduktion; CAR-T = chimära antigenreceptor T-celler; MACS = magnetiskt aktiverad cellsortering.
Protocol
Representative Results
Discussion
CAR-T-cellterapi har visat sig vara en lovande behandlingsmetod för B-celler och andra maligniteter. Traditionella tillverkningsmetoder för CAR-T-celler har dock flera begränsningar, såsom höga kostnader, arbetsintensiv produktion och öppna steg som ökar risken för kontaminering. Nyligen har flera halvautomatiserade plattformar, inklusive Miltenyi CliniMACS Prodigy (“processorn”), dykt upp för att ta itu med dessa begränsningar. T-cellstransduktionsprocessen (TCT), integrerad i processorn som beskrivs i detta m…
Declarações
The authors have nothing to disclose.
Acknowledgements
Författarna vill tacka flera personer och organisationer för deras bidrag till detta arbete. Cell and Gene Therapy Laboratory och Penn Translational and Correlative Studies Laboratory gav värdefull hjälp med processutveckling och förberedelse för IND-ansökningar. Melissa Varghese och Amanda DiNofia bidrog till processutvecklingen och förberedelserna för IND-inlämningar som ligger till grund för detta manuskript. Detta arbete stöddes av ett Acceleration Grant från Cell and Gene Therapy Collaborative vid Children’s Hospital of Philadelphia. Författarna vill också tacka Miltenyi Biotec för deras tekniska stöd och forskningsstöd. Figur 1 omfattas av copyright © 2023 Miltenyi Biotec B.V. & Co. KG; Alla rättigheter förbehållna.
Materials
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
Referências
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).

