RGBradford: Количественное определение белка с помощью камеры смартфона
Summary
В данной статье представлен протокол количественного определения белка с использованием анализа Брэдфорда и смартфона в качестве аналитического устройства. Уровни белка в образцах могут быть количественно определены с помощью цветовых данных, извлеченных из изображения микропланшета, сделанного с помощью смартфона.
Abstract
Количественное определение белка является важной процедурой в медико-биологических исследованиях. Среди нескольких других методов анализ Брэдфорда является одним из наиболее часто используемых. Из-за его широкого распространения, ограничения и преимущества анализа Брэдфорда были исчерпывающе описаны, включая несколько модификаций оригинального метода для улучшения его характеристик. Одной из переделок оригинального метода является использование камеры смартфона в качестве аналитического инструмента. Используя преимущества трех форм красителя Coomassie Brilliant Blue, которые существуют в условиях анализа Брэдфорда, в этой статье описывается, как точно количественно определить белок в образцах, используя данные о цвете, извлеченные из одного изображения микропланшета. После проведения анализа на микропланшете с помощью камеры смартфона делается снимок, а цветовые данные RGB извлекаются из изображения с помощью бесплатного программного обеспечения для анализа изображений с открытым исходным кодом. Затем отношение интенсивности синего и зеленого (по шкале RGB) образцов с неизвестными концентрациями белка используется для расчета содержания белка на основе стандартной кривой. Существенной разницы между значениями, рассчитанными с использованием цветовых данных RGB, и значениями, рассчитанными с использованием обычных данных поглощения, не наблюдается.
Introduction
Независимо от последующего использования (например, ИФА, кинетика ферментов, вестерн-блоттинг, очистка белков и масс-спектрометрия), количественное определение белка имеет решающее значение для точного анализа в лабораториях медико-биологических наук. В дополнение к их использованию в качестве вторичных индикаторов (т.е. для вычисления относительных уровней аналитов на массу белка), уровни белка в образце также могут быть желаемым результатом. Например, можно интересоваться уровнем белка в пищевых ресурсах1 или в моче2. Существует множество методов измерения концентрации белка в образцах3, в том числе прямые показания поглощения УФ-излучения4, хелатирование белка и меди 5,6, колориметрические анализысвязывания белка с красителем 7 и флуоресцентные анализы8, связывающие белки с красителями. Об актуальности количественного определения белка свидетельствует наличие в топ-3 наиболее цитируемой литературыдвух работ, описывающих методы измерения белка 5,7 9,10. Несмотря на то, что многие авторы пренебрегают фактическим цитированием, ссылаясь на непервичные ссылки или вообще ничего не цитируя, оригинальные статьи, описывающие белковый анализ Лоури и белковый анализ Брэдфорда, насчитывают >200 000 цитированийкаждая.
Популярность теста Брэдфорда обусловлена его доступностью, простотой, скоростью и чувствительностью. Анализ основан на взаимодействии между белками и красителем Coomassie Brilliant Blue G в кислых условиях. В условиях анализа (т.е. при низком рН) краситель существует в трех формах: красная катионная форма с λmax при 470 нм; зеленая нейтральная форма с λmax на длине волны 650 нм; и синяя анионная форма с λmax при 590 нм 11,12 (рис. 1). Катионная форма преобладает при отсутствии белков. По мере того, как белки взаимодействуют с красителем, они стабилизируют синюю анионную форму, вызывая заметное изменение цвета раствора, от коричневатого до синего. Обычно изменение концентрации синей формы красителя количественно оценивают спектрофотометрически, поглощение которой при 590-595 нм пропорционально количеству белка в анализе.
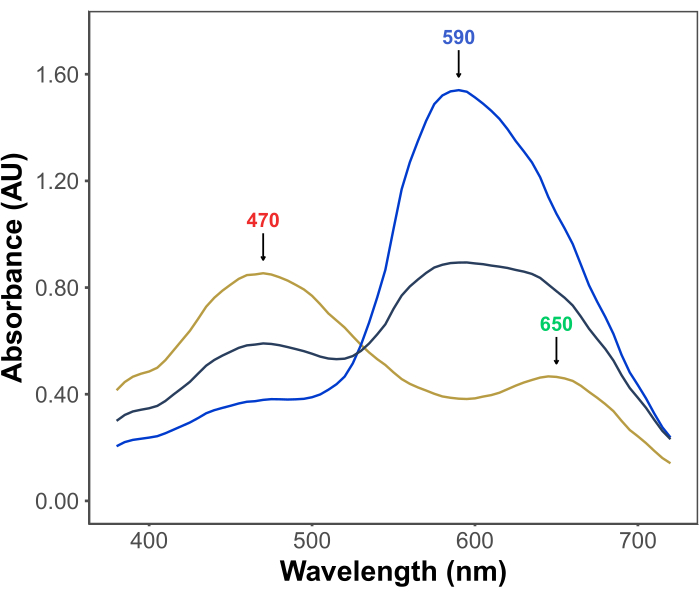
Рисунок 1: Спектры поглощения G бриллиантового синего цвета Кумасси в условиях Брэдфордского анализа. Три основных пика отмечены стрелками, указывающими λmax красной (470 нм), зеленой (650 нм) и синей (590 нм) форм красителя. Спектры регистрировали в отсутствие белка (желтая линия) и в присутствии 3 мкг (серая линия) и 10 мкг (синяя линия) бычьего сывороточного альбумина. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Широкое использование анализа Брэдфорда привело к выявлению ряда ограничений (например, вариабельная реакция на различные белки11 и интерференция липидов13 и детергентов7) и разработке модификаций для улучшения его характеристик (например, добавление детергентов14,15, подщелачивание14,16 и использование коэффициента абсорбции17). В дополнение к модификациям в самом анализе, также было описано использование альтернативных устройств, таких как смартфоны или камеры, для захвата аналитических сигналов 18,19,20. Действительно, разработка методов, использующих смартфоны в качестве портативных химических анализаторов, была активной областью исследований. Мотивация использования смартфонов проистекает из доступности, портативности, простоты использования и широкой доступности этих устройств.
В данной работе представлен протокол количественного определения белка с использованием теста RGBradford20, в котором в качестве аналитического устройства используется смартфон. В отличие от оригинальной публикации RGBradford20, здесь была введена процедура, которая упрощает процесс извлечения цвета. Он включает в себя использование свободно доступного программного приложения для автоматического извлечения информации о цвете из каждой лунки изображения на микропластине, что значительно экономит время и усилия. Это альтернатива предыдущему методу ручного получения цветовых данных из каждой скважины по отдельности с помощью графического редактора20. В конечном счете, уровни белка в образцах могут быть количественно определены с помощью цветовых данных, извлеченных из изображения микропланшета, сделанного с помощью смартфона.
Protocol
Representative Results
Discussion
В этой статье описывается RGBradford, метод, который использует камеру смартфона для записи данных анализа белка в Брэдфорде, извлечения цветовых данных и точного количественного определения уровня белка в биологических образцах, как первоначально было описанонедавно. Одно и?…
Declarações
The authors have nothing to disclose.
Acknowledgements
Эта работа финансировалась Национальным советом по научно-техническому развитию (CNPq, Бразилия) [номера грантов 428048/2018-8 и 402556/2022-4] и Университетом Бразилиа (Бразилия). Автор благодарит д-ра Дуарте Нуно Карвалью и д-ра Эвелин Сантуш (i3s, Порту, Португалия) за предоставление доступа к их смартфонам, использованным в этом исследовании.
Materials
| 96-well flat-bottom polystyrene microtiter plates | Jet Biofil, Guangzhou, China | TCP011096 | Any flat-bottom microplate compativle with optical reading will suffice. |
| Bovine serum albumin | Sigma-Aldrich, St. Louis, MO | A2153 | |
| Coomassie Brilliant Blue G | Sigma-Aldrich, St. Louis, MO | B0770 | |
| Ethyl alcohol | |||
| iPhone 11 | Apple | MWM02BR/A | Can be substituted with other smartphone equiped with a camera |
| iPhone 14 Pro | Apple | N/A | |
| Phosphoric acid | Sigma-Aldrich, St. Louis, MO | 695017 | |
| Redmi Note 9 Pro | XIAOMI | N/A | |
| S22 Ultra | Samsung | N/A | |
| SpectraMax 384 Plus. Microplate reader. | Molecular Devices, San Jose, CA | PLUS 384 | Any microplate reader capable of reading at 450 nm and 590 nm will work. This is optional. The method was actually created to dismiss the need of a microplate reader. |
Referências
- Zaguri, M., Kandel, S., Rinehart, S. A., Torsekar, V. R., Hawlena, D. Protein quantification in ecological studies: A literature review and empirical comparisons of standard methodologies. Methods in Ecology and Evolution. 12 (7), 1240-1251 (2021).
- Koga, T., et al. Mild electrical stimulation and heat shock ameliorates progressive proteinuria and renal inflammation in mouse model of Alport syndrome. PLoS One. 7 (8), e43852 (2012).
- Peterson, G. L. Determination of total protein. Methods in Enzymology. 91, 95-119 (1983).
- Goldfarb, A. R., Saidel, L. J., Mosovich, E. The ultraviolet absorption spectra of proteins. The Journal of Biological Chemistry. 193 (1), 397-404 (1951).
- Lowry, O. H., Rosebrough, N. J., Farr, A. L., Randall, R. J. Protein measurement with the Folin phenol reagent. The Journal of Biological Chemistry. 193 (1), 265-275 (1951).
- Smith, P. K., et al. Measurement of protein using bicinchoninic acid. Analytical Biochemistry. 150 (1), 76-85 (1985).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Datki, Z., et al. Application of BisANS fluorescent dye for developing a novel protein assay. PLoS One. 14 (4), e0215863 (2019).
- Van Noorden, R., Maher, B., Nuzzo, R. The top 100 papers. Nature. 514 (7524), 550-553 (2014).
- . Scopus Available from: https://www.scopus.com/ (2022)
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Analytical Biochemistry. 151 (2), 369-374 (1985).
- Chial, H. J., Thompson, H. B., Splittgerber, A. G. A spectral study of the charge forms of Coomassie Blue G. Analytical Biochemistry. 209 (2), 258-266 (1993).
- Pande, S. V., Murthy, M. S. R. A modified micro-Bradford procedure for elimination of interference from sodium dodecyl sulfate, other detergents, and lipids. Analytical Biochemistry. 220 (2), 424-426 (1994).
- Gogstad, G. O., Krutnes, M. -. B. Measurement of protein in cell suspensions using the Commassie brilliant blue dye-binding assay. Analytical Biochemistry. 126 (2), 355-359 (1982).
- Friedenauer, S., Berlet, H. H. Sensitivity and variability of the Bradford protein assay in the presence of detergents. Analytical Biochemistry. 178 (2), 263-268 (1989).
- Stoscheck, C. M. Increased uniformity in the response of the Coomassie blue G protein assay to different proteins. Analytical Biochemistry. 184 (1), 111-116 (1990).
- Zor, T., Selinger, Z. Linearization of the Bradford protein assay increases its sensitivity: Theoretical and experimental studies. Analytical Biochemistry. 236 (2), 302-308 (1996).
- Gee, C. T., Kehoe, E., Pomerantz, W. C. K., Penn, R. L. Quantifying protein concentrations using smartphone colorimetry: A new method for an established test. Journal of Chemical Education. 94 (7), 941-945 (2017).
- de Camargo, C., Vicentini, M., Gobbi, A., Martinez, D., Lima, R. Smartphone for point-of-care quantification of protein by Bradford assay. Journal of the Brazilian Chemical Society. 28 (4), 689-693 (2016).
- Moreira, D. C. RGBradford: Accurate measurement of protein concentration using a smartphone camera and the blue to green intensity ratio. Analytical Biochemistry. 655, 114839 (2022).
- Ernst, O., Zor, T. Linearization of the Bradford Protein Assay. Journal of Visualized Experiments. (38), 1918 (2010).
- Angelani, C. R., et al. A metabolic control analysis approach to introduce the study of systems in biochemistry: the glycolytic pathway in the red blood cell: Metabolic control analysis and the glycolytic pathway. Biochemistry and Molecular Biology Education. 46 (5), 502-515 (2018).

