通过将微流体与质量光度法相结合来分析微摩尔浓度下的蛋白质复合物形成
Summary
该协议将质量光度法与新型微流体系统相结合,以研究低亲和力蛋白质 – 蛋白质相互作用。该方法基于溶液中高浓度复合物的快速稀释,从而实现低亲和力测量并扩大了质量光度法的适用性。
Abstract
质量光度法是一种多功能的质量测量技术,可用于研究生物分子相互作用和溶液中的复合物形成,无需标记。质谱光度法通常适用于分析浓度范围为 100 pM-100 nM 的样品。然而,在许多生物系统中,有必要测量更浓缩的样品来研究低亲和力或瞬时相互作用。在这里,我们展示了一种方法,该方法有效地将可以通过质量光度法分析的样品浓度范围从纳摩尔扩大到数十微摩尔。
在该协议中,质量光度法与新型微流体系统相结合,以研究在微摩尔浓度范围内溶液中蛋白质复合物的形成。使用微流体系统,用户可以将样品保持在所需的更高浓度,然后稀释到纳摩尔范围 – 在质量光度测量前几毫秒。由于稀释的速度很快,数据是在样品的平衡发生变化(即复合物解离)之前获得的。
该技术用于测量免疫球蛋白 G (IgG) 抗体与新生儿 Fc 受体之间的相互作用,显示高阶复合物的形成,这些复合物无法通过静态质量光度测量来量化。
总之,质量光度法和微流体技术的结合使得表征微摩尔浓度范围内的样品成为可能,并且擅长测量亲和力较弱的生物分子相互作用。这些能力可以应用于一系列环境 – 包括生物治疗药物的开发和设计 – 能够对各种蛋白质-蛋白质相互作用进行彻底表征。
Introduction
蛋白质-蛋白质相互作用强调了大多数细胞功能,从免疫调节到 DNA 复制和翻译。因此,整个生命科学都迫切需要研究通常形成的各种异质复合物之间的广泛相互作用。然而,它们的检测、表征和定量通常具有挑战性,特别是对于低亲和力相互作用1。
免疫沉淀测定通常用于检测高亲和力相互作用,但对于低亲和力和瞬时相互作用,检测在很大程度上是不可行的2.也可以使用荧光技术,但需要添加可能具有破坏性的荧光标记2。冷冻电镜可以提供结构快照和以高空间分辨率形成的蛋白质复合物的集成读数,但通常还需要在太低的浓度下工作,无法对低亲和力相互作用进行成像。冷冻电镜还带来了与成本、可及性、样品制备和分析时间相关的挑战3.
此外,表面等离子体共振 (SPR) 已成为量化蛋白质-蛋白质相互作用的一种流行方法,尽管它需要蛋白质固定化,这会影响结合平衡并导致可变的导通率,从而降低测量精度 4,5。它还涉及数据收集和分析之前的几个分析步骤6.
质谱光度法是一种单分子技术,已用于分析蛋白质-蛋白质相互作用 5,6,7。它的工作原理是根据单分子或复合物落在玻璃盖玻片表面时散射的光来测量它们的质量8.质谱光度法测量已用于量化结合伴侣的相对丰度和它们形成的复合物的结合亲和力5。然而,与其他单分子技术一样,待测样品的浓度通常应小于 100 nM。如果浓度较高,落在玻璃表面的分子将在空间上重叠,导致数据质量差7.因此,在这些较低浓度下解离的较弱的相互作用(KD ~微摩尔)无法可靠地测量,因为无法观察到未结合和结合物质的必要混合物5。
在这里,我们描述了一种基于新型耦合微流体质量光度测量装置的方法,该方法克服了这一限制。具体来说,将微流体系统与质量光度计结合使用,以有效地扩大可以通过质量光度法量化的相互作用范围。微流体已被证明为研究蛋白质-蛋白质相互作用提供了一系列可能性,包括快速稀释以检测弱相互作用 1,9。本文所述的系统通过在微流控芯片上将样品快速稀释至10,000倍,并立即将其流过芯片的观察区域,从而使质量光度测量能够在分子开始稀释过程10后的50 ms内开始。当样品和缓冲液在芯片上的反向特斯拉阀混合器中混合时,就会发生稀释,两种溶液的相对流速决定了发生的稀释量(参见方案步骤8)。流量可通过微流控软件进行控制。改变流速可以改变物种的相对种群,因为它会影响玻璃表面着陆事件的数量,这是质量光度计测量的次数。
该过程的速度足够快,可以在交互的完整性被破坏之前完成测量(有关详细信息,另请参阅讨论)。这可以通过简要介绍一下一阶反应理论来理解,其中 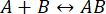 .正向(缔合)速率常数为 kf,反向(解离)速率常数为 kb,平衡解离常数 (KD) 定义为
.正向(缔合)速率常数为 kf,反向(解离)速率常数为 kb,平衡解离常数 (KD) 定义为
KD= kb/ kf
对于蛋白质结合,kf通常受到反应物扩散11 的限制,因此限制在 10 6-107 M-1·s-1 的范围内。因为范围有限,所以低亲和力(KD~微摩尔)反应将有kb≈ 1 s-1。即kb= kf ·KD= (106 M-1·s-1) (10-6 M) = 1 s-1, 配合物的半衰期约为 0.7 s11,12。
我们的示例系统是 IgG 单克隆抗体曲妥珠单抗与 IgG 新生儿 Fc 受体 (FcRn) 的可溶性结构域的结合,它们是已知的相互作用伙伴13。先前发表的单独使用传统质量光度法(即手动稀释样品)获得的数据表明,这些蛋白质形成多个物种。FcRn单体、FcRn二聚体和未结合的IgG清晰可见,而IgG-FcRn复合物(比例为1:1和1:2)也检测到(pH 5.0时),但丰度非常低5。这一观察结果提出了一个问题,即如果在较高浓度下测量,是否可以更清楚地检测到IgG-FcRn复合物的形成。事实上,将质量光度法与本文所述的耦合快速稀释方法相结合,通过增加测量的颗粒,为复合物的形成提供了更有力的证据。
这里描述的质量光度法和微流体协议使得表征具有KD 到微摩尔范围的复合物的形成成为可能。KD 的经验测定将需要进一步提高流量传感器的精度、泵的稳定性、芯片间的变化以及观察窗内的测量位置,因为所有这些因素都会影响从样品稀释到被测量的时间。
如果它们具有不同的分子量(相隔至少 25 kDa),则相同的方法可以应用于研究任何可溶性蛋白质之间的结合,这些分子量属于适合使用质量光度计分析的范围(30 kDa 至 6 MDa)。所获得的见解可能有助于在一系列背景下进行研究 – 从获得对细胞功能的机制理解到新生物治疗药物的设计。
Protocol
Representative Results
Discussion
这里概述的协议提供了一种检测和量化低亲和力蛋白质 – 蛋白质相互作用的方法。它使用与快速稀释微流体系统耦合的质量光度计。质谱光度法是一种无标记的生物分析工具,可以可靠地测量溶液中生物分子16 的分子量,适用于 30 kDa 至 6 MDa 范围内的生物分子。由于质量光度法是一种逐个分析样品的单分子技术,因此通常仅限于 100 pM-100 nM 浓度范围内的样品。超过这个范围,落在玻璃表面的分子会在空间上重叠,导致数据质量差;低于此范围,获得的数据太少,无法进行稳健的分析7.一个重要的结果是,它可以将蛋白质相互作用的研究限制在那些在该范围内形成结合和未结合物种混合物的蛋白质相互作用。
在这里,我们详细介绍了使用快速稀释微流体系统的分步协议,以有效地扩大适用于质量光度法的样品浓度范围。通过在微流控芯片上稀释样品,然后在 50 ms 内将其流过检测器观察窗口,该系统可以在相互作用平衡改变之前捕获未稀释样品中存在的复合物。在单独测量过程中,样品被连续输送到检测器。在这些条件下,当测量样品时,95% 的复合物将保持完整,即使是低亲和力相互作用 – KD 约为微摩尔量级,解离速率快至 1 s-1。
这可以计算如下:对于正向速率 kf和反向速率 kb 的反应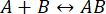 ,
,
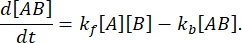
在平衡时,所有三种物质(A、B 和复合物 AB)的浓度保持不变,因此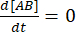 和
和 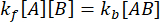 。在保守的假设下,扰动(在这种情况下是稀释)可能导致络合物解离,但正向(缔合)反应不进行,术语k f [A] [B]可以被视为可以忽略不计,并且可以进行以下简化:
。在保守的假设下,扰动(在这种情况下是稀释)可能导致络合物解离,但正向(缔合)反应不进行,术语k f [A] [B]可以被视为可以忽略不计,并且可以进行以下简化:
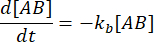
积分给出了平衡扰动后复合物在时间上的浓度的以下表达式:
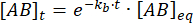
因此,在平衡扰动后在时间 t 保持束缚的复合物部分为:
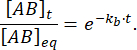
在 = 50 ms 时,对于 kb≈ 1 s-1 的反应,馏分结合为 0.95,即 95%11,12。
本文和之前的5 次使用质谱光度法来研究 IgG 单克隆抗体曲妥珠单抗与 FcRn 可溶性结构域的结合。据报道,这两种结合伙伴在酸性 pH值为 17 时以纳摩尔亲和力结合。质谱光度法用于定性评估结合伙伴在 pH 值为 5.0 时形成的复合物的丰度,并通过额外的微流体系统快速稀释样品。根据先前报告的结果5,该程序针对特定的蛋白质-蛋白质相互作用进行了优化。如果用户具有先验知识或优化了相关系统的实验条件,例如使用哪种缓冲液、初始蛋白质浓度、预期的化学计量以及使相互作用达到平衡所需的孵育量,则相同的程序可用于研究其他相互作用。
当手动稀释 IgG-FcRn 混合物时,即使已知这些蛋白质会相互作用,也很难检测到 IgG-FcRn 复合物的存在5。本文表明,快速稀释方法导致这些复合物的量显着增加。对于同一样品,当使用快速稀释时,均明显观察到 1:1 的 FcRn-IgG 复合物和 2:1 的 FcRn-IgG 复合物。这些复合物形成的差异证明了在广泛的浓度范围内研究生物分子相互作用系统的重要性。
此外,这些结果还表明,使用微流体和单分子分析来捕获弱相互作用是直接的,这填补了该方法的重大空白。由于质量光度法作为一种分析技术的优势,快速稀释微流体与质量光度法的结合具有吸引人的优势。也就是说,质量光度法不需要标记,涉及最少的样品制备,并且测量是在溶液中进行的。对于该协议,质量光度法的另一个关键优势是它能够区分和量化所有形成的物质(前提是它们具有>30 kDa的独特质量)。这与SPR形成鲜明对比,例如,SPR可以测量结合和解除结合的速率,但不能轻易提供化学计量信息8。
对于该协议,以及更一般的大规模光度测量实验,几个考虑因素是有帮助的。首先,最终蛋白质浓度应在质量光度法可以测量的极限(100 pM-100 nM)内。起始孵育浓度也应在微流体系统的范围内(最高 90 μM),并且理论上应高于相互作用10 的实际 KD。推荐的起点是在 μM 浓度下相互作用的物质之间的浓度混合比为 1:1。然后,该比例可以更改为 1:2、1:5,或者,如这种相互作用的情况,为 1:10。如果没有关于蛋白质相互作用的先前信息,用户将不得不优化实验,从每个伙伴的高浓度(推荐20μM)开始,以确定组分的亲和力是否在所提出的方法所维持的浓度范围内(即,形成复合物)。优化还可能涉及选择其他缓冲液条件以促进相互作用或滴定其中一种相互作用组分以确定正确的混合比。一旦确定了这些结果,就可以优化浓度和流速,以便为研究和方法提供最佳条件,例如,降低浓度以获得更好的峰分辨率。
其次,为了成功复制该实验,应尽量减少杂质。已知会对质量光度测量产生不利影响的常见杂质来源包括纯化后残留的其他蛋白质或细胞碎片、未经过滤的缓冲液、胶束形成去污剂(如果浓度过高)以及含有高浓度盐、甘油或其他成分的缓冲液。如上述议定书所述,应去除微流体系统中的气泡。如果样品具有高表面张力并且容易形成泡沫,则可能会在管道系统中形成气泡。浸油中也可能形成气泡,可以从对焦环检测到气泡(图3)。如果无法使用协议中描述的步骤去除气泡,另一种解决方案是使用干燥器和真空泵对样品进行脱气,将样品置于减压状态几分钟。不建议涡旋或摇晃高浓度的蛋白质溶液,因为这些动作可能会促进气泡的形成。
虽然这里展示了一种特定蛋白质-蛋白质相互作用的测量,但相同的协议可以应用于其他蛋白质-蛋白质相互作用系统,而无需进行重大修改。该协议的进一步未来方向将是使用测量值来计算所鉴定的复合物的KD值,正如在质量光度法5,7的其他地方所描述的那样。虽然先前的研究使用了涉及手动稀释和更强相互作用的实验数据,但分析原理可以很容易地应用于这种情况 – 前提是对微流体设备进行进一步改进(例如提高流量传感器精度和泵稳定性)。
除了蛋白质-蛋白质相互作用之外,联合质量光度法和快速稀释微流体方法可能还有更广泛的应用。质量光度法可用于评估样品纯度、聚集和均匀性18,19;研究蛋白质寡聚化20、大分子组装21或聚合化22;以及其他领域。质谱光度分析也超越了蛋白质;它已被用于研究核酸与蛋白质23、病毒颗粒24 和纳米颗粒25 之间的相互作用。因此,该协议描述了组合质量光度法微流体系统的重要应用 – 它能够在单个分子和复合物的水平上直接测量弱蛋白质 – 蛋白质相互作用。本申请的价值很高,因为它为直接表征通常难以研究的相互作用提供了可能性–与关键治疗领域的相关性有关。这种综合方法还可以作为对浓度高达数十微摩尔的样品进行更广泛调查的基础。
Declarações
The authors have nothing to disclose.
Acknowledgements
WS 得到了 UKRI 未来领袖奖学金 [MR/V02213X/1] 的支持。手稿文本和图形是在 Refeyn 科学传播团队成员(Panagiota Paganopoulou、Neus Torres Tamarit 和 Catherine Lichten)的支持下编写的。我们还感谢 Camille Hetez、Sofia Ferreira 和 Matthias Langhorst 的宝贵反馈。
Materials
| 2-Propanol (Isopropanol) | VWR International LLC | 20880.320 | |
| Data acquisition software | Refeyn | AcquireMP (v2022 R1) | |
| Data analysis software | Refeyn | DiscoverMP (v2022 R1) | |
| FCRN, His-Tag | Sigma | SRP0624 | |
| Herceptin (IgG) | Cambridge Bioscience | HY-P9907-1mg | |
| Mass photometer | Refeyn | TwoMP | |
| Microfluidics box | Refeyn | MassFluidix HC system | |
| Microfluidics chip | Refeyn | MassFluidix HC chip | |
| Microfluidics control software | Fluigent | OxyGEN | |
| Phosphate Buffered Saline (PBS), 1x Ultra Pure | VWR International LLC | K812 | |
| Sodium Hydroxide (NaOH) | Sigma | S2770 | |
| β-Amylase, from sweet potato | Sigma | A8781 |
Referências
- Arter, W. E., Levin, A., Krainer, G., Knowles, T. P. J. Microfluidic approaches for the analysis of protein-protein interactions in solution. Biophysical Reviews. 12 (2), 575-585 (2020).
- Hellenkamp, B., Thurn, J., Stadlmeier, M., Hugel, T. Kinetics of transient protein complexes determined via diffusion-independent microfluidic mixing and fluorescence stoichiometry. The Journal of Physical Chemistry. B. 122 (49), 11554-11560 (2018).
- Li, Z. Editorial: Methods in structural biology: Cryo-electron microscopy. Frontiers in Molecular Biosciences. 9, 1041386 (2022).
- Herling, T. W., et al. A microfluidic platform for real-time detection and quantification of protein-ligand interactions. Biophysical Journal. 110 (9), 1957-1966 (2016).
- Soltermann, F., et al. Quantifying protein-protein interactions by molecular counting with mass photometry. Angewandte Chemie International Edition. 59 (27), 10774-10779 (2020).
- Wu, D., Piszczek, G. Rapid determination of antibody-antigen affinity by mass photometry. Journal of Visualized Experiments: JoVE. 168, 61784 (2021).
- Wu, D., Piszczek, G. Measuring the affinity of protein-protein interactions on a single-molecule level by mass photometry. Analytical Biochemistry. 592, 113575 (2020).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Zijlstra, N., et al. Rapid microfluidic dilution for single-molecule spectroscopy of low-affinity biomolecular complexes. Angewandte Chemie International Edition. 56 (25), 7126-7129 (2017).
- MassFluidix® HC system for rapid dilution via microfluidics. Available from: https://www.refeyn.com/massfluidix-hc-system (2023)
- Pollard, T. D. A guide to simple and informative binding assays. Molecular Biology of the Cell. 21 (23), 4061-4067 (2010).
- Jarmoskaite, I., AlSadhan, I., Vaidyanathan, P. P., Herschlag, D. How to measure and evaluate binding affinities. eLife. 9, e57264 (2020).
- Monnet, C., et al. Selection of IgG variants with increased FcRn binding using random and directed mutagenesis: Impact on effector functions. Frontiers in Immunology. 6, 39 (2015).
- . Refeyn TwoMP: Transforming biomolecular characterisation Available from: https://www.refeyn.com/twomp-mass-photometer (2022)
- Lai, S. -. H., Tamara, S., Heck, A. J. R. Single-particle mass analysis of intact ribosomes by mass photometry and Orbitrap-based charge detection mass spectrometry. iScience. 24 (11), 103211 (2021).
- Wu, D., Piszczek, G. Standard protocol for mass photometry experiments. European Biophysics Journal. 50 (3-4), 403-409 (2021).
- Vaughn, D. E., Bjorkman, P. J. Structural basis of pH-dependent antibody binding by the neonatal Fc receptor. Structure. 6 (1), 63-73 (1998).
- Niebling, S., et al. Biophysical screening pipeline for Cryo-EM grid preparation of membrane proteins. Frontiers in Molecular Biosciences. 9, 882288 (2022).
- Paul, S. S., Lyons, A., Kirchner, R., Woodside, M. T. Quantifying oligomer populations in real time during protein aggregation using single-molecule mass photometry. ACS Nano. 16 (10), 16462-16470 (2022).
- Schulz, L., et al. Evolution of increased complexity and specificity at the dawn of form I Rubiscos. Science. 378 (6616), 155-160 (2022).
- Malay, A. D., et al. An ultra-stable gold-coordinated protein cage displaying reversible assembly. Nature. 569 (7756), 438-442 (2019).
- Hundt, N., Cole, D., Hantke, M. F., Miller, J. J., Struwe, W. B., Kukura, P. Direct observation of the molecular mechanism underlying protein polymerization. Science Advances. 8 (35), eabm7935 (2022).
- Acharya, A., et al. Distinct RPA domains promote recruitment and the helicase-nuclease activities of Dna2. Nature Communications. 12, 6521 (2021).
- Ebberink, E. H. T. M., Ruisinger, A., Nuebel, M., Thomann, M., Heck, A. J. R. Assessing production variability in empty and filled adeno-associated viruses by single molecule mass analyses. Molecular Therapy – Methods & Clinical Development. 27, 491-501 (2022).
- Melo, L., et al. Size distributions of gold nanoparticles in solution measured by single-particle mass photometry. The Journal of Physical Chemistry B. 125 (45), 12466-12475 (2021).

