スクリーニング応用のためのヒトiPS細胞由来神経細胞-アストロサイト共培養の3次元バイオプリンティング
Summary
ここでは、iPS細胞由来のニューロンとアストロサイトの3Dバイオプリント共培養を行うためのプロトコルを紹介します。この共培養モデルは、96ウェルまたは384ウェルフォーマットのハイドロゲル足場内で生成され、7日以内に高いポストプリント生存率と神経突起伸長を示し、両方の細胞タイプの成熟マーカーの発現を示します。
Abstract
細胞モデルを薬物スクリーニングに利用するためには、効率的な開発時間を確保しながら、スループットと均質性の要件を満たす必要があります。ただし、公開されている多くの 3D モデルは、これらの基準を満たしていません。そのため、早期創薬用途での有用性は限定的です。3次元(3D)バイオプリンティングは、3Dモデルの開発に適用して、開発期間の短縮、標準化の促進、スループットの向上を実現できる新しい技術です。ここでは、ヒト人工多能性幹細胞(iPS細胞)由来のグルタミン酸作動性ニューロンおよびアストロサイトの3Dバイオプリント共培養モデルを開発するためのプロトコルを紹介します。これらの共培養物は、生理活性ペプチド、完全長細胞外マトリックス(ECM)タンパク質のハイドロゲルマトリックス内に埋め込まれており、生理学的剛性は1.1 kPaです。このモデルは、96ウェルおよび384ウェルフォーマットで迅速に確立でき、平均72%の印刷後生存率を実現します。このモデルにおけるアストロサイトとニューロンの比率は1:1.5であることが示されており、これはヒトの脳の生理学的範囲内である。これらの3Dバイオプリント細胞集団は、成熟した神経細胞タイプマーカーの発現と、培養後7日以内に神経突起および星状細胞突起の成長も示しています。その結果、このモデルは、神経突起伸長アッセイと並行して細胞色素や免疫染色技術を用いた分析に適しています。これらの生理学的に代表的なモデルを大規模に作成できるため、神経科学ターゲットのミディアムスループットからハイスループットのスクリーニングアッセイでの使用に最適です。
Introduction
創薬業界における中枢神経系(CNS)疾患の研究は拡大しています1.しかし、てんかん、統合失調症、アルツハイマー病など、多くの中枢神経系疾患には、いまだに根治的な治療法がありません2,3,4。中枢神経系疾患における効果的な治療法の欠如は、少なくとも部分的には、脳の正確なin vitroモデルの欠如に起因している可能性があります5。その結果、現在のin vitroモデルとin vivoデータの間にトランスレーショナルギャップが生じ、その後の研究活動のボトルネックとなっています。
このトランスレーショナルギャップにより、近年、神経オルガノイド、ニューロスフェロイド、足場ベースのモデルなど、新しい3D細胞モデルの開発が大幅に増加しています6。これらのモデルの3D構造は、生体力学的ストレス、細胞間接触、脳細胞外マトリックス(ECM)などの神経微小環境の再現に役立ちます7。脳ECMは、ニューロン、アストロサイト、オリゴデンドロサイト、および神経血管ユニット7を含む神経細胞タイプ間の空間を占める神経生理学の動的要素である。脳ECMの再現は、ニューロンの形態とニューロンの発火に影響を与えることが示されており、脳の多くの複雑な3Dモデルは、神経細胞タイプによるECMタンパク質の沈着を実証しています8,9,10,11。足場ベースのモデルは、脳ECM12を表す多孔質の合成または生物学的ハイドロゲルマトリックスに懸濁された成熟神経共培養からなる。オルガノイドやスフェロイド系とは異なり、足場ベースの3Dモデルでは、存在するECMタンパク質のカスタマイズが可能であり、生体力学的ストレスを模倣するためのハイドロゲルの剛性の調整可能性という利点もあります13,14。
3Dニューラルモデルの圧倒的多数は、脳微小環境の再現の増加を示していますが、すべてのモデルが創薬アプリケーションの実装に適しているわけではありません15。3Dモデルを産業プロセスに実装するには、システムがスクリーニングアプリケーションのスループット要件を満たし、比較的短い開発時間が必要です16。3Dバイオプリンティングは、人為的ミスによって引き起こされるばらつきを排除するとともに、開発時間の短縮、スループットの向上、より高いレベルの精密制御を備えた3D足場ベースのニューラルモデルを作成する可能性を提供する新しい技術です17。このプロトコルは、ヒドロゲル足場中のヒトiPS細胞由来のグルタミン酸作動性ニューロンとアストロサイトの3D共培養モデルを提示します。このハイドロゲル足場には、生理学的に代表的な生理活性ペプチド(RGD、IKVAV、YIGSR)およびECMタンパク質が模倣生体力学的剛性内に含まれています。これらの完全長ECMタンパク質には、ヒト皮質に豊富に存在する完全長ラミニン-211とヒアルロン酸が含まれ、 in vivo 測定で1.1 kPaの剛性があります18。このモデルは、創薬の実用性を考慮して設計されており、神経突起伸長アッセイと並行して、細胞色素と抗体を用いたイメージング技術を用いたスクリーニング解析に適した96ウェルまたは384ウェルプレートフォーマットの3Dバイオプリンターを使用して作成されます。細胞は、培養後7日以内に神経細胞タイプマーカーの発現と神経突起および星状突起の増殖を示します。したがって、このプロトコルは、創薬アプリケーションで使用するためのハイスループット3D神経共培養モデルを開発するための方法論を提示します。
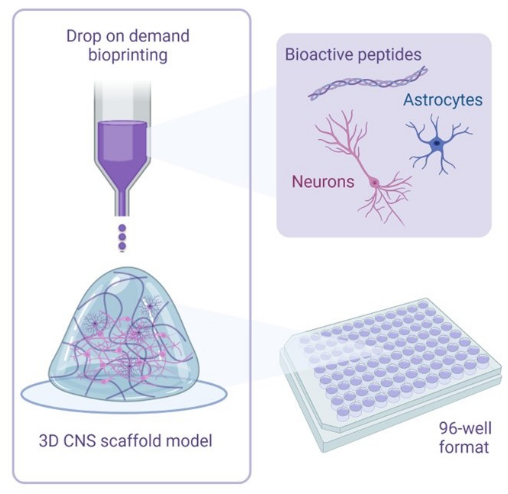
図1:共培養の3Dバイオプリントに使用される方法論の実例的な概要。 ヒトiPS細胞由来のニューロンとアストロサイトは、生理活性ペプチドを含むアクチベーターおよびバイオインク溶液と組み合わされ、ドロップオンデマンドバイオプリンティング技術を使用して、96ウェルまたは384ウェルフォーマットのハイドロゲルスキャフォールドにバイオプリントされます。 この図の拡大版をご覧になるには、ここをクリックしてください。
Protocol
Representative Results
Discussion
中枢神経系の正確なモデルの必要性はかつてないほど高まっており、2次元(2D)の従来の細胞培養モデルの限界により、近年、複雑な中枢神経系モデルが生成されています19。しかし、神経細胞タイプとECMの間の相互作用を表す多くの複雑な3Dモデルには、これらのモデルを工業プロセスに適用できない限界があります6,20,21。このプロトコルでは、ヒトiPS細胞由来のニューロンとアストロサイトの3D共培養モデルを開発し、3Dバイオプリンティング技術を使用してこれらの制限のいくつかを解決し、96ウェルおよび384ウェルフォーマットの生理活性ハイドロゲル足場を作成することを目的としています。
これらのモデルを開発するための方法論は、プレートマップ設計ソフトウェア、自動生成された印刷プロトコル、およびバイオプリンターからのガイド付き印刷プロセスによって簡素化されています。ただし、このプロトコルで使用される感受性iPS細胞由来細胞の種類は繊細であるため、融解と培養において以下の重要なステップに注意する必要があります。第一に、ROCK阻害剤(ROCKi)の含有は、バイオプリンティングプロセス全体および初期培養中にいくつかの利点があります。細胞の融解は、ニューロンがストレス反応を経験する可能性のある臨界点であり、不適切な融解プロトコルは生存の可能性を低下させる可能性があります22。通常、細胞を融解し、培地を添加し、細胞をできるだけ効率的にインキュベーター温度まで上昇させることが推奨されます23。但し、このプロトコルで記述されているbioprintingプロセスの間に、ニューロンおよびastrocytesは媒体よりもむしろ活性剤の解決で再懸濁されることが必要であり、細胞は印刷の操業の終わりまで室温より高く上げられない(解凍後30分まで)。したがって、融解直後にROCKiを培地に添加し、2つの遠心分離ステップ(ステップ2.1–2.7および1.3.15-1.3.20)でこれを含めることは、細胞ストレス経路を阻害するために不可欠であり、その結果、生存率レベルが低下します24。さらに、ROCKiは神経突起伸長を促進し、神経細胞の成熟を改善することが示されている25。したがって、ROCKiの補給はバイオプリンティング後48時間継続されます。ただし、細胞をアッセイに使用する前に、その後の培地交換時に完全にウォッシュオフするために、48時間後にROCKi添加物を除去することが不可欠です。
さらに注意が必要なステップは、印刷後のメディアの追加とメディアの交換(ステップ2.8-2.13)です。バイオプリントされたハイドロゲルの足場は、灰白質と同等のわずか1.1 kPaの同等の生体力学的剛性を持っています。ステップ2.10で説明したように、培地の添加および吸引中は、妨害を防ぐためにウェルの側面にピペットで静かに移すことが重要です。これは、ゲルレベルがウェルの総容量に占める割合が高い 384 ウェルプレートに特に関連しています。この方法は、細胞のエッジリフトや神経突起伸長の剪断を防ぐために、2Dコントロールウェルでも使用する必要があります。また、著者らは、iPS細胞由来の細胞培養に使用されるバイオセーフティキャビネットと同等の注意を払って取り扱う必要があるバイオプリンター内の無菌技術の重要性を強調したいと考えています。これには、グリーンライトと印刷手順で使用される70%EtOHおよびdH2Oの滅菌ろ過、バイオプリンターに手を出し入れしながらカートリッジとプレートの蓋を保管すること、印刷前後に70%エタノールワイプでバイオプリンター内の表面を除染することが含まれます。
このモデルを開発するために選ばれたバイオインクと活性剤溶液から形成されたバイオプリントハイドロゲル足場は、RASTRUMバイオプリンターで使用するためにInventia Life Scienceが開発したさまざまなバイオインクと活性剤溶液から選択されています。ラミニンとヒアルロン酸は、軸索誘導、シナプス形成、および神経周囲網の形成における役割により、iPS細胞由来の神経細胞の成熟に関連する分子として同定されました26,27。さらに、低密度のハイドロゲルがニューロンからのより優れた神経突起伸長を可能にすることが示されているため、1.1 kPaの生体力学的剛性が選択されました12。社内または別の商用サプライヤーから分化したニューロンおよびアストロサイトを使用してプロトコルに変更を加える場合は、最も支持的なハイドロゲル足場を決定するためにマトリックス選択試験を行うことが推奨されるであろう15。さらに、最適な生存率を確保し、ハイドロゲルの過密状態を防ぐために細胞源を変更する場合は、細胞密度を最適化する必要もあります。著者らは、バイオプリンター機能に関連するすべての変更とトラブルシューティングについて、メーカーに連絡し、メーカーのプロトコルを参照することを推奨しています。
中枢神経系には、幅広い神経細胞のサブタイプとグリア細胞が含まれており、それらはすべて異なる脳のニッチに存在し、神経機能に寄与する特定の役割を持っています28。この広い範囲の文脈の中で、このモデルは最も豊富な2つの細胞タイプ(星状細胞と興奮性グルタミン酸作動性ニューロン)のみを表しています。ミクログリア、オリゴデンドロサイト、血液脳関門形成内皮細胞などの重要な細胞型は、このシステムから除外されています。ミクログリアを含めることは、神経免疫相互作用に焦点を当てる上で関連性がある可能性があり、オリゴデンドロサイトは中枢髄鞘形成に影響を与える疾患に関心がある可能性があります。病理学におけるそれらの役割に加えて、血液脳関門形成内皮細胞などの細胞は薬物代謝酵素を排泄し、薬物動態アッセイのためのこのモデルの使用に影響を与える可能性があります29。モデルのさらなる制限は、ニューロンに対するアストロサイトの比率である可能性があります。アストロサイトとニューロンの比率は脳領域によって大きく異なり、推奨値は1:1から1:3の間である30,31。このモデルのアストロサイトとニューロンの比率はおおよそ1:1.5です。したがって、このモデルは、白質野など、アストロサイトがより豊富にある脳領域のモデルには関係がない可能性があります30。
近年、3Dバイオプリント共培養モデルを開発するための他のプロトコルが発表されています。Sullivan et al., 2021の論文では、iPS細胞由来の神経前駆細胞を用いた3Dバイオプリントされた神経モデルが発表され、2D培養と比較して、プリント後の高い生存率と神経機能の増強が実証されています32。但し、このプロトコルでは、神経の前駆細胞は細胞源として使用され、4週間培養で維持された。このプロトコルでは、市販のiPS細胞由来のグルタミン酸作動性ニューロンとアストロサイトを使用しました。これにより、共培養細胞の3Dネットワークをわずか7日で確立できます。神経突起増殖解析によって実証されているように、神経突起伸長は24時間以内に始まり、細胞増殖がモニターされた156時間にわたって直線的に継続します。これらのネットワークの急速な確立は、NGN2の最適化されたドキシサイクリン誘導性遺伝子発現を使用するグルタミン酸作動性ニューロンの使用に部分的に起因しており、2D培養でも7日以内に成熟ニューロンサブタイプマーカーの発現を示す33。アッセイ開発には細胞モデルの迅速なターンアラウンドと開発が必要であるため、この技術を使用してこの成長期間を短縮することは、バイオ医薬品業界内でモデルを実装するために重要です15。
結論として、このモデルは、ニューロンとアストロサイトの3Dモデルの可能性を示しており、スクリーニング目的で迅速かつ便利に確立されます。将来的には、このモデルタイプは、さまざまな中枢神経系疾患の創薬活動に応用される可能性があり、患者や遺伝子編集された疾患のiPS細胞株を使用して、さまざまな疾患に拡大する機会があります。さらに、ドキシサイクリン誘導性NGN2発現iPS細胞由来グルタミン酸作動性ニューロンを用いることで、細胞をより短時間で成熟させることができ、神経変性研究のための老化脳モデルの開発に活用することができます。このシステムは、ミクログリアやオリゴデンドロサイトなど、共培養における追加の細胞タイプの使用によっても拡張できます。
Declarações
The authors have nothing to disclose.
Acknowledgements
著者らは、プロトコルの開発と原稿へのフィードバックに協力してくれたAlex Volkerling、Martin Engel、Rachel Bleachに感謝します。
Materials
| 2-mercaptoethanol | Thermofisher | 31350010 | |
| 384-well plate | PerkinElmer | 6057300 | |
| 96-well plate | PerkinElmer | 6055300 | |
| Activator fluid F299 | Inventia Life Science | N/A | |
| Activator fluid F3 | Inventia Life Science | N/A | |
| B27 (50x) minus Vit A | Thermofisher | 12587010 | |
| Bioink fluid F261 | Inventia Life Science | N/A | |
| Bioink fluid F32 | Inventia Life Science | N/A | |
| Doxycycline hyclate | Sigma Aldrich | D5207 | |
| GlutaMAX (100x) | Thermofisher | 35050061 | |
| Goat anti-mouse IgG H&L Alexa Fluor 647 | Abcam | ab150115 | |
| Goat anti-rabbit IgG H&L Alexa Fluor 488 | Abcam | ab150077 | |
| Hoechst | Abcam | ab228551 | |
| Human BDNF Recombinant Protein | Thermofisher | PHC7074 | |
| Human NT3 Recombinant Protein | Thermofisher | PHC7036 | |
| iCell Astrocytes | Fujifilm CDI | 1434 | |
| INCell Analyser 6500HS | Molecular Devices | N/A | high content imaging system |
| Incucyte S3 | Sartorius | N/A | |
| ioGlutamatergic Neurons (Large vial) | Bit.bio | e001 | |
| Laminin (1 mg/mL) | Sigma Aldrich | L2020 | |
| Live/dead kit (Calcein-AM, Ethidium homo-dimer-1) | Invitrogen | L3224 | |
| Mouse anti-BIII tubulin NL637 conjugated | R&D systems | SC024 | |
| Neurobasal media | Thermofisher | 21103049 | |
| Normal Donkey Serum | Abcam | ab7475 | |
| NucBlue Live (Hoechst 33342) | Thermofisher | R37605 | |
| Opti-MEM | Thermofisher | 11058021 | |
| Paraformaldehyde | Sigma Aldrich | P6148 | |
| PEI 50% in H2O | Sigma Aldrich | 181978 | |
| Pierce Borate Buffer 20x | Thermofisher | 28341 | |
| Prism | GraphPad | Data analysis software | |
| Rabbit anti-ionotropic glutamatre receptor 2 (GluR2) | Abcam | ab206293 | |
| RASTRUM(TM) Bioprinter | Inventia Life Science | N/A | Bioprinter |
| RASTRUM(TM) Bioprinter Cartridges | Inventia Life Science | N/A | Bioprinter Cartridges |
| RASTRUM(TM) Targeting plate | Inventia Life Science | N/A | Targeting plate |
| Rho kinase (ROCK) inhibitor | Abcam | ab120129 | |
| Sheep anti-GFAP NL493 conjugated | R&D systems | SC024 | |
| Signals Image Artist | PerkinElmer | N/A | Image analysis platform |
| Triton X-100 | Thermofisher | HFH10 | |
| Zeiss Axio Observer | Zeiss | N/A | Inverted microscope platform |
Referências
- Jung, Y. L., Hwang, J., Yoo, H. S. Disease burden metrics the innovations of leading pharmaceutical companies: a global and regional comparative study. Globalization and Health. 16 (1), 80-80 (2020).
- Potkin, S. G., et al. The neurobiology of treatment-resistant schizophrenia: paths to antipsychotic resistance and a roadmap for future research. npj Schizophrenia. 6, 1 (2020).
- Zahra, W., et al., Keswani, C., et al. The Global Economic Impact of Neurodegenerative Diseases: Opportunities and Challenges. Bioeconomy for Sustainable Development. , (2019).
- Perucca, E. The pharmacological treatment of epilepsy: recent advances and future perspectives. Acta Epileptologica. 3 (1), 22 (2021).
- Nikolakopoulou, P., et al. Recent progress in translational engineered in vitro models of the central nervous system. Brain. 143 (11), 3181-3213 (2020).
- Whitehouse, C., Corbett, N., Brownlees, J. 3D models of neurodegeneration: implementation in drug discovery. Trends in Pharmacological Sciences. 44 (4), 208-221 (2023).
- Rauti, R., Renous, N., Maoz, B. M. Mimicking the brain extracellular matrix in vitro: A review of current methodologies and challenges. Israel Journal of Chemistry. 60 (12), 1141-1151 (2020).
- Fawcett, J. W., Oohashi, T., Pizzorusso, T. The roles of perineuronal nets and the perinodal extracellular matrix in neuronal function. Nature Reviews Neuroscience. 20 (8), 451-465 (2019).
- Lam, D., et al. Tissue-specific extracellular matrix accelerates the formation of neural networks and communities in a neuron-glia co-culture on a multi-electrode array. Scientific Reports. 9, 4159 (2019).
- Roll, L., Lessmann, K., Brüstle, O., Faissner, A. Cerebral organoids maintain the expression of neural stem cell-associated glycoepitopes and extracellular matrix. Cells. 11 (5), 760 (2022).
- Yan, Y., Bejoy, J., Marzano, M., Li, Y. The use of pluripotent stem cell-derived organoids to study extracellular matrix development during neural degeneration. Cells. 8 (3), 242 (2019).
- Ma, L., et al. 3D bioprinted hyaluronic acid-based cell-laden scaffold for brain microenvironment simulation. Bio-Design and Manufacturing. 3 (3), 164-174 (2020).
- Liaw, C. -. Y., Ji, S., Guvendiren, M. Engineering 3D hydrogels for personalized in vitro human tissue models. Advanced Healthcare Materials. 7 (4), 1701165 (2018).
- Ma, J., Huang, C. Composition and mechanism of three-dimensional hydrogel system in regulating stem cell fate. Tissue Engineering Part B: Reviews. 26 (6), 498-518 (2020).
- Belfiore, L., et al. Generation and analysis of 3D cell culture models for drug discovery. European Journal of Pharmaceutical Sciences. 163, 105876 (2021).
- Langhans, S. A. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Frontiers in Pharmacology. 9, 6 (2018).
- Engel, M., Belfiore, L., Aghaei, B., Sutija, M. Enabling high throughput drug discovery in 3D cell cultures through a novel bioprinting workflow. SLAS Technology. 27 (1), 32-38 (2022).
- Takamura, T., et al. Influence of age on global and regional brain stiffness in young and middle-aged adults. Journal of Magnetic Resonance Imaging. 51 (3), 727-733 (2020).
- Slanzi, A., Iannoto, G., Rossi, B., Zenaro, E., Constantin, G. In vitro models of neurodegenerative diseases. Frontiers in Cell and Developmental Biology. 8, 328 (2020).
- de Souza, N. Organoid variability examined. Nature Methods. 14 (7), 655-655 (2017).
- Hernández, D., et al. Culture variabilities of human iPSC-derived cerebral organoids are a major issue for the modelling of phenotypes observed in Alzheimer’s disease. Stem Cell Review and Reports. 18 (2), 718-731 (2022).
- Li, R., et al. Differentiation of human iPS cells into sensory neurons exhibits developmental stage-specific cryopreservation challenges. Frontiers in Cell and Developmental Biology. 9, 796960 (2021).
- Nishiyama, Y., et al. Safe and efficient method for cryopreservation of human induced pluripotent stem cell-derived neural stem and progenitor cells by a programmed freezer with a magnetic field. Neuroscience Research. 107, 20-29 (2016).
- Uhrig, M., Ezquer, F., Ezquer, M. Improving cell recovery: Freezing and thawing optimization of induced pluripotent stem cells. Cells. 11 (5), 799 (2022).
- Harbom, L. J., et al. The effect of rho kinase inhibition on morphological and electrophysiological maturity in iPSC-derived neurons. Cell and Tissue Research. 375 (3), 641-654 (2019).
- Koh, H. S., Yong, T., Chan, C. K., Ramakrishna, S. Enhancement of neurite outgrowth using nano-structured scaffolds coupled with laminin. Biomaterials. 29 (26), 3574-3582 (2008).
- Tarus, D., et al. Design of hyaluronic acid hydrogels to promote neurite outgrowth in three dimensions. ACS Applied Materials & Interfaces. 8 (38), 25051-25059 (2016).
- Brain Initiative Cell Census Network (BICCN). Initiative Cell Census Network (BICCN). A multimodal cell census and atlas of the mammalian primary motor cortex. Nature. 598 (7879), 86-102 (2021).
- Dauchy, S., et al. Expression and transcriptional regulation of ABC transporters and cytochromes P450 in hCMEC/D3 human cerebral microvascular endothelial cells. Biochemical Pharmacology. 77 (5), 897-909 (2009).
- Herculano-Houzel, S. The glia/neuron ratio: How it varies uniformly across brain structures and species and what that means for brain physiology and evolution. Glia. 62 (9), 1377-1391 (2014).
- von Bartheld, C. S., Bahney, J., Herculano-Houzel, S. The search for true numbers of neurons and glial cells in the human brain: A review of 150 years of cell counting. The Journal of Comparative Neurology. 524 (18), 3865-3895 (2016).
- Sullivan, M. A., et al. 3D bioprinting of stem cell-derived central nervous system cells enables astrocyte growth, vasculogenesis and enhances neural differentiation/function. bioRxiv. , (2022).
- Pawlowski, M., et al. Inducible and deterministic forward programming of human pluripotent stem cells into neurons, skeletal myocytes, and oligodendrocytes. Stem Cell Reports. 8 (4), 803-812 (2017).

