12.8:
Buhar Basıncını Düşürme
12.8:
Buhar Basıncını Düşürme
Bir sıvının denge buhar basıncı, buharlaşma ve yoğunlaşma eşit oranlarda meydana geldiğinde gaz fazı tarafından uygulanan basınçtır:
Uçucu olmayan bir maddenin uçucu sıvı içinde çözülmesi, sıvının buhar basıncının düşmesine neden olur. Bu fenomen, eklenen çözünen moleküllerin sıvının buharlaşma ve yoğunlaşma süreçleri üzerindeki etkisi dikkate alınarak açıklanabilir. Buharlaşma için çözücü molekülleri çözeltinin yüzeyinde mevcut olmalıdır. Çözünen maddenin varlığı, çözücü moleküllerinin kullanabileceği yüzey alanını azaltır ve böylece çözücü buharlaşma oranını düşürür. Yoğuşma hızı, çözünen maddenin varlığından etkilenmediği için net sonuç, buharlaşma-yoğuşma dengesinin buhar fazında daha az çözücü molekülü ile (yani, daha düşük bir buhar basıncında) sağlanmasıdır.
Bu yorum yararlı olsa da, buhar basıncını düşürmenin koligatif doğasının birkaç önemli yönünü hesaba katmaz. Daha ayrıntılı bir açıklama entropinin özelliğini içerir. Bir sıvının buhar basıncının düşürülmesini anlamak için, ayrı ayrı çözücü ve çözünen fazlara kıyasla bir çözelti içindeki maddenin daha dağınık doğasının, çözücü moleküllerini etkili bir şekilde stabilize etmeye ve buharlaşmalarını engellemeye hizmet ettiğini kavramak yeterlidir. Daha düşük bir buhar basıncı ve buna bağlı olarak daha yüksek bir kaynama noktası ortaya çıkar.
Çözelti bileşenlerinin buhar basınçları ile bu bileşenlerin konsantrasyonları arasındaki ilişki Raoult yasası ile açıklanmıştır: İdeal bir çözeltinin herhangi bir bileşeni tarafından uygulanan kısmi basınç, saf bileşenin buhar basıncının çözeltideki mol fraksiyonu ile çarpımına eşittir.
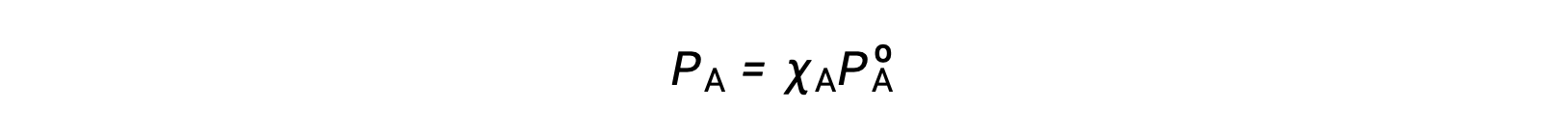
burada PA, çözelti içinde bileşen A tarafından uygulanan kısmi basınçtır, PºA, saf A’nın buhar basıncıdır ve XA, çözeltideki A’nın mol fraksiyonudur.
Gaz halindeki bir karışımın toplam basıncının, tüm bileşenleri için kısmi basınçların toplamına eşit olduğunu hatırlayarak (Dalton’un kısmi basınçlar yasası), i bileşenleri içeren bir çözelti tarafından uygulanan toplam buhar basıncı şöyledir:

Uçucu olmayan bir madde, buhar basıncı ihmal edilebilir olan bir maddedir (Pº ≈ 0) ve bu nedenle, yalnızca uçucu olmayan çözünen maddeler içeren bir çözeltinin üzerindeki buhar basıncı yalnızca çözücüye bağlıdır:
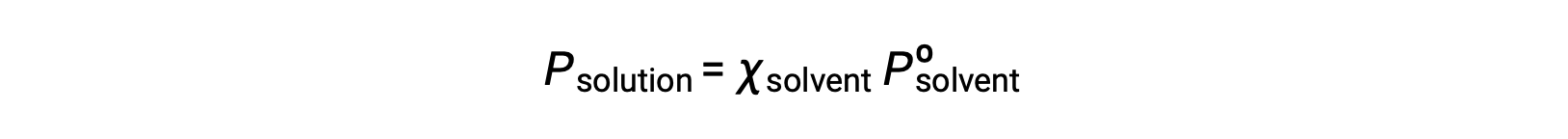
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
Suggested Reading
- Andrews, Frank C. "Colligative properties of simple solutions." Science 194, no. 4265 (1976): 567-571.
- Lindsay Jr, W. T., and Chu Tisin Liu. “Vapor pressure lowering of aqueous solutions at elevated temperatures.” Westinghouse Research Laboratories, Pittsburgh, Pennsylvania, 1968.
- Chinard, Francis P. "Colligative properties." Journal of Chemical Education 32, no. 7 (1955): 377.
