Diffusion Tensor Magnetic Resonance Imaging i Analyse af neurodegenerative sygdomme
Summary
Diffusion tensor imaging (DTI) dybest set fungerer som en MRI-baseret værktøj til at identificere<em> In vivo</em> Mikrostrukturen af hjernen og patologiske processer som følge af neurologiske lidelser i den cerebrale hvide substans. DTI-baserede analyser giver mulighed for ansøgning til hjernesygdomme både på koncern-niveau og i enkeltfag data.
Abstract
Diffusion tensor imaging (DTI) teknikker giver oplysninger om de mikrostrukturelle processer i cerebral hvide substans (WM) in vivo. De nuværende programmer er designet til at undersøge forskelle i WM involvering mønstre i forskellige hjernesygdomme, især neurodegenerative lidelser, ved brug af forskellige DTI analyserne i sammenligning med matchede kontroller.
DTI dataanalyse er udført i et variate mode, dvs voxelwise sammenligning af regionale diffusion retning-baserede parametre såsom fraktioneret anisotropi (FA) sammen med fiber sporing (FT) ledsaget af tractwise brøkdele anisotropi statistik (TFAS) på koncernniveau i orden at identificere forskelle i FA langs WM strukturer, der sigter på definitionen af regionale mønstre WM ændringer på koncernniveau. Forvandling til en stereotaktisk standard rum er en forudsætning for gruppens undersøgelser og kræver grundige databehandling for at bevare directional indbyrdes afhængigheder. De nuværende programmer viser optimerede tekniske tilgange til dette bevarelsen af kvantitative og retningsbestemt oplysninger under rumlig normalisering dataanalyser på gruppe niveau. På dette grundlag kan FT teknikker anvendes til at gruppere gennemsnit data med henblik på at kvantificere målinger oplysninger som defineret af FT. Derudover anvendelse af DTI metoder, dvs forskelle i FA-maps efter stereotaktisk tilpasningen, en langsgående analyse på et individuelt emne basis afsløre oplysninger om progression af neurologiske lidelser. Yderligere kvalitetsforbedring af DTI-baserede resultater kan opnås i forbehandlingsfasen ved anvendelse af en kontrolleret fjernelse af gradient retninger med høje støjniveauer.
Sammenfattende er DTI anvendes til at definere en særskilt WM pathoanatomy forskellige hjernesygdomme ved kombinationen af hele hjerne-baserede og tarmkanalen-baserede DTI analyse.
Introduction
Diffusion tensor imaging i den menneskelige hjerne
Den hvide substans (WM) skrifter i centralnervesystemet består af tætpakkede axoner i tillæg til forskellige typer af neuroglia og andre små populationer af celler. Den aksonal membran samt godt afstemt proteinfibre inden en Axon begrænser diffusionen vinkelret på fiberen orientering, hvilket fører til anisotrope vanddiffusion i hjernen WM 1. Myelinskeder omkring axoner kan også bidrage til anisotropi både intra-og ekstracellulære vand 2.
Den kvantitative beskrivelse af denne anisotropi kunne påvises ved diffusion tensor imaging (DTI). DTI producerer billeder af væv vægtet med de lokale mikrostruktur karakteristika vand diffusion. De image-intensiteter ved hver position er svækket, afhængigt af styrken og retningen af den såkaldte magnetiske diffusion gradient (repræsenteret ib-værdi), samt på den lokale mikrostruktur, hvor vandmolekylerne diffundere 3, diffusionskoefficient D, en skalar værdi:
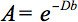
Men i nærværelse af anisotropi i WM, kan diffusion ikke længere være kendetegnet ved en enkelt skalar koefficient, men kræver en tensor  hvilket i første tilnærmelse beskriver molekylær mobilitet langs hver retning og sammenhæng mellem disse retninger 4.. Diffusion anisotropi er primært forårsaget af orienteringen af fiber skrifter i WM og er påvirket af sine mikro-og makrostrukturelle funktioner. Af de mikrostrukturelle træk, synes intraaxonal organisation at være af størst indflydelse på diffusion anisotropi, foruden densiteten af fiberen ennd celle pakning, graden af myelination, og individuel fiber diameter. På en makroskopisk skala, påvirker variation i orienteringen af alle WM skrifter i en billeddannelse voxel dens grad af anisotropi 5..
hvilket i første tilnærmelse beskriver molekylær mobilitet langs hver retning og sammenhæng mellem disse retninger 4.. Diffusion anisotropi er primært forårsaget af orienteringen af fiber skrifter i WM og er påvirket af sine mikro-og makrostrukturelle funktioner. Af de mikrostrukturelle træk, synes intraaxonal organisation at være af størst indflydelse på diffusion anisotropi, foruden densiteten af fiberen ennd celle pakning, graden af myelination, og individuel fiber diameter. På en makroskopisk skala, påvirker variation i orienteringen af alle WM skrifter i en billeddannelse voxel dens grad af anisotropi 5..
I typiske DTI målinger, er de voxel dimensioner i størrelsesordenen millimeter. Således en voxel indeholder altid midlede oplysninger af vandmolekyler inde i detekteret volumen, der normalt omfatter flere axoner samt de omgivende vandmolekyler. Trods denne multiorienteret miljø, er DTI følsom til orienteringen af den største hovedakse som bringer den fremherskende aksonal retning, dvs axonal bidrag dominerer det målte signal 2.
DTI giver to typer oplysninger om ejendommen vand diffusion: først orienteringen-uafhængig omfang diffusion anisotropi 5 og det andet den fremherskende retning vand diffusion i image voxels, dvs diffusion orientering 6..
De nuværende protokoller er meningen at skabe en ramme for DTI analyseteknikker til kvantitativ sammenligning af emnegrupper på koncernniveau, som skitseret i det følgende.
Kvantificering af diffusionsegenskaber – analyseparametre
Elementerne i den symmetriske tensor kan måles ved diffusion gradienter langs mindst seks ikke-kolineære og ikke-koplanare retninger, således at b (ligning 1) er blevet en tensor, hvilket resulterer i signaldæmpning
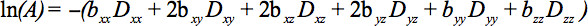
Denne ligning kræver tegner sig for mulige interaktioner mellem billedbehandling og diffusion gradienter, der anvendes i retvinklede retninger (cross vilkår), og selv mellem billeddiagnostiske gradienter, som anvendesi vinkelrette retninger 4.
Den underordnede diffusion tensor  kan altid diagonalized efterlader kun tre ikke-nul elementer langs hoveddiagonalen af tensor, dvs egenværdierne (
kan altid diagonalized efterlader kun tre ikke-nul elementer langs hoveddiagonalen af tensor, dvs egenværdierne ( 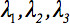 ). Egenværdierne afspejler form eller konfiguration af ellipsoiden. Det matematiske forhold mellem den primære koordinater ellipsoiden og laboratoriet rammen er beskrevet af egenvektorerne
). Egenværdierne afspejler form eller konfiguration af ellipsoiden. Det matematiske forhold mellem den primære koordinater ellipsoiden og laboratoriet rammen er beskrevet af egenvektorerne 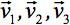
Da der er flere udfordringer i at vise tensor data, er begrebet diffusion ellipsoider blevet foreslået 3.. De Eigendiffusivities af disse ellipsoids repræsenterer endimensional diffusionskoefficienter i hovedretning diffusivities af mediet, dvs hovedakse ellipsoiden repræsenterer den vigtigste diffusion retning i voxel som falder sammen med retningen af fibrene, mens excentricitet ellipsoiden giver oplysninger om grad af anisotropi og dens symmetri. Derfor kunne diffusion anisotropi parametre såsom fraktioneret anisotropi (FA) defineres 7..
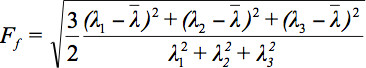
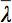 er det aritmetiske gennemsnit af alle Egenværdier.
er det aritmetiske gennemsnit af alle Egenværdier.
En yderligere metode er at bruge den primære retning af diffusion tensor at behandle WM konnektivitet af hjernen, svarende til traktografi Approalm som har til hensigt at undersøge hvilke dele af hjernen er forbundet med hinanden. Antages det, at orienteringen af den vigtigste del af diffusion tensor repræsenterer orienteringen af de dominerende axonal skrifter, er en 3-D vektor felt billede, hvor hver vektor repræsenterer fiberens orientering. I øjeblikket er der flere forskellige tilgange til at rekonstruere WM skrifter, som kan opdeles i to typer: den første kategori er baseret på line formering algoritmer ved hjælp af lokale tensor information for hvert trin i fiber-tarmkanalen formering 2,8,9. Den anden kategori er baseret på global energi minimering at finde den energisk gunstigste sti mellem to WM regioner, hvilket resulterer i tilgangen i tarmkanalen-baserede rumlige statistik (TBSS) 10, som har været anvendt i andre algoritmer, som tractwise brøkdele anisotropi statistik (TFAS – se protokol tekst, afsnit 2.4)..
Omdannelse til stereotaktisk stativard plads
Ligesom i andre avancerede MRI metoder, DTI-og FT-baserede undersøgelser i et klinisk sammenhæng forfølge det ultimative mål at kategorisere enkelte patients hjerne morfologi for at lette den diagnostiske proces baseret på nogle diskrimination metrisk 11. Studier på koncernniveau er mest relevant, hvis det fælles kliniske fænotype formodes at være på grund af skader til et eller flere specifikke områder i hjernen eller et særligt neuroanatomiske netværk. Her gennemsnit af resultaterne for forskellige fag er nyttig for at vurdere fælles mønstre af mikrostrukturelle ændringer. Hver enkelt hjerne har til at blive overført til stereotaktisk plads, så, i et andet trin, det aritmetiske gennemsnit af resultaterne på et voxel-by-voxel niveau er mulig. Rumlig normalisering tilladt for aritmetiske gennemsnit af de opnåede resultater fra forskellige emner for at forbedre signal-til-støj-forhold (SNR), og at udføre en sammenligning af prøver fra patienter og controls for at analysere den beregningsmæssige pathoanatomy af en specifik lidelse, fx en neurodegenerativ sygdom, der er forbundet med påvirkning af en specifik hjerne-system.
Den tidlige tilgang normalisering til en standardiseret stereotaxic plads med 12 foreslog en transformation algoritme til en standard atlas omfatter identificering af forskellige hjerne vartegn og stykkevis skalering af hjernens kvadranter. I dag er de fleste af de avancerede MRI dataanalyse pakker bruger normalisering til Montreal Neurological Institute (MNI) stereotaktisk plads 13.. Til denne transformation blev halvautomatiske og automatiseret hjerne registrering algoritmer ved hjælp af studie specifikke skabeloner udviklet 14,15. I DTI har særlig opmærksomhed henledes på at bevare den retningsbestemte oplysninger under normaliseringsproces 16,17. Anvendelsen af rumlige transformationer til DT-MR-billeder, der er nødvendige for fysisk normaliseringaf samlinger af datasæt er, i modsætning til vridning skalar billeder, kompliceres af, at DTS indeholder orienteringsmæssige oplysninger, som igen er påvirket af transformation. Denne effekt skal der redegøres for, for at sikre den anatomiske korrekthed ændrede billede. Her er teknikker til at anvende affine transformationer til DTI datasæt præsenteres.
Anvendelse af DTI til hjernesygdomme
Sammenligningen af den langsgående DTI oplysninger kræves en tilpasning / registrering af en fagets data mellem hinanden. I denne sammenhæng er bevarelse af den retningsbestemte nødvendige oplysninger (dvs. rotation af diffusion tensor under affine transformationer). Mulige ansøgninger til neurodegenerative sygdomme er blevet rapporteret tidligere (fx 18,19).
DTI er blevet etableret som en robust non-invasiv teknisk redskab til at undersøge in vivo Neuropatholnologi for WM neuronale skrifter (f.eks 11,20,21,22). DTI-baserede kvantitative målinger af diffusionsprocessen, f.eks FA, har allerede vist sig at være følsomme markører for at studere en bred vifte af WM patologier, såsom slagtilfælde 20, multipel sclerose 23, amyotrofisk lateral sklerose 24, 25, Alzheimers sygdom 26 , og flere andre WM lidelser 27,28.
Derudover kan DTI med FT anvendes til at identificere WM skrifter 23.. Denne teknik, mens der stadig ikke er i rutinemæssig klinisk brug, nye er som et kraftfuldt instrument til vurdering af sti-specifikke abnormiteter i neurologisk sygdom. Inden for de identificerede skrifter, afledt forskellige kvantitative MRI indeks fra DTI og yderligere opkøb (f.eks T2-vægtede billeder og / eller magnetisering overførsel (MT) billeddannelse), som er anatomisk coregistered til DTI data kan måles. Herved kan hvert indeks være calculated som en funktion af stilling i tarmkanalen, med henvisning til plots skildrer deres rumlige variation tarmkanalen profiler.
I det følgende, menneskelige DTI scanninger, der blev udført på 1,5 Tesla MR-scannere (Siemens Medical, Erlangen, Tyskland) blev anvendt til at undersøge potentialet af forskellige analyseteknikker til påvisning af hvide substans abnormiteter i patientgrupper samt i individer. Efter en automatiseret kvalitetskontrol for afskaffelse af motion-korrupte mængder og volumener med andre former for artefakter, forberede standardiserede efterbehandling procedurer DTI data for fortløbende analyse. Forskellige analyser tilgange vil blive illustreret i det følgende, dvs først, hele hjernen baseret rumlig statistik (WBSS), andet, FT, og tredje, Tractwise fraktioneret anisotropi statistik (TFAS). WBSS er en metode, der kører i analogi med voxel-baseret morfometri (VBM), som er normalt kendt som voxel-baserede morfometri / statistikker om DTI data (VBM / DTI) <em>. VBM er en metode, der oprindeligt kører på kontrastrige billeder hvor kontraster i separate scanninger skal løses mens WBSS er en metode, der bruger den voxelwise sammenligning af en fysisk parameter. Så selv algoritmisk ens, vil en terminologi, som differentierende WBSS og VBM blive anvendt i det følgende.
Protocol
Representative Results
Discussion
Interpersonelle gennemsnit af DTI data kan opnås med hensyn til diffusion amplitude (ved anvendelse af FA information) og diffusion retning (baseret på FT), hhv. Midling af FA maps giver mulighed for statistisk sammenligning af emnegrupper ved WBSS og TFAS. Denne metodologiske ramme giver en introduktion til DTI teknikker med inter-emne midling og gruppearbejde sammenligning. Stereotaktisk normalisering og sammenligning af FA maps på koncernniveau giver mulighed for flere muligheder for at kvantificere forskelle mell…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dele af dette arbejde, dvs undersøgelse om QC og korrektion for beskadigede gradient retninger i ansøgning til data fra patienter med hyperkinetisk forstyrrelser, blev støttet af det europæiske HD-netværket (EHDN projekt 070). De MR-scanninger i denne bestemte undersøgelse er erhvervet som en del af Londons hjemmeside TRACK-HD kohorten.
Materials
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT – Tensor Imaging and Fiber Tracking |
References
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies – a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer’s disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer’s disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington’s disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington’s disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI – Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology – special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).

