Neurodegenerative रोगों के विश्लेषण में प्रसार tensor चुंबकीय अनुनाद इमेजिंग
Summary
एक एमआरआई आधारित उपकरण की पहचान के रूप में प्रसार tensor इमेजिंग (डीटीआई) मूल रूप में कार्य करता है<em> Vivo में</em> मस्तिष्क सफेद मामले में मस्तिष्क संबंधी बीमारियों के कारण मस्तिष्क और रोग प्रक्रियाओं के microstructure. डीटीआई आधारित विश्लेषण समूह स्तर पर और एक विषय के डेटा में दोनों मस्तिष्क रोगों के लिए आवेदन के लिए अनुमति देते हैं.
Abstract
प्रसार tensor इमेजिंग (डीटीआई) तकनीक vivo में मस्तिष्क सफेद पदार्थ (WM) का microstructural प्रक्रियाओं के बारे में जानकारी प्रदान करते हैं. वर्तमान अनुप्रयोगों मिलान नियंत्रण के साथ तुलना में अलग डीटीआई विश्लेषण के उपयोग से अलग मस्तिष्क की बीमारियों, विशेष रूप से neurodegenerative विकारों, में WM भागीदारी पैटर्न के मतभेद की जांच करने के लिए तैयार कर रहे हैं.
डीटीआई डेटा विश्लेषण एक variate फैशन में किया जाता है, एक साथ फाइबर ट्रैकिंग के साथ इस तरह के आंशिक anisotropy के रूप में क्षेत्रीय प्रसार दिशा आधारित मैट्रिक्स (एफए), (एफटी) की यानी voxelwise तुलना क्रम में समूह स्तर पर tractwise आंशिक anisotropy आंकड़े (TFAS) के साथ समूह स्तर पर WM परिवर्तन के क्षेत्रीय पैटर्न की परिभाषा पर निशाना, WM संरचनाओं के साथ एफए में मतभेद की पहचान करने के लिए. एक stereotaxic मानक अंतरिक्ष में परिवर्तन समूह के अध्ययन के लिए एक शर्त है और घ को संरक्षित करने के लिए प्रसंस्करण पूरी तरह से डेटा की आवश्यकताirectional अंतर – निर्भरता. वर्तमान अनुप्रयोगों समूह स्तर पर डेटा विश्लेषण में स्थानिक सामान्य बनाने के दौरान मात्रात्मक और दिशात्मक जानकारी के इस संरक्षण के लिए अनुकूलित तकनीकी दृष्टिकोण दिखा. इस आधार पर, एफटी तकनीक एफटी द्वारा परिभाषित मैट्रिक्स जानकारी यों के क्रम में समूह औसतन डेटा के लिए लागू किया जा सकता है. इसके अतिरिक्त, डीटीआई तरीकों के आवेदन, एक व्यक्ति के विषय के आधार पर एक अनुदैर्ध्य विश्लेषण में stereotaxic संरेखण के बाद एफए नक्शे में यानी मतभेद, मस्तिष्क संबंधी बीमारियों की प्रगति के बारे में जानकारी से पता चलता है. डीटीआई आधारित परिणामों की आगे की गुणवत्ता में सुधार के उच्च शोर के स्तर के साथ ढाल दिशाओं की एक नियंत्रित उन्मूलन के आवेदन के द्वारा preprocessing के दौरान प्राप्त किया जा सकता है.
सारांश में, डीटीआई पूरे मस्तिष्क आधारित और पथ आधारित डीटीआई विश्लेषण के संयोजन से अलग मस्तिष्क रोगों की एक अलग WM pathoanatomy परिभाषित करने के लिए प्रयोग किया जाता है.
Introduction
मानव मस्तिष्क में प्रसार tensor इमेजिंग
केंद्रीय तंत्रिका तंत्र में सफेद पदार्थ (WM) इलाकों neuroglia और कोशिकाओं के अन्य छोटी आबादी के विभिन्न प्रकार के अलावा घनी पैक एक्सोन से मिलकर बनता है. एक अक्षतंतु भीतर axonal झिल्ली के रूप में भी अच्छी तरह से गठबंधन प्रोटीन फाइबर मस्तिष्क WM 1 में अनिसोट्रोपिक पानी प्रसार करने के लिए अग्रणी, फाइबर उन्मुखीकरण के लिए पानी प्रसार सीधा प्रतिबंधित करता है. एक्सोन आसपास मेलिन शीथ भी अंतर और बाह्य पानी 2 दोनों के लिए anisotropy से योगदान कर सकते हैं.
इस anisotropy के मात्रात्मक वर्णन प्रसार tensor इमेजिंग (डीटीआई) द्वारा पता लगाया जा सकता है. डीटीआई पानी प्रसार के स्थानीय microstructural विशेषताओं के साथ भारित ऊतकों की छवियों पैदा करता है. प्रत्येक स्थिति में छवि तीव्रता (में प्रतिनिधित्व तथाकथित चुंबकीय प्रसार ढाल की ताकत और दिशा पर निर्भर करता है, तनु हैंबी मूल्य), साथ ही पानी के अणुओं 3 फैलाना जिसमें स्थानीय माइक्रोस्ट्रक्चर, प्रसार गुणांक डी, एक अदिश मूल्य पर:
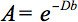
हालांकि, WM में anisotropy के उपस्थिति में, प्रसार अब कोई भी अदिश गुणांक की विशेषता है, लेकिन एक टेंसर आवश्यकता किया जा सकता है  पहले अनुमान के इन निर्देशों के बीच 4 प्रत्येक दिशा और सहसंबंध साथ आणविक गतिशीलता का वर्णन करता है. प्रसार anisotropy मुख्य रूप WM में फाइबर इलाकों के उन्मुखीकरण के कारण होता है और इसकी सूक्ष्म और macrostructural सुविधाओं से प्रभावित है. Microstructural सुविधाओं की, intraaxonal संगठन फाइबर एक के घनत्व के अलावा प्रसार anisotropy पर सबसे बड़ा प्रभाव का प्रतीत होता हैएन डी सेल पैकिंग, myelination की डिग्री, और व्यक्तिगत फाइबर व्यास. एक macroscopic पैमाने पर, एक इमेजिंग voxel में सभी WM के इलाकों के अभिविन्यास में परिवर्तनशीलता anisotropy 5 की अपनी डिग्री को प्रभावित करती है.
पहले अनुमान के इन निर्देशों के बीच 4 प्रत्येक दिशा और सहसंबंध साथ आणविक गतिशीलता का वर्णन करता है. प्रसार anisotropy मुख्य रूप WM में फाइबर इलाकों के उन्मुखीकरण के कारण होता है और इसकी सूक्ष्म और macrostructural सुविधाओं से प्रभावित है. Microstructural सुविधाओं की, intraaxonal संगठन फाइबर एक के घनत्व के अलावा प्रसार anisotropy पर सबसे बड़ा प्रभाव का प्रतीत होता हैएन डी सेल पैकिंग, myelination की डिग्री, और व्यक्तिगत फाइबर व्यास. एक macroscopic पैमाने पर, एक इमेजिंग voxel में सभी WM के इलाकों के अभिविन्यास में परिवर्तनशीलता anisotropy 5 की अपनी डिग्री को प्रभावित करती है.
ठेठ डीटीआई माप में, voxel आयाम मिलीमीटर के क्रम में हैं. इस प्रकार, एक voxel हमेशा आमतौर पर कई axons के साथ ही आसपास के पानी के अणुओं को शामिल किया गया पता लगाया है कि मात्रा के अंदर पानी के अणुओं की औसतन जानकारी शामिल हैं. इस multidirectional माहौल के बावजूद, डीटीआई प्रमुख axonal दिशा को संरेखित करता है जो सबसे बड़ा मुख्य धुरी के उन्मुखीकरण के प्रति संवेदनशील है, यानी axonal योगदान मापा संकेत 2 हावी है.
पहला, प्रसार anisotropy 5 और दूसरे के उन्मुखीकरण स्वतंत्र हद, imag में पानी प्रसार के प्रमुख दिशा: डीटीआई पानी प्रसार की संपत्ति के बारे में सूचना के दो प्रकार प्रदान करता हैई voxels, प्रसार अभिविन्यास 6 अर्थात्.
निम्नलिखित में उल्लिखित के रूप में वर्तमान प्रोटोकॉल, समूह स्तर पर विषय समूहों की मात्रात्मक तुलना के लिए DTI विश्लेषण तकनीक की एक रूपरेखा प्रदान करने वाले हैं.
प्रसार संपत्तियों की मात्रा – विश्लेषण पैरामीटर
ख (1 समीकरण) एक टेंसर बन गया है कि इतनी सममित टेंसर के तत्वों के संकेत क्षीणन, जिसके परिणामस्वरूप कम से कम छह गैर समरेख और गैर समतलीय दिशाओं साथ प्रसार ढ़ाल से मापा जा सकता है
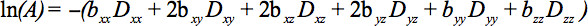
इस समीकरण ओर्थोगोनल दिशाओं (पार संदर्भ) में आवेदन किया है और भी लागू कर रहे हैं कि इमेजिंग ढ़ाल के बीच रहे हैं कि इमेजिंग और प्रसार ढ़ाल के बीच संभावित बातचीत के लिए लेखांकन की आवश्यकताओर्थोगोनल दिशाओं 4 में.
दूसरी रैंक प्रसार tensor  हमेशा टेंसर के मुख्य विकर्ण के साथ केवल तीन गैर शून्य तत्वों छोड़ने diagonalized किया जा सकता है, (Eigenvalues यानी
हमेशा टेंसर के मुख्य विकर्ण के साथ केवल तीन गैर शून्य तत्वों छोड़ने diagonalized किया जा सकता है, (Eigenvalues यानी 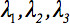 ). Eigenvalues दीर्घवृत्ताभ के आकार या विन्यास को दर्शाते हैं. दीर्घवृत्ताभ और प्रयोगशाला फ्रेम के प्रिंसिपल निर्देशांक के बीच गणितीय संबंध eigenvectors द्वारा वर्णित है
). Eigenvalues दीर्घवृत्ताभ के आकार या विन्यास को दर्शाते हैं. दीर्घवृत्ताभ और प्रयोगशाला फ्रेम के प्रिंसिपल निर्देशांक के बीच गणितीय संबंध eigenvectors द्वारा वर्णित है 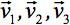
टेंसर डेटा प्रदर्शित करने में कई चुनौतियों का सामना कर रहे हैं, प्रसार ellipsoids की अवधारणा 3 प्रस्ताव किया गया है. इन ई के Eigendiffusivitiesदीर्घवृत्ताभ की सनक के बारे में जानकारी प्रदान करता है, जबकि दीर्घवृत्ताभ की मुख्य धुरी, फाइबर की दिशा के साथ मेल खाता है जो voxel में मुख्य प्रसार दिशा का प्रतिनिधित्व करता है यानी llipsoids, मध्यम के diffusivities की मुख्य दिशा में एकआयामी प्रसार गुणांक का प्रतिनिधित्व anisotropy और इसकी समरूपता की डिग्री. इसलिए, इस तरह आंशिक anisotropy (एफए) के रूप में प्रसार anisotropy मैट्रिक्स 7 में परिभाषित किया जा सकता है.
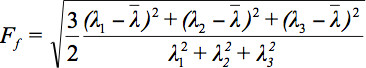
 सभी Eigenvalues का अंकगणितीय औसत है.
सभी Eigenvalues का अंकगणितीय औसत है.
एक अतिरिक्त दृष्टिकोण tractography approa के लिए इसी, मस्तिष्क की WM कनेक्टिविटी को संबोधित करने के प्रसार tensor के प्राचार्य दिशा उपयोग करने के लिए हैजो चर्चा एक दूसरे से जुड़े हुए हैं जो मस्तिष्क के कुछ हिस्सों को जांच करने का इरादा नहीं है. प्रसार tensor के प्रमुख घटक के उन्मुखीकरण प्रमुख axonal इलाकों के उन्मुखीकरण का प्रतिनिधित्व करता है यह मानते हुए कि प्रत्येक वेक्टर फाइबर अभिविन्यास का प्रतिनिधित्व करता है, जिसमें एक 3 डी वेक्टर क्षेत्र प्रदान की जाती है. पहली श्रेणी में फाइबर पथ प्रचार 2,8,9 के प्रत्येक चरण के लिए स्थानीय टेंसर जानकारी का उपयोग कर लाइन प्रचार एल्गोरिदम पर आधारित है: वर्तमान में, दो प्रकार में विभाजित किया जा सकता है जो WM के इलाकों के पुनर्निर्माण के लिए कई अलग अलग दृष्टिकोण हैं. दूसरी श्रेणी पथ आधारित स्थानिक आँकड़े के दृष्टिकोण में जिसके परिणामस्वरूप दो WM के क्षेत्रों के बीच उर्जा सबसे अनुकूल रास्ता खोजने के लिए, वैश्विक ऊर्जा न्यूनतम पर आधारित है (TBSS) ऐसे tractwise आंशिक anisotropy आंकड़े (TFAS के रूप में अन्य एल्गोरिदम में इस्तेमाल किया गया है जो 10 – प्रोटोकॉल पाठ, अनुभाग 2.4 देखें)..
Stereotaxic स्टैंड में परिवर्तनअर्द अंतरिक्ष
अन्य उन्नत एमआरआई तरीकों में की तरह, एक नैदानिक संदर्भ में डीटीआई और एफटी आधारित अध्ययन 11 मीट्रिक कुछ भेदभाव के आधार पर निदान की प्रक्रिया को सुविधाजनक बनाने के क्रम में व्यक्तिगत रोगी के मस्तिष्क आकारिकी वर्गीकृत करने के लिए अंतिम लक्ष्य का पीछा. आम नैदानिक phenotype के एक या अधिक विशिष्ट मस्तिष्क क्षेत्रों या एक विशिष्ट neuroanatomical नेटवर्क को नुकसान के कारण माना जाता है अगर समूह स्तर पर अध्ययन सबसे अधिक प्रासंगिक हैं. इधर, विभिन्न विषयों के परिणाम की औसत microstructural परिवर्तन के आम पैटर्न का आकलन करने के क्रम में उपयोगी है. प्रत्येक व्यक्ति के मस्तिष्क है, ताकि एक दूसरे चरण में औसतन गणित एक voxel द्वारा voxel स्तर पर परिणामों की संभव है stereotaxic अंतरिक्ष में स्थानांतरित किया जाना है. स्थानिक सामान्य बनाने के संकेत करने वाली शोर अनुपात (SNR) में सुधार करने के लिए और रोगियों के नमूने और आगे की तुलना करने के क्रम में विभिन्न विषयों से प्राप्त परिणामों का अंकगणित औसत के लिए अनुमतिROLS एक विशिष्ट विकार के कम्प्यूटेशनल pathoanatomy का विश्लेषण करने के क्रम में, एक विशिष्ट मस्तिष्क प्रणाली का स्वांग के साथ जुड़ा हुआ है जो एक neurodegenerative रोग उदा.
12 से एक मानकीकृत stereotaxic अंतरिक्ष को सामान्य बनाने की जल्दी दृष्टिकोण मस्तिष्क के विभिन्न स्थलों और मस्तिष्क चतुर्भागों के टुकड़ों स्केलिंग की पहचान से जुड़े एक मानक एटलस के लिए एक परिवर्तन कलन विधि का सुझाव दिया. आजकल, उन्नत एमआरआई डेटा विश्लेषण संकुल के अधिकांश मॉन्ट्रियल स्नायविक संस्थान (MNI) stereotaxic अंतरिक्ष 13 को सामान्य बनाने का उपयोग करें. इस बदलाव के लिए, अध्ययन विशिष्ट टेम्पलेट का उपयोग अर्ध स्वचालित और स्वचालित मस्तिष्क पंजीकरण एल्गोरिदम 14,15 विकसित किए गए. डीटीआई में, विशेष ध्यान सामान्य बनाने की प्रक्रिया 16,17 दौरान दिशात्मक जानकारी की रक्षा करने के लिए तैयार हो गया है. डीटी एमआर छवियों स्थानिक परिवर्तनों का आवेदन जो स्थानिक सामान्य बनाने के लिए आवश्यक हैंके सेट डेटा के संग्रह डीटीएस फिर परिवर्तन से प्रभावित है जो orientational जानकारी हो कि इस तथ्य से जटिल वार्पिंग अदिश छवियों, के विपरीत है. इस आशय तब्दील छवि का शारीरिक शुद्धता सुनिश्चित करने के लिए जिम्मेदार होना चाहिए. इधर, डीटीआई डेटा सेट करने के लिए affine परिवर्तनों को लागू करने के लिए तकनीक प्रस्तुत कर रहे हैं.
मस्तिष्क की बीमारियों के लिए DTI के आवेदन
अनुदैर्ध्य डीटीआई डेटा की तुलना एक दूसरे के बीच एक विषय के डेटा का एक संरेखण / पंजीकरण की आवश्यकता है. इस संदर्भ में दिशात्मक जानकारी के संरक्षण (affine परिवर्तनों के दौरान प्रसार tensor यानी रोटेशन) आवश्यक है. Neurodegenerative विकारों के लिए संभावित अनुप्रयोगों (जैसे 18,19) पहले से सूचित किया गया है.
डीटीआई विवो neuropathol में जांच करने के लिए एक मजबूत गैर इनवेसिव तकनीकी उपकरण के रूप में स्थापित कर दिया गया हैWM न्यूरोनल इलाकों के ogy (जैसे 11,20,21,22). प्रसार की प्रक्रिया के डीटीआई आधारित मात्रात्मक मैट्रिक्स, एफए, जैसे पहले से ही इस तरह के स्ट्रोक 20, एकाधिक काठिन्य 23, amyotrophic पार्श्व काठिन्य 24, 25, अल्जाइमर रोग के 26 रूप WM विकृतियों की एक विस्तृत श्रृंखला का अध्ययन करने के लिए संवेदनशील मार्कर होना दिखाया गया है , और कई अन्य WM विकारों 27,28.
इसके अतिरिक्त, एफटी साथ डीटीआई WM के हिस्से 23 की पहचान करने के लिए इस्तेमाल किया जा सकता है. इस तकनीक को अभी भी नियमित नैदानिक प्रयोग में, स्नायविक रोग में मार्ग विशिष्ट असामान्यताओं के मूल्यांकन के लिए एक शक्तिशाली साधन के रूप में उभर रहा है नहीं है. पहचान इलाकों के भीतर, विभिन्न मात्रात्मक एमआरआई सूचकांक डीटीआई डेटा के लिए संरचनात्मक रूप coregistered हैं मापा जा सकता है कि डीटीआई और अतिरिक्त अधिग्रहण (जैसे टी 2 भारित छवियों और / या आकर्षण संस्कार स्थानांतरण (एमटी) इमेजिंग) से निकाली गई. इसके द्वारा, प्रत्येक सूचकांक calcul हो सकता हैपथ के प्रोफाइल के रूप में उनके स्थानिक विभिन्नता चित्रण भूखंडों की चर्चा करते हुए पथ के भीतर स्थिति के एक समारोह के रूप में पैदा.
1.5 पर प्रदर्शन किया गया जो निम्नलिखित, मानव DTI स्कैन में टेस्ला एमआरआई स्कैनर (सीमेंस चिकित्सा, अरलैंगेन, जर्मनी) रोगी समूहों में और साथ ही व्यक्तियों में सफेद बात असामान्यताओं का पता लगाने के लिए विभिन्न तकनीक विश्लेषण की क्षमता की जांच करने के लिए इस्तेमाल किया गया. कलाकृतियों के अन्य प्रकार के साथ गति भ्रष्ट मात्रा और मात्रा के उन्मूलन के लिए एक स्वचालित गुणवत्ता की जांच करने के बाद, मानकीकृत postprocessing प्रक्रियाओं लगातार विश्लेषण के लिए DTI डेटा तैयार करते हैं. अलग विश्लेषण दृष्टिकोण निम्नलिखित में सचित्र, यानी स्थानिक आँकड़े आधारित पहला, पूरे मस्तिष्क (WBSS), दूसरा, एफटी, और तीसरे, Tractwise आंशिक anisotropy आंकड़े (TFAS). जाएगा WBSS आमतौर पर डीटीआई डेटा (VBM / डीटीआई) पर voxel आधारित morphometry / आँकड़े के रूप में जाना जाता है जो voxel आधारित morphometry (VBM) के सादृश्य में चलाता है एक विधि है <eमीटर>. VBM मूल WBSS एक शारीरिक पैरामीटर की voxelwise तुलना का उपयोग करता है कि एक विधि है, जबकि अलग स्कैन में विपरीत मतभेदों को हल किया जाना है जहां विपरीत छवियों पर चलाता है एक विधि है. एल्गोरिदम समान हालांकि इसलिए, WBSS और VBM फर्क है जो एक शब्दावली निम्नलिखित में इस्तेमाल किया जाएगा.
Protocol
Representative Results
Discussion
डीटीआई डेटा के इंटर विषय औसतन क्रमश: प्रसार आयाम (एफए जानकारी के उपयोग के द्वारा) और प्रसार की दिशा (एफटी के आधार पर) के लिए सम्मान के साथ प्राप्त किया जा सकता है. एफए नक्शे की औसत WBSS और TFAS द्वारा विषय समूहों …
Disclosures
The authors have nothing to disclose.
Acknowledgements
इस काम के पार्ट्स, QC और hyperkinetic विकारों के साथ मरीजों के डेटा के लिए आवेदन में भ्रष्ट ढाल दिशाओं के लिए सुधार पर अध्ययन यानी यूरोपीय HD नेटवर्क (EHDN परियोजना 070) द्वारा समर्थित थे. कुछ इस अध्ययन में एमआरआई स्कैन लंदन साइट ट्रैक एच.डी. पलटन के भाग के रूप में हासिल किया गया.
Materials
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT – Tensor Imaging and Fiber Tracking |
References
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies – a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer’s disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer’s disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington’s disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington’s disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI – Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology – special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).

