Diffusion Tensor Magnetic Resonance Imaging i Analyse av nevrodegenerative sykdommer
Summary
Diffusion tensor imaging (DTI) fungerer i utgangspunktet som en MRI-basert verktøy for å identifisere<em> In vivo</em> Mikrostrukturen av hjernen og patologiske prosesser på grunn av nevrologiske lidelser innenfor den cerebrale hvit substans. DTI-baserte analyser tillate søknad til hjernen sykdommer både på konsernnivå og i enkelt emne data.
Abstract
Diffusion tensor imaging (DTI) teknikker gir informasjon om mikrostruktur prosesser av cerebral hvit substans (WM) in vivo. Dagens programmer er laget for å undersøke forskjeller i WM involvering mønstre i ulike hjernesykdommer, spesielt nevrodegenerative lidelser, ved bruk av ulike DTI analyser sammenlignet med matchede kontroller.
DTI dataanalyse er utført i et variate mote, dvs. voxelwise sammenligning av regionale diffusjon retning-baserte beregninger som fractional anisotropy (FA), sammen med fiber sporing (FT) ledsaget av tractwise brøk anisotropi statistikk (tfas) på konsernnivå i orden å identifisere forskjeller i FA langs WM strukturer, med sikte på å definere regionale mønstre av WM endringer på gruppenivå. Transformasjon til en stereotaxic standard plass er en forutsetning for gruppe studier og krever grundige databehandling å bevare directional inter-avhengigheter. De nåværende Søknadene viser optimaliserte tekniske tilnærminger for dette bevaring av kvantitative og retningsbestemt informasjon under romlig normalisering i dataanalyser på konsernnivå. På dette grunnlag kan FT teknikker brukes til å gruppere gjennomsnitt data for å kvantifisere beregninger informasjon som definert av FT. I tillegg, anvendelse av DTI metoder, det vil si forskjeller i FA-maps etter stereotaxic justering, i en langsgående analyse på et enkelt fag basis avsløre informasjon om utviklingen av nevrologiske lidelser. Ytterligere kvalitetsforbedring av DTI baserte resultater kan oppnås i løpet av forbehandling ved anvendelse av en kontrollert eliminering av gradient retninger med høyt støynivå.
Oppsummert er dti brukt til å definere en distinkt WM pathoanatomy forskjellige hjernesykdommer ved kombinasjonen av hel hjerne-baserte og tarmkanalen-baserte DTI analyse.
Introduction
Diffusjon tensor avbildning i den menneskelige hjerne
Den hvite substans (WM) trakter i det sentrale nervesystemet består av tettpakkede axoner i tillegg til ulike typer neuroglia og andre små populasjoner av celler. Den aksonal membran samt godt justert proteinfibrer innenfor et akson begrenser vanndampdiffusjonssperre vinkelrett på fiber-retningen, noe som fører til vann anisotrop diffusjon i hjernen WM 1.. Myelin hylser rundt aksonene kan også bidra til den anisotropi for både intra-og ekstracellulært vann 2..
Den kvantitative beskrivelse av denne anisotropi kunne påvises ved diffusjon tensor imaging (DTI). DTI produserer bilder av vev vektet med de lokale mikrostruktur egenskaper vann diffusjon. Bilde-intensitet ved hver posisjon dempes, avhengig av styrken og retningen av den såkalte magnetiske diffusjon gradient (representert ib-verdi), så vel som på den lokale mikrostruktur hvori vannmolekylene diffundere 3, diffusjonskoeffisienten D, en skalar-verdi:
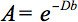
Imidlertid, i nærvær av anisotropi i WM, kan diffusjon ikke lenger være kjennetegnet av en enkelt skalar koeffisient, men krever en tensor  som i første tilnærming beskriver molekylær mobilitet langs hver retning og sammenheng mellom disse retningene fire. Diffusion anisotropy er hovedsakelig forårsaket av retningen på fiber traktater i WM og påvirkes av sine mikro-og macrostructural funksjoner. Av mikrostruktur egenskaper, synes intraaxonal organisasjon å være av størst innflytelse på diffusjon anisotropy, foruten tettheten av fiber ennd celle pakking, grad av myelination, og individuell fiber diameter. På en makroskopisk skala, påvirker variasjoner i orienteringen til alle WM trakter i en avbildning voksel dens grad av anisotropi 5..
som i første tilnærming beskriver molekylær mobilitet langs hver retning og sammenheng mellom disse retningene fire. Diffusion anisotropy er hovedsakelig forårsaket av retningen på fiber traktater i WM og påvirkes av sine mikro-og macrostructural funksjoner. Av mikrostruktur egenskaper, synes intraaxonal organisasjon å være av størst innflytelse på diffusjon anisotropy, foruten tettheten av fiber ennd celle pakking, grad av myelination, og individuell fiber diameter. På en makroskopisk skala, påvirker variasjoner i orienteringen til alle WM trakter i en avbildning voksel dens grad av anisotropi 5..
I typiske DTI målinger, de Voxel dimensjoner er i størrelsesorden millimeter. Således inneholder en voksel alltid den informasjon middelverdisignal av vann-molekylene i den detekterte volum som vanligvis omfatter flere axoner, så vel som det omgivende vann molekyler. Til tross for dette multidirectional miljø, er dti følsom for orienteringen av det største hovedakse, som er justert til den axonal dominerende retning, dvs. den axonal bidraget dominerer det målte signal 2..
DTI gir to typer informasjon om eiendommen med vann diffusjon: For det første orienteringen-uavhengig grad av diffusjon anisotropy 5 og andre, den dominerende retning av vann diffusjon i image voxels, dvs. diffusjon orientering seks.
Gjeldende protokoller er ment å gi et rammeverk av DTI analyseteknikker for kvantitativ sammenligning av faggruppene på gruppenivå, som beskrevet i det følgende.
Kvantifisering av diffusjon egenskaper – analyseparametere
De deler av den symmetriske tensor kan måles ved diffusjon gradienter langs minst seks ikke-kolineære og ikke-koplanare retninger, slik at b (Ligning 1) er blitt en tensor, som resulterer i signaldempning
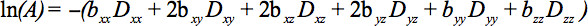
Denne ligningen krever regnskap for mulige interaksjoner mellom bildebehandling og diffusjon gradienter som er brukt i ortogonale retninger (kryss vilkår), og selv mellom bildebehandling gradienter som er brukti ortogonale retninger fire.
Den andre-rank diffusjon tensor  kan alltid bli diagonaliseres slik at bare tre ikke-null elementer langs de viktigste diagonalen i tensor, dvs. Egenverdier (
kan alltid bli diagonaliseres slik at bare tre ikke-null elementer langs de viktigste diagonalen i tensor, dvs. Egenverdier ( 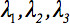 ). Egenverdiene reflekterer formen eller konfigurasjonen av ellipsoiden. Den matematiske forholdet mellom oppdragsgiver koordinatene for ellipsoiden og laboratoriet rammen er beskrevet av egenvektorene
). Egenverdiene reflekterer formen eller konfigurasjonen av ellipsoiden. Den matematiske forholdet mellom oppdragsgiver koordinatene for ellipsoiden og laboratoriet rammen er beskrevet av egenvektorene 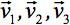
Siden det er flere utfordringer i å vise tensor data, har begrepet diffusjon ellipsoidene blitt foreslått tre. De Eigendiffusivities av disse ellipsoids representerer unidimensional diffusjonskoeffisienter i hovedretningen av diffusivities ved mediet, dvs. hovedaksen til ellipsoiden representerer den viktigste diffusjon retning i voksel som faller sammen med retningen av fibrene, mens den eksentrisiteten for ellipsoiden gir informasjon om grad av anisotropy og symmetri. Derfor kan diffusjon anisotropi beregninger som brøk anisotropy (FA) defineres syv.
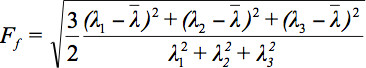
 er det aritmetiske gjennomsnittet av alle Egenverdier.
er det aritmetiske gjennomsnittet av alle Egenverdier.
En ytterligere tilnærming er å bruke den viktigste retning av diffusjon tensor å ta opp WM tilkobling av hjernen, tilsvarende tractography approalm, som har til hensikt å undersøke hvilke deler av hjernen er koblet til hverandre. Forutsatt at orienteringen av den større komponent i diffusjonstensor representerer orienteringen av de dominerende aksonal traktene, er et 3-D vektorfeltet fremskaffet hvor hver vektor representerer fiberorientering. For tiden er det flere ulike tilnærminger til rekonstruere WM traktater som kan deles inn i to typer: Den første kategorien er basert på linje forplantning algoritmer ved hjelp av lokale tensor informasjon for hvert trinn i fiber skrift forplantning 2,8,9. Den andre kategorien er basert på globale energi minimering å finne den energimessig mest gunstige veien mellom to WM regioner, noe som resulterer i tilnærmingen til skrift-baserte romlig statistikk (TBSS) 10 som har vært brukt i andre algoritmer som tractwise brøk anisotropi statistikk (tfas – se protokoll tekst, punkt 2.4)..
Transformasjon til stereotaxic stativard plass
Som i andre avanserte MR-metoder, DTI-og FT-baserte studier i en klinisk sammenheng forfølge det endelige målet å kategorisere enkelte pasientens hjerne morfologi for å lette den diagnostiske prosessen basert på noen diskriminering metrisk 11. Studier på gruppenivå er mest aktuelt dersom vanlig klinisk fenotype er ment å være grunnet skader på en eller flere spesifikke områder av hjernen eller en bestemt nevroanatomi nettverk. Her, i snitt av resultatene for ulike fag er nyttig for å vurdere felles mønstre av mikrostruktur endringer. Hver enkelt hjerne må overføres inn i stereotaktisk plass, slik at, i et andre trinn, det aritmetiske gjennomsnitt av resultatene på en voxel-for-voxel nivå er mulig. Romlig normalisering tillatt for aritmetisk gjennomsnitt av resultatene oppnådd fra forskjellige fag for å forbedre signal-til-støy-forhold (SNR) og for å utføre en sammenligning av prøver fra pasienter og fortsrols for å analysere den beregningsmessige pathoanatomy av en spesifikk sykdom, for eksempel en nevrodegenerativ sykdom som er assosiert med den affectation av en spesifikk hjerne-system.
Den tidlige tilnærming av normalisering til en standardisert stereotaxic plass med 12 foreslått en transformasjon algoritme til en standard atlas involverer identifisering av ulike hjernen landemerker og stykkevis skalering av hjernen kvadranter. I dag, de fleste av de avanserte MR dataanalyse pakker bruke normalisering til Montreal Nevrologisk Institute (MNI) stereotaksisk plass 13. For denne transformasjonen ble halvautomatisk og automatisert hjernen registrering algoritmer ved hjelp studere spesifikke maler utviklet 14,15. I DTI har spesiell oppmerksomhet for å bli trukket for å bevare retningsbestemt informasjon under normalisering prosessen 16,17. Anvendelsen av romlige omdannelser for DT-MR-bilder som er nødvendig for romlig normaliseringav samlinger av datasett er, i motsetning til skalare warping bilder, komplisert ved det faktum at delirium inneholde orienteringsmessig informasjon som blir igjen påvirket av transformasjonen. Denne effekten må tas hensyn til for å sikre den anatomiske riktigheten av den transformerte bildet. Her er teknikker for påføring affine transformasjoner til dti datasett presentert.
Anvendelsen av DTI til hjernesykdommer
Sammenligningen av langsgående DTI opplysninger kreves en justering / registrering av en motivets data mellom hverandre. I den sammenheng er bevaring av retningsbestemt informasjon som er nødvendig (dvs. rotasjon av diffusjon tensor under affine transformasjoner). Mulige bruksområder til nevrodegenerative sykdommer har blitt rapportert tidligere (f.eks 18,19).
DTI har blitt etablert som en robust non-invasiv tekniske verktøy for å undersøke in vivo neuropathollogi av WM nevrale traktater (f.eks 11,20,21,22). DTI-baserte kvantitative beregninger av diffusjons-prosessen, f.eks FA, har allerede blitt vist å være sensitive markører for å studere et bredt spekter av WM patologier, slik som 20 hjerneslag, multippel sklerose 23, amyotrofisk lateral 24 sklerose, 25, Alzheimers sykdom 26 , og flere andre WM lidelser 27,28.
I tillegg kan DTI med FT brukes til å identifisere WM traktater 23. Denne teknikken, samtidig som den ikke er i rutinemessig klinisk bruk, fremstår som et kraftig instrument for vurdering av sti-spesifikke abnormaliteter i nevrologisk sykdom. Innenfor de identifiserte områder, ulike kvantitative MR indekser avledet fra DTI og ytterligere oppkjøp (f.eks T2-vektede bilder og / eller magnetiseringen transfer (MT) imaging) som er anatomisk coregistered til DTI data kunne måles. Herved kan hver indeks være calculrerte som en funksjon av posisjonen i tarmkanalen, med henvisning til plott som viser deres romlige variasjon som tarmkanalen profiler.
I de følgende, menneskelige DTI skanner som ble utført på 1,5 Tesla MR-skannere (Siemens Medical, Erlangen, Tyskland) ble brukt til å undersøke potensialet av ulike analyseteknikker for påvisning av hvit substans abnormaliteter i pasientgrupper samt i enkeltpersoner. Etter en automatisert kvalitetskontroll for eliminering av motion-ødelagte volumer og volumer med andre typer gjenstander, standardiserte postprosesseringsjuksekoder prosedyrer forberede DTI data for påfølgende analyse. Ulike analyser tilnærminger vil bli belyst i det følgende, dvs. første, hele hjernen basert romlige statistikk (WBSS), andre, FT, og tredje, Tractwise fractional anisotropi statistikk (tfas). WBSS er en metode som går i analogi til voxel-baserte morfometri (VBM) som vanligvis er kjent som voxel-baserte morfometri / statistikk om DTI data (VBM / DTI) <em>. VBM er en metode som opprinnelig kjører på kontrast der kontrast forskjeller i separate skanninger må løses mens WBSS er en metode som bruker voxelwise sammenligning av en fysisk parameter. Derfor, selv om algoritmisk lignende, vil en terminologi som er differensierende WBSS og VBM bli brukt i det følgende.
Protocol
Representative Results
Discussion
Inter-individuelle gjennomsnittverdi DTI data kan oppnås med hensyn til diffusjon amplitude (ved bruk av FA informasjon) og diffusjon retning (basert på FT), henholdsvis. Midling av FA maps tillater statistisk sammenligning av faggruppene ved WBSS og tfas. Denne metodiske rammeverket gir en innføring i DTI teknikker med mellom forsøkspersonene gjennomsnitt og gruppen sammenligning. Stereotaxic normalisering og sammenligning av FA kart på konsernnivå åpner for flere muligheter for å kvantifisere forskjeller mello…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Deler av dette arbeidet, dvs. studie på QC og korrigering for ødelagt gradient retninger i programmet til data fra pasienter med hyperkinetisk forstyrrelse, ble støttet av European HD nettverk (EHDN prosjekt 070). MR skanner i denne bestemte studien ble kjøpt som en del av London nettstedet TRACK-HD kohort.
Materials
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT – Tensor Imaging and Fiber Tracking |
References
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies – a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer’s disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer’s disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington’s disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington’s disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI – Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology – special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).

