Diffusion Tensor Magnetic Resonance Imaging i Analys av neurodegenerativa sjukdomar
Summary
Diffusion tensor imaging (DTI) fungerar i princip som en MR-baserat verktyg för att identifiera<em> In vivo</em> Mikrostrukturen av hjärnan och patologiska processer till följd av neurologiska sjukdomar inom vit hjärnvävnad. DTI-baserade analyser möjliggör ansökan till hjärnsjukdomar både på koncernnivå och i fristående uppgifter.
Abstract
Diffusion tensor imaging (DTI) teknik ger information om de mikrostrukturella processer i vit hjärnvävnad (WM) in vivo. Föreliggande program är utformade för att undersöka skillnader i WM engagemang mönster i olika hjärnsjukdomar, speciellt neurodegenerativa sjukdomar genom användning av olika DTI analyser jämfört med matchade kontroller.
DTI dataanalys utförs i en variate mode, dvs voxelwise jämförelse av regionala diffusion riktning-baserade mätmetoder såsom fraktionerad anisotropi (FA), tillsammans med fiber spårning (FT) åtföljs av tractwise fraktionerad anisotropi statistik (TFAs) på gruppnivå i syfte att identifiera skillnader i FA längs WM strukturer, som syftar till definitionen av regionala mönster WM förändringar på gruppnivå. Omvandling till en stereotaktisk standard utrymme är en förutsättning för gruppens studier och kräver noggranna databehandling för att bevara directional inter-beroenden. De aktuella ansökningarna visar optimerade tekniska metoder för bevarande av kvantitativa och riktad information under rumslig normalisering i dataanalyser på gruppnivå. På denna grundval, kan FT tekniker tillämpas på koncernen var i genomsnitt data för att kvantifiera mått uppgifter enligt definitionen i FT. Dessutom tillämpningen av DTI metoder, det vill säga skillnader i FA-kartorna efter stereotaktisk inriktning, i en longitudinell analys på en individ basis avslöja information om utvecklingen av neurologiska sjukdomar. Ytterligare förbättringar av kvaliteten på DTI-baserade resultat kan erhållas vid förbehandling genom tillämpning av en kontrollerad eliminering av lutning riktningar med höga bullernivåer.
Sammanfattningsvis är DTI används för att definiera en tydlig WM pathoanatomy av olika hjärnsjukdomar genom kombinationen av hela hjärnan-baserade och tarmkanalen-baserade DTI analys.
Introduction
Diffusion tensor imaging i den mänskliga hjärnan
Den vita substansen (WM) skrifter i det centrala nervsystemet består av tätt packade axoner förutom olika typer av neuroglia och andra små populationer av celler. Den axonal membran liksom de väl löpande fiber protein inom en axon begränsar vinkelrät vattendiffusion till fiberorienteringen, vilket leder till anisotropisk vatten diffusion i hjärnan WM 1. Myelinskidor runt axoner kan också bidra till anisotropi för både intra-och extracellulära vatten 2.
Den kvantitativa beskrivningen av denna anisotropi kunde detekteras genom diffusion tensor imaging (DTI). DTI ger bilder av vävnader viktas med de lokala mikrostrukturella egenskaper vatten diffusion. Bilden-intensiteter vid varje position dämpas, beroende på styrkan och riktningen av den så kallade magnetiska diffusionsgradient (representerad ib-värde), såväl som på den lokala mikrostruktur i vilken vattenmolekylerna diffunderar 3, diffusionskoefficienten D, ett skalärt värde:
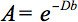
Men i närvaro av anisotropi i WM, kan diffusion inte längre präglas av ett enda skalär koefficient, men kräver en tensor  som i första approximation beskriver molekylär rörlighet längs varje riktning och korrelationen mellan dessa riktningar 4. Diffusion anisotropi orsakas främst av orienteringen av fiberområden i WM och påverkas av sin mikro-och makrostrukturella funktioner. Av de mikrostrukturella egenskaper, förefaller intraaxonal organisation vara av störst betydelse för diffusion anisotropi, förutom densitet fiber ennd cell packning, grad av myelination och enskild fiber diameter. På en makroskopisk skala, påverkar variationen i orienteringen av alla WM skrifter i en avbildning voxeln dess grad av anisotropi 5.
som i första approximation beskriver molekylär rörlighet längs varje riktning och korrelationen mellan dessa riktningar 4. Diffusion anisotropi orsakas främst av orienteringen av fiberområden i WM och påverkas av sin mikro-och makrostrukturella funktioner. Av de mikrostrukturella egenskaper, förefaller intraaxonal organisation vara av störst betydelse för diffusion anisotropi, förutom densitet fiber ennd cell packning, grad av myelination och enskild fiber diameter. På en makroskopisk skala, påverkar variationen i orienteringen av alla WM skrifter i en avbildning voxeln dess grad av anisotropi 5.
I typiska DTI mätningar, voxeln mått är i storleksordningen millimeter. Således innehåller en voxel alltid den genomsnittliga uppgifter av vattenmolekyler inuti detekterade volym som oftast omfattar flera axoner samt omgivande vattenmolekyler. Trots denna flera riktningar miljö är DTI känslig för orienteringen av största huvudaxel som ligger i linje till den dominerande axonal riktning, dvs axonal bidrag dominerar den uppmätta signalen 2.
DTI erbjuder två typer av information om fastigheten för vatten diffusion: första, orientering-oberoende grad av diffusion anisotropi 5 och den andra, den dominerande inriktningen av vatten diffusion i image voxels, dvs diffusion orientering 6.
De nuvarande protokoll är tänkta att ge en ram för DTI analys tekniker för kvantitativ jämförelse av ämnesgrupper på gruppnivå, som beskrivs i det följande.
Kvantifiering av diffusionsegenskaper – analysparametrar
De delar av den symmetriska tensor kan mätas genom diffusions gradienter längs åtminstone sex icke-kolinjära och icke-samma plan riktningar så att b (ekvation 1) har blivit en tensor, vilket resulterar i signaldämpning
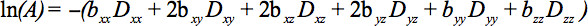
Denna ekvation kräver redovisning av eventuella interaktioner mellan avbildning och gradienter spridning som tillämpas i vinkelräta riktningar (kors termer) och även mellan avbildning gradienter som tillämpasi ortogonala riktningar 4.
Den näst-rank diffusionstensoren  kan alltid diagonaliseras lämnar endast tre icke-noll element utmed huvuddiagonalen av tensor, dvs egenvärdena (
kan alltid diagonaliseras lämnar endast tre icke-noll element utmed huvuddiagonalen av tensor, dvs egenvärdena ( 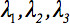 ). Egenvärdena återspegla formen eller konfigurationen av ellipsoiden. Den matematiska förhållandet mellan den huvudsakliga koordinaterna för ellipsoiden och laboratoriet ram beskrivs av egenvektorerna
). Egenvärdena återspegla formen eller konfigurationen av ellipsoiden. Den matematiska förhållandet mellan den huvudsakliga koordinaterna för ellipsoiden och laboratoriet ram beskrivs av egenvektorerna 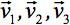
Eftersom det finns flera utmaningar visning tensor uppgifter, har begreppet diffusion ellipsoids föreslagits 3. De Eigendiffusivities av dessa ellipsoids representerar de endimensionella diffusionskoefficienterna i den huvudsakliga inriktningen av diffusiviteter av mediet, dvs huvudaxel ellipsoiden representerar den huvudsakliga diffusion riktning i voxel som sammanfaller med riktningen för fibrerna, medan excentriciteten hos ellipsoiden ger information om grad av anisotropi och dess symmetri. Därför kunde diffusion anisotropi variabler som till exempel fraktionerad anisotropi (FA) definieras 7.
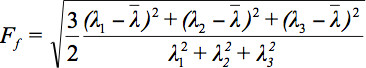
 är det aritmetiska medelvärdet av alla Egenvärden.
är det aritmetiska medelvärdet av alla Egenvärden.
En ytterligare metod är att använda den huvudsakliga inriktningen av diffusionstensoren att ta itu med WM-anslutning av hjärnan, som svarar mot tractography approalm som har för avsikt att undersöka vilka delar av hjärnan är anslutna till varandra. Med antagande av att orienteringen av huvudkomponenten i diffusionstensoren representerar orienteringen av de dominerande axonala skrifter, är en 3-D vektorfältet tillhandahålls där varje vektor representerar fiberorienteringen. För närvarande finns det flera olika metoder för att rekonstruera WM områden som kan delas in i två typer: den första kategorin bygger på algoritmer line förökning med hjälp av lokala tensor för varje steg av fibern tarmkanalen förökning 2,8,9. Den andra kategorin är baserad på global energiminimering att hitta det energimässigt mest gynnsamma vägen mellan två WM regionerna, vilket resulterar i den strategi för tarmkanalen-baserade spatial statistik (TBSS) 10, som har använts i andra algoritmer såsom tractwise fraktionerad anisotropi statistik (TFAs – se protokoll text, avsnitt 2.4)..
Omvandling till stereotaxic stativard utrymme
Liksom i andra avancerade MR metoder, DTI-och FT-baserade studier i ett kliniskt sammanhang fullfölja det slutliga målet att kategorisera enskilda patientens hjärna morfologi för att underlätta den diagnostiska processen baserat på någon diskriminering metric 11. Studier på gruppnivå är mest relevant om den gemensamma kliniska fenotypen är tänkt att vara på grund av skada på ett eller flera specifika områden i hjärnan eller en specifik neuroanatomisk nätverk. Här, i genomsnitt av resultaten för olika ämnen är användbar för att bedöma gemensamma mönster av mikrostrukturella förändringar. Varje enskild hjärna måste överföras till stereotaktisk utrymme så att, i ett andra steg, det aritmetiska medelvärdet av resultaten på en Voxel-för-Voxel nivå är möjlig. Spatial normalisering tillåtet för aritmetisk medelvärdesbildning av de resultat som erhållits från olika ämnen för att förbättra signal-till-brusförhållandet (SNR) och för att göra en jämförelse av prover av patienter och fortsRols för att analysera den beräkningsmässiga pathoanatomy av en specifik störning, t.ex. en neurodegenerativ sjukdom som är associerad med att stödet påverkar ett specifikt hjärnsystemet.
Den tidiga tillvägagångssätt normalisering till en standardiserad stereotaktisk utrymme med 12 föreslog en omvandling algoritm för att en vanlig kartbok innefattar identifikation av olika hjärnan landmärken och styckevis uppskalning av hjärnan kvadranter. Numera är de flesta av de avancerade MRI dataanalys paket använda normalisering till Montreal neurologiska institutet (MNI) stereotaktisk utrymme 13. För denna omvandling var halvautomatiska och automatiska hjärnan registrering algoritmer använder studera specifika mallar utvecklade 14,15. I DTI, har särskild uppmärksamhet dras för att bevara den riktade informationen under normaliseringsprocessen 16,17. Tillämpningen av rumsliga transformationer till DT-MR-bilder som krävs för rumslig normaliseringav samlingar av dataset är, i motsats till bilder skevhet skalära, kompliceras av det faktum att DTs innehåller orienterande informationen som återigen påverkas av transformation. Denna effekt måste redovisas för att säkerställa den anatomiska riktigheten i den transformerade bilden. Här är tekniker för att tillämpa affina transformationer till DTI dataset presenteras.
Tillämpning av DTI till hjärnsjukdomar
Jämförelsen av longitudinella DTI uppgifter krävs en anpassning / registrering av ett föremål data mellan varandra. I detta sammanhang är bevarandet av den riktade information som krävs (dvs. rotation av diffusionstensoren under affina transformationer). Möjliga tillämpningar till neurodegenerativa sjukdomar har rapporterats tidigare (t.ex. 18,19).
DTI har etablerats som en robust non-invasiv tekniska verktyg för att undersöka in vivo Neuropatholnik för WM neuronala skrifter (t.ex. 11,20,21,22). DTI-baserade kvantitativa mått på diffusion process, t.ex. FA, har redan visat sig vara känsliga markörer för att studera ett brett spektrum av WM sjukdomar, såsom stroke 20, multipel skleros 23, amyotrofisk lateralskleros 24, 25, Alzheimers sjukdom 26 , och flera andra WM störningar 27,28.
Dessutom kan DTI med FT användas för att identifiera WM skrifter 23. Denna teknik, men ändå inte i rutinmässig klinisk användning, framstår som ett kraftfullt instrument för bedömning av väg-specifika avvikelser i neurologisk sjukdom. Inom de identifierade områden, olika kvantitativa MRI index härrör från DTI och ytterligare förvärv (t.ex. T2-viktade bilder och / eller magnetiseringsöverföring (MT) imaging) som är anatomiskt coregistered till DTI uppgifterna kunde mätas. Härigenom skulle varje index vara calculpade som en funktion av position inom området, med hänvisning till tomter som skildrar deras rumsliga variation som tarmkanalen profiler.
I det följande humana DTI genomsökningar som utfördes på 1,5 Tesla MR-skannrar (Siemens Medical, Erlangen, Tyskland) användes för att undersöka möjligheterna för olika analystekniker för detektering vita substansen avvikelser i patientgrupper samt hos individer. Efter en automatisk kvalitetskontroll för eliminering av rörelse-korrupta volymer och volymer med andra typer av artefakter, standardiserade efterbearbetningsåtgärder förfaranden förbereda DTI data för rad analys. Olika analyser metoder kommer att belysas i det följande, dvs första, hela hjärnan baserad spatial statistik (WBSS), andra, FT, och tredje, Tractwise fraktionerad statistik anisotropi (TFAs). WBSS är en metod som körs i analogi med Voxel-baserad morfometri (VBM) som brukar kallas voxel-baserad morfometri / statistik på DTI uppgifter (VBM / DTI) <em>. VBM är en metod som ursprungligen körs på kontrastrika bilder där kontrastmedel olikheter i enskilda skanningar måste lösas medan WBSS är en metod som använder voxelwise jämförelse av en fysikalisk parameter. Därför, även algoritmiskt liknande, kommer en terminologi som är att skilja WBSS och VBM användas i det följande.
Protocol
Representative Results
Discussion
Inter-föremål utjämning av DTI data kan uppnås med avseende på diffusion amplitud (genom användning av FA information) och diffusion riktning (baserat på FT), respektive. Medelvärde av FA kartor möjliggör statistisk jämförelse av ämnesgrupper från WBSS och TFAs. Denna metodologiska ramverk ger en introduktion till DTI tekniker med inter-ämne medelvärdesbildning och grupp jämförelse. Stereotaxic normalisering och jämförelse av FA kartor på gruppnivå medger flera möjligheter att kvantifiera skillnad…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Delar av detta arbete, dvs studiet av QC och korrigering för skadade lutning riktningar i ansökan till data från patienter med hyperkinetiska störningar, stöddes av Europeiska HD nätverket (EHDN projekt 070). De MRT i denna viss studie förvärvades som en del av London webbplatsen TRACK-HD kohorten.
Materials
| MR scanner | Siemens 1.5 T Magnetom Symphony | ||
| analysis software | TIFT – Tensor Imaging and Fiber Tracking |
References
- Moseley, M. E., Cohen, Y., et al. Diffusion-weighted MR imaging of anisotropic water diffusion in cat central nervous system. Radiology. 176, 439-445 (1990).
- Mori, S., van Zijl, P. C. M. Fiber tracking: principles and strategies – a technical review. NMR Biomed. 15, 468-480 (2002).
- Basser, P. J., Mattiello, J., LeBihan, D. MR Diffusion Tensor Spectroscopy and Imaging. Biophys J. 66, 259-267 (1994).
- Mattiello, J., Basser, J. P., Le Bihan, D. Analytical expression for the b-matrix in NMR diffusion imaging and spectroscopy. J. Magn. Reson. A. 108, 131-141 (1994).
- Pierpaoli, C., Basser, P. J. Toward a quantitative assessment of diffusion anisotropy. Magn. Reson. Med. 36, 893-906 (1996).
- Pajevic, S., Pierpaoli, C. Color schemes to represent the orientation of anisotropic tissues from diffusion tensor data: application to white matter fiber tract mapping in the human brain. Magn. Reson. Med. 42, 526-540 (1999).
- Le Bihan, D., Mangin, J. F., et al. Diffusion tensor imaging: concepts and applications. J. Magn. Reson. Imaging. 13, 534-546 (2001).
- Conturo, T. E., Lori, N. F., et al. Tracking neuronal fibre pathways in the living human brain. Proc. Natl. Acad. Sci. U.S.A. 96, 10422-10427 (1999).
- Lori, N. F., Akbudak, E. Diffusion tensor fibre tracking of human brain connectivity: aquisition methods, reliability analysis and biological results. NMR Biomed. 15, 494-515 (2002).
- Smith, S. M., Jenkinson, M., et al. Tract-based spatial statistics: voxelwise analysis of multi-subject diffusion data. Neuroimage. 31, 1487-1505 (2006).
- Agosta, F., Pagani, E., et al. Assessment of white matter tract damage in patients with amyotrophic lateral sclerosis: a diffusion tensor MR imaging tractography study. AJNR. Am. J. Neuroradiol. 31, 1457-1461 (2010).
- Talairach, J., Tournoux, P. . Coplanar stereotaxic atlas of the human brain. , (1988).
- Brett, M., Johnsrude, I. S., Owen, A. M. The problem of functional localization in the human brain. Nat. Rev. Neurosci. 3, 243-249 (2002).
- Collins, D. L., Neelin, P., Peters, T. M., Evans, A. C. Automatic 3-D intersubject registration of MR volumetric data in standardized Talairach space. J. Comput. Assist. Tomogr. 18, 192-205 (1994).
- Friston, K. J., Ashburner, J., Frith, C. D., Poline, J. -. B., Heather, J. D., Frackowiak, R. S. J. Spatial registration and normalization of images. Human Brain Mapp. 2, 165-189 (1995).
- Alexander, D. C., Pierpaoli, C., Basser, P. J., Gee, J. C. Spatial transformations of diffusion tensor magnetic resonance images. IEEE Trans. Med. Imaging. 20, 1131-1139 (2001).
- Müller, H. -. P., Unrath, A., Ludolph, A. C., Kassubek, J. Preservation of Diffusion Tensor Properties during Spatial Normalization by use of Tensor imaging and Fiber Tracking on a Normal Brain Database. Phys. Med. Biol. 52, N99-N109 (2007).
- Likitjaroen, Y., Meindl, T., et al. Longitudinal changes of fractional anisotropy in Alzheimer’s disease patients treated with galantamine: a 12-month randomized, placebo-controlled, double-blinded study. Eur. Arch. Psychiatry Clin. Neurosci. 262, 341-350 (2012).
- Zhang, Y., Schuff, N. Progression of white matter degeneration in amyotrophic lateral sclerosis: A diffusion tensor imaging study. Amyotroph. Lateral Scler. 12, 421-429 (2011).
- Pierpaoli, C., Barnett, A. Water diffusion changes in Wallerian degeneration and their dependence on white matter architecture. Neuroimage. 13, 1174-1185 (2001).
- Agosta, F., Valsasina, P., et al. Sensorimotor functional connectivity changes in amyotrophic lateral sclerosis. Cereb Cortex. 21, 2291-2298 (2011).
- Müller, H. -. P., Unrath, A., Huppertz, H. J., Ludolph, A. C., Kassubek, J. Neuroanatomical patterns of cerebral white matter involvement in different motor neuron diseases as studied by diffusion tensor imaging analysis. Amyotroph Lateral Scler. 13, 254-264 (2012).
- Reich, D. S., Zackowski, K. M. Corticospinal tract abnormalities are associated with weakness in multiple sclerosis. Am. J. Neuroradiol. 29, 333-339 (2008).
- Abe, O., Yamada, H. Amyotrophic lateral sclerosis: Diffusion tensor tractography and voxel-based analysis. NMR Biomed. 17, 411-416 (2004).
- Sage, C. A., Peeters, R. R., Gorner, A., Robberecht, W., Sunaert, S. Quantitative diffusion tensor imaging in amyotrophic lateral sclerosis. Neuroimage. 34, 486-499 (2007).
- Preti, M. G., Baglio, F., et al. Assessing corpus callosum changes in Alzheimer’s disease: comparison between tract-based spatial statistics and atlas-based tractography. PLoS One. 7, e35856 (2012).
- Borroni, B., Brambati, S. M., et al. Evidence of white matter changes on diffusion tensor imaging in frontotemporal dementia. Arch. Neurol. 64, 246-251 (2007).
- Unrath, A., Müller, H. -. P., Riecker, A., Ludolph, A. C., Sperfeld, A. D., Kassubek, J. Whole brain-based analysis of regional white matter tract alterations in rare motor neuron diseases by diffusion tensor imaging. Hum Brain Mapp. 31, 1727-1740 (2010).
- Müller, H. -. P., Lulé, D., Unrath, A., Ludolph, A. C., Riecker, A., Kassubek, J. Complementary Image Analysis of Diffusion Tensor Imaging and 3-Dimensional T1-Weighted Imaging: White Matter Analysis in Amyotrophic Lateral Sclerosis. J. Neuroimaging. 21, 24-33 (2011).
- Müller, H. -. P., Unrath, A., Sperfeld, A. D., Ludolph, A. C., Riecker, A., Kassubek, J. Diffusion tensor imaging and tractwise fractional anisotropy statistics: quantitative analysis in white matter pathology. Biomed. Eng. Online. 6, 42 (2007).
- Müller, H. -. P., Unrath, A., Riecker, A., Pinkhardt, E. H., Ludolph, A. C., Kassubek, J. Inter-subject variability in the analysis of diffusion tensor imaging at the group level: fractional anisotropy mapping and fiber tracking techniques. Magn. Reson. Imaging. 27, 324-334 (2009).
- Müller, H. -. P., Glauche, V., et al. Stability of white matter changes related to Huntington’s disease in the presence of imaging noise: a DTI study. PLoS Curr. 3, RRN1232 (2011).
- Müller, H. -. P., Süßmuth, S. D., Landwehrmeyer, G. B., Ludolph, A. C., Tabrizi, S. J., Klöppel, S., Kassubek, J. Stability effects on results of diffusion tensor imaging analysis by reduction of the number of gradient directions due to motion artifacts: an application to presymptomatic Huntington’s disease. PLoS Curr. 3, RRN1292 (2011).
- Shen, Y., Larkman, D. J., Counsell, S., Pu, I. M., Edwards, D., Hajnal, J. V. Correction of High-Order Eddy Current Induced Geometric Distortion in Diffusion-Weighted Echo-Planar images. Magn. Reson. Med. 52, 1184-1189 (2004).
- Ashburner, J., Friston, K. J. Nonlinear Spatial Normalization Using Basis Functions. Human Brain Mapping. 7, 254-266 (1999).
- Jones, D. K., Symms, M. R., Cercignani, M., Howard, R. J. The effect of filter size on VBM analyses of DT-MRI data. Neuroimage. 26, 546-554 (2005).
- Kunimatsu, A., Aoki, S., et al. The optimal trackability threshold of fractional anisotropy for diffusion tensor tractography of the corticospinal tract. Magn. Reson. Med. Sci. 3, 11-17 (2004).
- Genovese, C. R., Lazar, N. A., Nichols, T. Thresholding of statistical maps in functional neuroimaging using the false discovery rate. Neuroimage. 15, 870-878 (2002).
- Cleaver, J. E. Defective repair replication of DNA in xeroderma pigmentosum. Nature. 218, 652-656 (1968).
- Anttinen, A., Koulu, L., et al. Neurological symptoms and natural course of xeroderma pigmentosum. Brain. 131, 1979-1989 (2008).
- Kassubek, J., Sperfeld, A. D. The cerebro-morphological fingerprint of a progeroid syndrome: white matter changes correlate with neurological symptoms in xeroderma pigmentosum. PLoS One. 7, e30926 (2012).
- Canu, E., Agosta, F. The topography of brain microstructural damage in amyotrophic lateral sclerosis assessed using diffusion tensor MR imaging. AJNR. Am. J. Neuroradiol. 32, 1307-1314 (2011).
- Verstraete, E., Veldink, J. H., Hendrikse, J., Schelhaas, H. J., van den Heuvel, M. P., van den Berg, L. H. Structural MRI reveals cortical thinning in amyotrophic lateral sclerosis. J. Neurol. Neurosurg. Psychiatry. 83, 383-388 (2012).
- Hofer, S., Frahm, J. Topography of the human corpus callosum revisited- comprehensive fiber tractography using diffusion tensor magnetic resonance imaging. Neuroimage. 32, 989-994 (2006).
- Iwata, N. K., Kwan, J. Y., et al. White matter alterations differ in primary lateral sclerosis and amyotrophic lateral sclerosis. Brain. 134, 2642-2655 (2011).
- Kassubek, J., Ludolph, A. C., Müller, H. -. P. Neuroimaging of motor neuron diseases. Ther. Adv. Neurol. Disord. 5, 119-127 (2012).
- Kassubek, J., Juengling, F. D. . Multimodality functional neuroimaging. In: C. Stippich (Ed.): Clinical functional MRI – Presurgical functional neuroimaging. , (2007).
- Stadlbauer, A., Buchfelder, M., Salomonowitz, E., Ganslandt, O. Fiber density mapping of gliomas: histopathologic evaluation of a diffusion-tensor imaging data processing method. Radiology. , 257-846 (2010).
- Stadlbauer, A., Hammen, T., et al. Differences in metabolism of fiber tract alterations in gliomas: a combined fiber density mapping and magnetic resonance spectroscopic imaging study. Neurosurgery. 71, 454-463 (2012).
- Staempfli, P., Jaermann, T., Crelier, G. R., Kollias, S., Valavanis, A., Boesiger, P. Resolving fiber crossing using advanced fast marching tractography based on diffusion tensor imaging. Neuroimage. 30, 110-120 (2006).
- Ehricke, H. H., Otto, K. M., Klose, U. Regularization of bending and crossing white matter fibers in MRI Q-ball fields Magn. Reson Imaging. 29, 916-926 (2011).
- Hirsch, J. G., Schwenk, S. M., Rossmanith, C., Hennerici, M. G., Gass, A. Deviations from the diffusion tensor model as revealed by contour plot visualization using high angular resolution diffusion-weighted imaging (HARDI). MAGMA. 16, 93-102 (2003).
- Lazar, M., Weinstein, D. M., et al. White matter tractography using diffusion tensor deflection. Human Brain Mapping. 18, 306-321 (2003).
- Reisert, M., Mader, I., Anastasopoulos, C., Weigel, M., Schnell, S., Kiselev, V. Global fiber reconstruction becomes practical. Neuroimage. 54, 955-962 (2011).
- Klein, A., Andersson, J. Evaluation of 14 nonlinear deformation algorithms applied to human brain MRI registration. Neuroimage. 46, 786-802 (2009).
- Bammer, R. Basic principles of diffusion-weighted imaging. Eur. J. Radiol. 45, 169-184 (2003).
- Mohammadi, S., Keller, S. S. The influence of spatial registration on detection of cerebral asymmetries using voxel-based statistics of fractional anisotropy images and TBSS. PLoS One. 7, e36851 (2012).
- Turner, M. R., Grosskreutz, , et al. Towards a neuroimaging biomarker for amyotrophic lateral sclerosis. Lancet Neurol. 10, 400-403 (2011).
- Müller, H. -. P., Kassubek, J., Enderle, J. D. Multimodal imaging in neurology – special focus on MRI applications and MEG. Synthesis Lectures in Biomedical Engineering. 16, (2008).
- Douaud, G., Filippini, N., Knight, S., Talbot, K., Turner, M. R. Integration of structural and functional magnetic resonance imaging in amyotrophic lateral sclerosis. Brain. 134, 3470-3479 (2011).
- Kolind, S. H., Laule, C., et al. Complementary information from multi-exponential T2 relaxation and diffusion tensor imaging reveals differences between multiple sclerosis lesions. Neuroimage. 40, 77-85 (2008).
- Verma, R., Zacharaki, E. I. Multiparametric tissue characterization of brain neoplasms and their recurrence using pattern classification of MR images. Acad. Radiol. 15, 966-977 (2008).

