<em> Xenopus</emFluorometry साथ> Oocyte कट खुला वैसलीन गैप वोल्टेज दबाना तकनीक
Summary
कट खुला वैसलीन खाई दृष्टिकोण तेज चैनल कैनेटीक्स के उच्च संकल्प के साथ Xenopus oocytes में व्यक्त वोल्टेज पर निर्भर आयन चैनल से आयनिक और gating धाराओं के कम शोर रिकॉर्डिंग प्राप्त करने के लिए प्रयोग किया जाता है. मामूली संशोधन के साथ, वोल्टेज दबाना fluorometry कट खुला oocyte प्रोटोकॉल के लिए युग्मित किया जा सकता है.
Abstract
कट खुला oocyte वैसलीन अंतराल (COVG) वोल्टेज दबाना तकनीक oocytes में heterologous आयन चैनल के electrophysiological और गतिज गुणों के विश्लेषण के लिए अनुमति देता है. कट खुले सेटअप से रिकॉर्डिंग कम परिमाण gating धाराओं, तेजी आयनिक वर्तमान सक्रियण, और क्रियाशीलता छोड़ना हल करने के लिए विशेष रूप से उपयोगी हैं. दो इलेक्ट्रोड वोल्टेज दबाना (TEVC) तकनीक से अधिक मुख्य लाभ में वृद्धि हुई दबाना गति में सुधार के संकेत से शोर अनुपात, और intracellular और बाह्य परिवेश मिलाना करने की क्षमता शामिल है.
यहाँ, हम कट खुले सेटअप और प्रोटोकॉल के साथ ही वोल्टेज दबाना fluorometry क्षमता जोड़ने के लिए आवश्यक हैं कि संशोधनों को प्रदर्शित करने के लिए, (हंै वी 1.5), Xenopus oocytes में व्यक्त मानव हृदय सोडियम चैनल को रोजगार.
ऐसे हंै वी 1.5 के रूप में तेजी से सक्रिय आयन चैनल, गुण, पूरी तरह से जो में, TEVC का उपयोग कर कमरे के तापमान के पास हल नहीं किया जा सकता हैoocyte झिल्ली के घंटे संपूर्णता वोल्टेज नियंत्रण मुश्किल बना clamped है. हालांकि, कट खुला तकनीक में, कोशिका झिल्ली के केवल एक छोटे से हिस्से के अलगाव पैच दबाना तकनीक के साथ जुड़े चैनल चलाने के नीचे रोकने जबकि सही उपवास कैनेटीक्स रिकॉर्ड करने के लिए आवश्यक तेजी से clamping के लिए अनुमति देता है.
COVG तकनीक, आयन चैनल कैनेटीक्स और electrophysiological गुणों के साथ संयोजन के रूप में आगे प्रोटीन गति extracellularly लागू fluorophores, आनुवंशिक रूप से इनकोडिंग फ्लोरोसेंट प्रोटीन की प्रविष्टि, या अप्राकृतिक अमीनो एसिड के समावेश की सिस्टीन विकार के माध्यम से पता लगाया है जहां वोल्टेज दबाना fluorometry, का उपयोग करके assayed किया जा सकता है ब्याज 1 के क्षेत्र में. इस अतिरिक्त डेटा फ्लोरोसेंट अणु आसपास के microenvironment में परिवर्तन के माध्यम से प्रोटीन की वोल्टेज पर निर्भर गठनात्मक rearrangements के बारे में गतिज जानकारी पैदावार.
Introduction
विशिष्ट वोल्टेज clamping तकनीक नियंत्रित झिल्ली क्षमता पर आयनिक धाराओं की रिकॉर्डिंग की अनुमति. व्यापक रूप से दो इलेक्ट्रोड वोल्टेज दबाना (TEVC) का इस्तेमाल किया और पैच दबाना तकनीक कई आयन चैनल के गुणों पर विश्वसनीय electrophysiological जानकारी प्रदान करते हैं. हालांकि, इन तरीकों के दोनों तेज वोल्टेज gated सोडियम चैनल और ऐसे Xenopus oocytes की उन के रूप में झिल्ली में अन्य तेजी से सक्रिय चैनल के लिए विश्वसनीय डेटा के अधिग्रहण को रोकने कि कमियां हैं. Bezanilla और स्टेफनी प्रयोगशालाओं फलस्वरूप oocytes 2 के लिए कट खुला वैसलीन खाई वोल्टेज दबाना तकनीक (COVG) विकसित की है. तकनीक, ना +, + K, और सीए 2 + चैनलों 3-8 रिकॉर्ड करने के लिए व्यापक रूप से लागू किया गया है.
COVG रिकॉर्डिंग के दौरान, एक heterologous प्रोटीन व्यक्त oocyte झिल्ली तीन क्षेत्रों में बांटा गया है. आयनिक मौजूदा डेटा के रूप में oocyte के शीर्ष क्षेत्र से दर्ज की गई हैशीर्ष क्षेत्र के आसपास के स्नान को आसानी से और जल्दी से बदला जा सकता है जो एक आदेश क्षमता, clamped है. मध्य क्षेत्र शीर्ष क्षेत्र 9 के रूप में एक ही क्षमता के लिए clamped किया जा रहा से रिसाव धाराओं के खिलाफ गार्ड. oocyte उद्घाटन (कट) खुला एक सैपोनिन समाधान या एक प्रवेशनी के उपयोग के माध्यम से होता है, जहां नीचे क्षेत्र है. रासायनिक या नीचे क्षेत्र में झिल्ली का मार्गदर्शन उद्घाटन भूमि से जोड़े, जो आंतरिक क्षमता के नियंत्रण की अनुमति देता है, और निचले सदन के समाधान के साथ सेल इंटीरियर सटे renders. शीर्ष चैम्बर में समाधान विनिमय बाहरी परिवेश को बदल देता है, जबकि निचले सदन में समाधान के छिड़काव, आंतरिक वातावरण के गुणों को समायोजित कर सकते हैं. 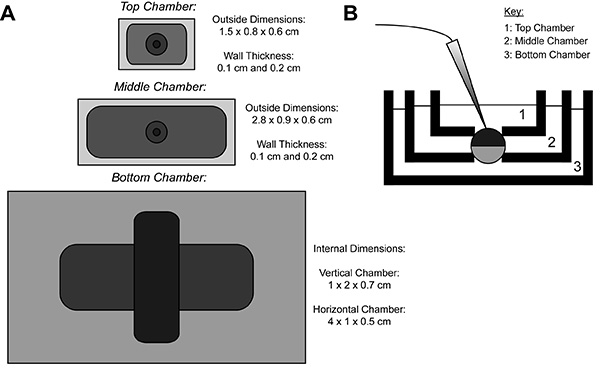
चित्रा 1. Oocyte कट ओपन वोल्टेज दबाना स्नान सेटअप आरेख. (ए) ऊपरएक दूसरे से अलग तीन स्नान के मद्देनजर नीचे. COVG के लिए कक्षों का आयाम चित्रा पर प्रदर्शित कर रहे हैं. (बी) के परीक्षण की स्थिति में स्नान सेटअप के साइड देखें. बड़ी छवि को देखने के लिए यहां क्लिक करें .
COVG तकनीक के फायदे कम मौजूदा शोर (3 kHz पर 1 ना), विदेशी मीडिया की आयनिक रचना, आंतरिक मीडिया, तेजी से समय संकल्प (के क्षय के 20-100 μsec समय लगातार मिलाना करने की क्षमता का नियंत्रण शामिल क्षमता क्षणिक), और कई घंटे 9 के लिए स्थिर रिकॉर्डिंग. नुकसान यह विशेष उपकरणों की आवश्यकता है और यह दो इलेक्ट्रोड वोल्टेज clamping (TEVC) 10 की तुलना में प्रदर्शन करने के लिए और अधिक कठिन है कि कर रहे हैं.
COVG दृष्टिकोण अति विशिष्ट उपकरण और जटिल प्रक्रिया संबंधी तत्वों की आवश्यकता होती है, यह valu के अधिग्रहण के लिए अनुमति दे सकते हैंसक्षम electrophysiological डेटा. इस तरह के उपवास कैनेटीक्स और पूंछ धाराओं के साथ 4 धाराओं gating के रूप में इस डाटा, चैनल चलाने के नीचे सहित अन्य वोल्टेज clamping प्रोटोकॉल के साथ जुड़े मुद्दों में से कुछ के बिना दर्ज किया जा सकता है. COVG सेटअप मामूली संशोधनों के तापमान नियंत्रकों और वोल्टेज दबाना fluorometry (वीसीएफ) के उपयोग के लिए अनुमति दे सकते हैं. COVG विधानसभा के भीतर वोल्टेज दबाना fluorometry तत्वों के शामिल किए जाने के साथ ही साथ वर्तमान 11-13 जबकि रिकॉर्डिंग प्रोटीन गठनात्मक परिवर्तन की निगरानी करने की क्षमता प्रदान करके डेटा उत्पादन बढ़ाने कर सकते हैं.
Protocol
Representative Results
Discussion
कट खुला oocyte वैसलीन खाई वोल्टेज दबाना तकनीक डेटा का तेजी से समाधान के लिए अनुमति देता है, कम शोर, अपेक्षाकृत लंबे प्रोटोकॉल 19 से अधिक आंतरिक समाधान और बाहरी समाधान संरचना पर नियंत्रण, और स्थिर रिकॉर्?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
सभी सेंट लुइस कार्डिएक आण्विक इंजीनियरिंग लैब में वाशिंगटन विश्वविद्यालय के सदस्य हैं. एक Burroughs वैज्ञानिक इंटरफेस पर फंड कैरियर पुरस्कार में आपका स्वागत है – 1010299 (जे एस के लिए).
Materials
| External Solution | Brand | Catalog Number | [Final], weight, or volume |
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 25mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 90mM |
| HEPES | Research Products International | H75030 | 20mM |
| Calcium hydroxide | Sigma-Aldrich | 239232 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Internal Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 105mM |
| MES Sodium Salt | Sigma-Aldrich | M5057 | 10mM |
| HEPES | Research Products International | H75030 | 20mM |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N',N'-tetraacetic acid (EGTA) | Sigma-Aldrich | E4378 | 2mM |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Depolarizing Solution | |||
| KCl | Sigma-Aldrich | 221473 | 110mM |
| Magnesium chloride | Sigma-Aldrich | M8266 | 1.5mM |
| Calcium Chloride | Caisson | C021 | 0.8mM |
| HEPES | Research Products International | H75030 | 10mM |
| Pipet Solution | |||
| KCl | Sigma-Aldrich | 221473 | 3M |
| Saponin Solution | |||
| Saponin | Sigma-Aldrich | 47036 | 0.125g |
| Internal Solution | See above | 50mL | |
| Agar Bridge Solution | |||
| N-methyl-D-glucamine (NMDG) | Sigma-Aldrich | M2004 | 100ml of 1M |
| HEPES | Research Products International | H75030 | 1.2g |
| MES Hydrate | Sigma-Aldrich | M8250 | variable (pH to 7.4) |
| Granulated Agar | Research Products International | A20250 | 3% |
| NMDG Storage Solution | |||
| NMDG, HEPES, MES Hydrate solution | see above | 40ml | |
| Water | 60ml | ||
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| High Performance Oocyte Clamp | Dagan | CA-1B | |
| Data Acquisition System | Axon CNS | Digidata 1440A | |
| Oscilloscope | Tektronix | TDS 210 | |
| Rack Power Filter | APC | G5 | |
| Heating/Cooling Bath Temperature Controller | Dagan | HCC-100A | |
| PC | Dell | Optiplex 990 | |
| pCLAMP 10.3 Voltage Clamp Software | Molecular Devices, LLC | pCLAMP10.3 | |
| TMC Vibration Control TableTop Platform | TMC | 64 SERIES | |
| TMC Vibration Control Air Table | TMC | 20 Series | |
| V1/I Electrode Data Collector | Dagan | part of CA-1B | |
| MX10L Micromanipulator | Siskiyou | MX10L | |
| Bath/Guard (I/V) Headstage (with appropriate connectors) | Dagan | part of CA-1B | |
| Microscope | Omano | OM2300S-JW11 | |
| Temperature Control Bath | Custom or Dagan | Custom or HE-204C | Custom chamber made from materials from Cool Polymers (D-series). Dagan also provides a prefeabricated stage (HE-204C). |
| Custom AgCl Pellet Container | Custom | Custom | Custom machined |
| Ag/AgCl electrode, pellet, 2.0 mm | Warner | E-206 | |
| External Oocyte Bath | Custom or Dagan | Custom or CC-1-T-LB | Custom machined or purchased from Dagan |
| Internal Oocyte Bath | Custom or Dagan | Custom or CC-TG-ND | Custom machined or purchased from Dagan |
| Capillaries for Agar Bridges and Pulled Electrodes | Warner | G150T-4 | |
| Rotatable Mounts for the Microscope, Micromanipulator, and Bath | Siskiyou | SD-1280P | |
| Fiber-Lite | Dolan-Jenner | LMI-600 | |
| Regular Bleach | Clorox | 470174-764 | |
| Xenopus laevis Oocytes | Nasco | LM535M (sexually mature females) | |
| 90 Na+ External Solution | See Solutions sheet | ||
| 10 Na+ Internal Solution | See Solutions sheet | ||
| 3 M KCL | See Solutions sheet | ||
| Saponin | Sigma-Aldrich | 47036 | |
| NMDG Storage Solution | See Solutions sheet | ||
| 5mL transfer pipets | SciMart | GS-52 | |
| Modified KCl electrode injector | BD | 309659 | Plastic syringe tip melted to allow for injection of solution into electrodes. Alternatively, a Microfil by WPI can be purchased. |
| Microvaccum | Custom | Custom | |
| Forceps | VWR | 63040-458 | |
| Oocyte Handling Tools (Pipette Pump) | VWR | 53502-222 | |
| Deionized Water Squirt Bottle | VWR | 16649-911 | |
| Vaseline Petroleum Jelly | Fisher Scientific | 19-086-291 | |
| Additional Materials Required for VCF Recordings: | |||
| VCF Microscope | Nikon | Eclipse FN1 | |
| Nikon CFI APO 40XW NIR Objective | Nikon | N40X-NIR | |
| X-Y Translator System for Fixed-Stage Upright Microscopes | Sutter Instruments | MT500-586 | |
| External VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 2.7 x 1.9 x 0.4 cm. | |
| Internal VCF Oocyte Bath | Custom | Custom machined. The chamber dimensions are 1.6 x 1.6 x 0.4 cm. | |
| Modified Temperature Control Bath | Custom | Custom chamber made from materials from Cool Polymers (D-series). The chamber dimensions of the modified temperature controller bath are 2.7 x 1.9 x 0.3 cm for the horizontal chamber, and 1 x 2.5 x 0.5 cm for the vertical chamber. |
References
- Kalstrup, T., Blunck, R. Dynamics of internal pore opening in KV channels probed by a fluorescent unnatural amino acid. Proc. Natl. Acad. Sci. U.S.A. 110, 8272-8277 (2013).
- Stefani, E., Bezanilla, F. Cut-open oocyte voltage-clamp technique. Methods Enzymol. 293, 300-318 (1998).
- Muroi, Y., Chanda, B. Local anesthetics disrupt energetic coupling between the voltage-sensing segments of a sodium channel. J. Gen. Physiol. 133, 1-15 (2009).
- Stefani, E., Toro, L., Perozo, E., Bezanilla, F. Gating of Shaker K+ channels: I. Ionic and gating currents. Biophys. J. 66, 996-1010 (1994).
- Wang, S., Liu, S., Morales, M. J., Strauss, H. C., Rasmusson, R. L. A quantitative analysis of the activation and inactivation kinetics of HERG expressed in Xenopus oocytes. J. Physiolt. 502 (Pt 1), 45-60 (1997).
- Neely, A., Garcia-Olivares, J., Voswinkel, S., Horstkott, H., Hidalgo, P. Folding of active calcium channel beta(1b) -subunit by size-exclusion chromatography and its role on channel function. J. Biol. Chem. 279, 21689-21694 (2004).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels I: wild-type skeletal muscle. Na(V)1.4. J. Gen. Physiol. 141, 309-321 (2013).
- Silva, J. R., Goldstein, S. A. Voltage-sensor movements describe slow inactivation of voltage-gated sodium channels II: a periodic paralysis mutation in Na(V)1.4 (L689I). J. Gen. Physiol. 141, 323-334 (2013).
- Taglialatela, M., Toro, L., Stefani, E. Novel voltage clamp to record small, fast currents from ion channels expressed in Xenopus oocytes. Biophys. J. 61, 78-82 (1992).
- Clare, J. J., Trezise, D. J. . Expression and analysis of recombinant ion channels : from structural studies to pharmacological screening. , (2006).
- Cha, A., Zerangue, N., Kavanaugh, M., Bezanilla, F., Susan, G. A. . Methods in enzymology. 296, 566-578 (1998).
- Lakowicz, J. R. . Principles of fluorescence spectroscopy. 3rd edn. , (2006).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19, 1127-1140 (1997).
- Richards, R., Dempski, R. E. Examining the conformational dynamics of membrane proteins in situ with site-directed fluorescence labeling. J. Vis. Exp. , (2011).
- Cohen, S., Au, S., Pante, N. Microinjection of Xenopus laevis oocytes. J. Vis. Exp. , (2009).
- Raynauld, J. P., Laviolette, J. R. The silver-silver chloride electrode: a possible generator of offset voltages and currents. J. Neurosci. Methods. 19, 249-255 (1987).
- Gagnon, D. G., Bissonnette, P., Lapointe, J. Y. Identification of a disulfide bridge linking the fourth and the seventh extracellular loops of the Na+/glucose cotransporter. J. Gen. Physiol. 127, 145-158 (2006).
- Pantazis, A., Olcese, R., Roberts, G. . Cut-Open Oocyte Voltage-Clamp Technique. In: Roberts G. (Ed.) Encyclopedia of Biophysics: SpringerReference. , (2013).

