Hot biologisk katalys: Isotermiska Titrering Calorimetry för att karaktärisera enzymatiska reaktioner
Summary
Isotermisk titrering kalorimetri åtgärder värmeflöde frigörs eller absorberas i kemiska reaktioner. Denna metod kan användas för att kvantifiera enzym-katalys. I detta dokument, protokoll för instrumentella inställning, experimentera kör, och dataanalys beskrivs generellt och tillämpas på karakterisering av enzymatisk urea hydrolys av jack böna ureas.
Abstract
Isotermisk titrering kalorimetri (ITC) är en väl beskriven teknik som mäter den värme som frigörs eller absorberas under en kemisk reaktion, använder den som en inneboende sond för att karakterisera praktiskt taget varje kemisk process. Numera är denna teknik i stor utsträckning tillämpas för att bestämma termodynamiska parametrar för biomolekylära bindnings jämvikter. Dessutom har ITC visat sig kunna på direkt mätning av kinetik och termodynamiska parametrar (k katt, K M, Ah) av enzymatiska reaktioner, trots att denna ansökan är fortfarande underutnyttjade. Som värme förändringar sker spontant under enzymatisk katalys, kräver ITC inte kräver någon ändring eller märkning av det system som analyseras och kan utföras i lösning. Dessutom behöver metoden lilla mängd material. Dessa egenskaper gör ITC en ovärderlig, kraftfullt och unikt verktyg för att studera enzymkinetik i flera tillämpningar, såsom, till exempel, läkemedelsutveckling.
<p class = "jove_content"> I detta arbete en experimentell ITC-baserad metod för att kvantifiera kinetik och termodynamik för enzymatiska reaktioner är noggrant beskrivet. Metoden används för att bestämma k katt och K M för enzymatisk hydrolys av urea genom Canavalia ensiformis (jack böna) ureas. Beräkning av inneboende molära entalpin (AH int) av reaktionen utförs. De sålunda erhållna värdena överensstämmer med tidigare data som rapporteras i litteraturen, vilket visar tillförlitligheten hos metoden.Introduction
Kvantitativ bestämning av biokemiska reaktioner ger insikter i de biologiska processer på grundval av livet. Kalorimetri erbjuder en etikett-fri metod för att kvantitativt karakterisera faktiskt varje kemisk reaktion i lösning. Denna teknik mäter den värme som frigörs eller absorberas över tiden, och är därför en universell detekteringssystemet och en mycket bekväm metod för att kvantifiera mängden av reagerande molekyler (dvs. bindningstermodynamik), såväl som för att mäta reaktionshastigheten (dvs. kinetik). Framför allt har isotermisk titrering kalorimetri (ITC) antagits som metod för valet att karakterisera termodynamik av biomolekylära jämvikter, involverar protein-ligand, protein-protein, joner protein-metall och protein-DNA interaktioner 1-6. Dessutom gör möjligheten för ITC att ge kinetisk information den ett mycket kraftfullt system för att mäta enzymkatalys, även om potentialen i denna ansökan är fortfarandeskattade 7-9.
Michaelis-Menten-ekvationen 10 är en kvantitativ beskrivning av enzymatiska reaktioner, eftersom det ger ett förhållande mellan reaktionshastigheten och substratkoncentrationen, beroende på två kinetiska parametrar: Michaelis konstant (K M) och den katalytiska hastighetskonstant (kcat) . Den kcat / M-förhållandet är kallad den katalytiska effektiviteten hos ett enzym. I praktiken kan bestämningen av K M och kcat för en specifik reaktion ger en fullständig beskrivning av katalys.
I en typisk enzymreaktion (fig 1), ett substrat (S) interagerar med enzymet (E), som bildar den enzymsubstrat (ES)-komplexet, som därefter aktiveras till övergångstillståndet (ES *). Den sistnämnda omvandlas till den enzymprodukt (EP)-komplex som så småningom dissocierar. Dessa stegs är beskrivna med följande reaktion.
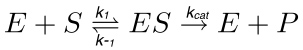 (1)
(1)
där k 1 är hastighetskonstanten för bildningen av ES-komplex, k -1 är hastighetskonstanten för dissociation av ES-komplex, medan kcat är den katalytiska hastighetskonstanten eller omsättningstalet.
Enligt Michaelis-Menten-ekvationen 10, kan reaktionshastigheten beräknas enligt följande:
 (2)
(2)
där K M = (k -1 + kcat) / k 1 och kcat = vmax / [E], med v max är den maximala hastigheten uppnås när alla enzym är bundet till substratet.
Den isotermiska titrering kalorimetern är det instrument som används i denna studie för att karaktärisera den enzymatiska hydrolysen av urea. Detta instrument är gjort av en adiabatisk skärm innehållande två präglade formade celler (figur 1). Dessa är anslutna till utsidan med smala accessrören. Provcellen (ca. 1,4 ml) laddas med enzymlösningen, medan referenscellen är i allmänhet fyllda med vatten eller med lösningsmedlet som används för analysen. En roterande spruta med lång nål och en omrörnings paddel fastsatt, som vanligen innehåller ca. 0,3 ml substratlösning, är monterad på provcellen. En termoelektrisk enhet mäter skillnaden i temperatur mellan provet och referenscellen och, med hjälp av en "återkopplingscellnätverk" hävdat denna skillnad på noll genom att lägga till eller dra ifrån värmen. Under experimentet är substratet sprutas in i enzymlösning vid en konstant vald temperatur. När enzymatic reaktion sker, den mängd värme som frigörs eller absorberas är proportionell mot det antal substratmolekyler som omvandlas till produktmolekyler. Dessutom är graden av värmeflöde direkt relaterad till reaktionshastigheten. De uppmätta data, som förekommer som en avvikelse av värme spår från första baslinjen (figur 1), representerar den termiska effekten (μcal / sek) som levereras av instrumentet till provcellen, som är proportionell mot värmeflödet förekommer i provcellen över tiden.

Figur 1. Schematisk representation av isoterm titrering kalorimeter för att studera enzymatiska reaktioner. En enzymatisk reaktion som inträffar vid titrering av substratet (i injektionssprutan) i enzymlösning (i provcellen) resulterar i en förändring av thermal ström släpptes av kalorimetern, som behövs för att hålla skillnaden i temperatur mellan provcellen och referenscellen konstant. Klicka här för att visa en större bild.
Totalt sett är det värmeförändringen (Q) som är proportionell mot den molära entalpin för reaktionen (AH) och antalet moler av produkt genereras (n), som i sin tur ges av den totala volymen gånger koncentrationen:
 (3)
(3)
Den produktbildning över tiden (dP / dt), vilket motsvarar den reaktionshastighet, kan således vara relaterat till den mängd värme som alstras under samma tid (dQ / dt) genom förhållandet:
 (4)
(4)
Enligt denna ekvation, för att få en Michaelis-Menten rita det är nödvändigt att mäta i) Den totala molära entalpi AH, och ii) värmeflödet dQ / dt vid olika substratkoncentrationer. Vanligtvis utförs detta i två olika experiment: i det första experimentet (Metod 1, M1) är substratet sprutas in i enzymlösning och värmen för fullständig substratomvandling mäts; I det andra experimentet (metod 2, M2), finns flera injektioner av substratet utförs och hastigheten för värmeproduktionen mäts vid olika substratkoncentrationer. Dessa två uppsättningar av data som är tillräcklig för att härleda de kinetiska parametrarna K ^ och kcat.
I denna artikel, är ett generellt protokoll för att bestämma de kinetiska parametrarna för enzymatiska reaktioner som utförs med hjälp av ITC beskrivs. Vi tillämpade metoden att urea hydrolys av Canavalia ensiformis ureaSE, som referenssystem. Den god överensstämmelse mellan de erhållna med denna metod resultat och de uppgifter som rapporteras i litteraturen visar tillförlitligheten i denna strategi.
Protocol
Representative Results
Discussion
Betydelsen av ITC att studera enzymatisk aktivitet med avseende på befintliga metoder
Utöver sin klassiska program för att studera bindande jämvikter, ger isotermisk titrering kalorimetri en tillförlitlig och snabb metod för att karakterisera enzymatiska reaktioner i lösning med hjälp av reaktionsvärmen som en sond, utan att kräva system för modifiering eller märkning. De kinetiska parametrarna kcat och K M erhålls vanlige…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Den specialgödnings Produkter Företag (SFP) är känd för att tillhandahålla de medel som behövs för denna studie.
Materials
| HEPES | Sigma | H3375 | dissolving in water and adjusting pH with NaOH |
| TRIZMA-Base | Sigma | T1503 | dissolving in water and adjusting pH with HCl |
| Sodium dihydrogen phosphate | Riedel-de-Haen | 4270 | dissolving in water |
| Sodium phosphate dibasic | Riedel-de-Haen | 30427 | dissolving in water |
| Urea | Sigma | U4128 | dissolving in water at 40 °C |
| Canavalia ensiformis urease (type C-3) | Sigma | U0251 | dissolving in 20 mM HEPES pH 7 and stored at -80 °C |
| VP-ITC on Origin 7.0 | MicroCal (GE Healthcare) | SYS13901 | instrument |
| VPViewer2000 1.30.00 on Origin 7.0 | MicroCal (GE Healthcare) | data acquisition software supplied with the instrument |
References
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr. Opin. Struct. Biol. 11, 560-566 (2001).
- Ladbury, J. E. Application of isothermal titration calorimetry in the biological sciences: things are heating up! BioTechniques. 37, 885-887 (2004).
- Zambelli, B., Bellucci, M., Danielli, A., Scarlato, V., Ciurli, S. The Ni2+ binding properties of Helicobacter pylori NikR. Chem. Commun. , 3649-3651 (2007).
- Zambelli, B., et al. High-affinity Ni2+ binding selectively promotes binding of Helicobacter pylori NikR to its target urease promoter. J. Mol. Biol. 383, 1129-1143 (2008).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J. Vis. Exp. , (2011).
- Ghai, R., Falconer, R. J., Collins, B. M. Applications of isothermal titration calorimetry in pure and applied research–survey of the literature from 2010. J. Mol. Recognit. 25, 32-52 (2012).
- Todd, M. J., Gomez, J. Enzyme kinetics determined using calorimetry: a general assay for enzyme activity. Anal. Biochem. 296, 179-187 (2001).
- Bianconi, M. L. Calorimetry of enzyme-catalyzed reactions. Biophys. Chem. 126, 59-64 (2007).
- Demarse, N. A., Killian, M. C., Hansen, L. D., Quinn, C. F. Determining enzyme kinetics via isothermal titration calorimetry. Methods Mol. Biol. 978, 21-30 (2013).
- Michaelis, L., Menten, M. Die kinetik der invertinwirkung. Biochem. Z. 49, 333-369 (1913).
- Walker, J., Wilson, K., Walker, J. . Principle and techniques of practical biochemistry. , 312-356 (2000).
- Ciurli, S., Sigel, A., Sigel, H., Sigel, R. K. O. . Nickel and its surprising impact in nature. 2, 241-278 (2007).
- Zambelli, B., Musiani, F., Benini, S., Ciurli, S. Chemistry of Ni2+ in urease: sensing, trafficking, and catalysis. Acc. Chem. Res. 44, 520-530 (2011).
- Zonia, L. E., Stebbins, N. E., Polacco, J. C. Essential role of urease in germination of nitrogen-limited Arabidopsis thaliana seeds. Plant Physiol. 107, 1097-1103 (1995).
- Follmer, C. Insights into the role and structure of plant ureases. Phytochemistry. 69, 18-28 (2008).
- Sumner, J. B. The isolation and crystallization of the enzyme urease. J. Biol. Chem. 69, 435-441 (1926).
- Krajewska, B. Ureases I. Functional, catalytic and kinetic properties: A review. J. Mol. Cat. B. 59, 9-21 (2009).
- Callahan, B. P., Yuan, Y., Wolfenden, R. The burden borne by urease. J. Am. Chem. Soc. 127, 10828-10829 (2005).
- Krajewska, B., van Eldik, R., Brindell, M. Temperature- and pressure-dependent stopped-flow kinetic studies of jack bean urease. Implications for the catalytic mechanism. J. Biol. Inorg. Chem. 17, 1123-1134 (2012).
- Hausinger, R. P., Karplus, P. A., Huber, R., Poulos, T., Wieghardt, K. . Handbook of Metalloproteins. , 867-879 (2001).
- Goldberg, R., Kishore, N., Lennen, R. Thermodynamic quantities for the ionization reactions of buffers. J. Phys. Chem. Ref. Data. 31, 231-370 (2002).
- Baumann, M. J., et al. Advantages of isothermal titration calorimetry for xylanase kinetics in comparison to chemical-reducing-end assays. Anal. Biochem. 410, 19-26 (2011).
- Noske, R., Cornelius, F., Clarke, R. J. Investigation of the enzymatic activity of the Na+,K+-ATPase via isothermal titration microcalorimetry. Biochim. Biophys. Acta. 1797, 1540-1545 (2010).
- Harmon, K. M., Niemann, C. The competitive inhibition of the urease-catalyzed hydrolysis of urea by phosphate. J. Biol. Chem. 177, 601-605 (1949).
- Benini, S., Rypniewski, W. R., Wilson, K. S., Ciurli, S., Mangani, S. Structure-based rationalization of urease inhibition by phosphate: novel insights into the enzyme mechanism. J. Biol. Inorg. Chem. 6, 778-790 (2001).
- Segel, I. H. . Enzyme kinetics: behavior and analysis of rapid equilibrium and steady-state enzyme systems. , (1993).

