Флуоресценции изображений с Один-нм Точность (Fiona)
Summary
Холост флуорофоры могут быть локализованы с нанометровой точностью, используя Фиона. Вот краткое изложение методики FIONA Сообщается, и как проводить Фиона эксперименты описывается.
Abstract
Флуоресценции изображений с точностью один-нанометровом (Fiona) является простой, но полезный метод для локализации одиночных флуорофоры с нанометровой точностью в плоскости ху. Вот краткое изложение методики FIONA Сообщается и примеры исследований, которые были проведены с использованием Фиона кратко описаны. Во-первых, как настроить необходимое оборудование для Фиона экспериментов, то есть полное внутреннее отражение флуоресценции микроскопии (TIRFM), с подробной информацией о совместив оптику, описывается. Тогда, как провести простой эксперимент Фиона по локализации иммобилизованных Cy3-ДНК одиночных молекул с использованием соответствующих протоколов, а затем с помощью ФИОНЫ для измерения 36 нм размер шага одной усеченной миозина Va двигателя с надписью с квантовой точки, иллюстрируется. Наконец, сообщается недавняя попытка распространить применение Фионы в толстых образцах. Показано, что, используя погружением в воду цели и квантовые точки замачивают в глубине золь-гелей и кролик глазных роговиц (>200 мкм), точность локализации 2-3 нм может быть достигнуто.
Introduction
Вокруг 1882, Эрнст Аббе установлено, что разрешение на видном светового микроскопа ~ λ / 2NA, или ~ 200 нм (где λ длина волны и Н.А. является числовая апертура) 1,2. Поэтому любой объект меньше, чем этого измерения будет отображаться как дифракционной месте в оптическом микроскопе. Тем не менее, можно определить центр на месте, то есть местоположение объекта, с гораздо более высокой точностью 3. Флуоресценции изображений с точностью один-нанометровом (Fiona) является простой, но полезный метод для локализации одиночных флуорофоры с нанометровой точностью в плоскости 4. Точность локализации, σ μ (то есть, стандартная ошибка среднего), зависит от общего количества собранных фотонов, 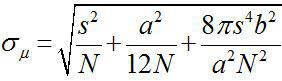 , Где N является количество фотонов, с стандартное отклонение флуоресцентного месте, эторазмер пикселя детектора изображения, и б является стандартное отклонение фоне 3,4. Для флуорофором излучающей ~ 10000 фотоны, ФИОНА может достичь ~ 1 нм точность 4.
, Где N является количество фотонов, с стандартное отклонение флуоресцентного месте, эторазмер пикселя детектора изображения, и б является стандартное отклонение фоне 3,4. Для флуорофором излучающей ~ 10000 фотоны, ФИОНА может достичь ~ 1 нм точность 4.
ФИОНА может быть использован для точного определения положения стационарного излучателя или движущегося один (при условии, изображения могут быть приняты достаточно быстро). ФИОНА может быть применен последовательно в рамках фильма и, таким образом отслеживать движение одной молекулы 4- 8. Фото-защитная реагенты могут быть необходимы для того, чтобы образец не этого разрушению. Кроме того, сама по себе флуоресцентный объект может быть любого размера, меньше или больше, чем дифракционные ограничения, например, он может состоять из органелл (~ 1 мкм) с множеством флуоресцентных белков, диспергированных на ее мембране. Использование ФИОНА еще может дать очень точную (нанометровой) среднем его средней центра масс. Значительное улучшение в точности локализации Фионой позволяет определить nanomeтер Массовое перемещение во времени. Это подтолкнуло микроскопии в молекулярном масштабе длины 4 8.
С момента своего изобретения, варианты ФИОНЫ были разработаны. Например, ярко-поле изображения с точностью один-нанометровом (bFIONA) 9, небольшой варианта Фиона, изображений и локализует плотные объекты, такие как Меланосомы естественных условиях (темных объектов, содержащих пигмент меланин) в с проходящем свете. Кроме того, ФИОНА был принят на работу, чтобы решить несколько красителей. Например, одной молекулы с высоким разрешением изображения с фотообесцвечивания (креветки) 10,11 или одной молекулы с высоким разрешением колокализация (SHREC) 12 были разработаны для решения двух красителей в течение примерно 10 нм. (Заметим, что это разрешение, то есть насколько точно можно сказать, одинаковые красители друг от друга.) Совсем недавно, анализ ФИОНА внесла свой вклад в процесс локализации определенного сверхвысокого разрешения микроскопии, такие как стохастический оптического RECOnstruction микроскопии (ШТОРМОВАЯ) 13-15 и фото-активированный локализации микроскопии (Palm) 16, в котором временные темные флуорофоров возбуждены, а затем флуоресценции локализован. При повторном захватывающей довольно низкой плотности красителей (менее одного дифракционного предела спот), и затем сбора флуоресценции, анализируя каждый из них по Фиона, можно построить в высоком разрешении карту. Резолюция затем просто ограничивается числом фотонов друг краситель звук производится, а также вещей, как хранение образца в неподвижном (в том числе, например, микроскоп) при приобретении.
В этой статье, краткое изложение методики FIONA и кратко описать примеры исследований, которые были выполнены с помощью ФИОНА сообщается. Во-первых, как настроить необходимое оборудование для Фиона экспериментов, то есть полное внутреннее отражение флуоресценции микроскопии (TIRFM), с подробной информацией о совместив оптику, описывается. Тогда, какпровести простой эксперимент Фиона по локализации иммобилизованных Cy3-ДНК одиночных молекул с использованием соответствующих протоколов, иллюстрируется. После этого, использование ФИОНЫ для измерения 36 нм размер шага одной усеченной миозина Va двигателя с надписью с квантовой точки представлена. Миозин Va является важным processive двигателя белок, который осуществляет сотовой груз во время транслокации вдоль нитей актина. Здесь миозина Va построить усеченный используется для удаления доменов не имеющие отношения к размером шага, и с флагом тег добавлен в С-конца, чтобы позволить легкость маркировки с квантовыми точками функционализированными Anti-Flag антител. Этот эксперимент проводится при низкой АТФ замедлить миозин и позволяют использовать достаточно длинных выдержках, чтобы получить хороший счета фотонов в каждом кадре. Любая достаточно ярким флуоресцентную метку можно заменить следующим протоколом. Наконец, сообщается последнее усилие расширения сферы применения ФИОНЫ к толстых образцов. Как доказательство-о-принципе, квантовые точки были пропитаныв Соль-гелей и кролик глазных роговиц, а затем в образ и локализованы с помощью Фиона. Для визуализации, погружения цель 60X вода с NA = 1.2 был использован, потому что эта цель имеет больше рабочее расстояние, чем ранее использовавшийся 100X иммерсионным объективом. Чтобы компенсировать потери в увеличении в цели, экстра-увеличение объектива (3.3x или 4.0X) был вставлен в пути излучения. Кроме того, эпи-флуоресцентный (не МДП) микроскопии должен быть использован для доступа глубокие участки в толстых образцов. Показано, что квантовые точки, смоченные в глубине золь-гелей и в глаз кролика роговицы (Z> 200 мкм) можно локализовать с 2-3 точностью нм.
Protocol
Representative Results
Discussion
ФИОНА это техника локализовать положение флуоресцентного излучателя (органического флуорофором или квантовой точки) с нанометровой точностью и временным разрешением до 1 мс 4 8. Когда достаточное количество фотонов собирают, этот метод позволяет определить положение флуоресцен…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Работа выполнена при поддержке грантов НИЗ 068625, NSF грантов 1063188 и центра физике живых клеток 0822613. Особая благодарность доктору Марина Марьянович в Beckman Института передовой науки и технологии за дар глаз кролика.
Materials
| Name of Material/ Equipment | Company | Catalog Number | Comments/Description |
| Double-sided tape | 3M | — | ~ 75 um thick |
| EMCCD camera | Andor Technology | DU-897E-CS0-#BV | |
| Ultrasonic cleaner | Branson | 2510 | |
| Fluorescence filter set | Chroma | 49016 | |
| Actin polymerization buffer | Cytoskeleton | BSA02 | |
| Biotin G-actin | Cytoskeleton | AB07 | |
| G-actin | Cytoskeleton | AKL95 | |
| General actin buffer | Cytoskeleton | BSA01 | |
| Laser shutter (with driver) | Electro-Optical Products Corp. | SH-10-MP | |
| IDL | Exelis Visual Information Solutions | — | |
| Neutravidin | Fisher Scientific | PI-31000 | |
| Coverslip | Fisherbrand | 22X30-1.5 | 0.16-0.19 mm thick |
| Microscope slide | Gold Seal Microslides | 30103X1 | 0.93-1.05 mm thick |
| Plasma cleaner | Harrick Plasma | PDC-001 | |
| Glass bottom dish | In Vitro Scientific | D35-20-1.5-N | |
| Cy3-DNA oligos | Integrated DNA Technologies | — | 5'-Cy3/GCCTCGCTGCCGTCGCCA-3'Bio |
| Fluorescent beads | Invitrogen | T-7280 | |
| Qdot 605-streptavidin | Invitrogen | Q10101MP | |
| Qdot605 | Invitrogen | Q21301MP | |
| Qdot705 | Invitrogen | Q22021MP | |
| Qdot705 Antibody Conjugation Kit | Invitrogen | Q22061MP | |
| Matlab | MathWorks | — | |
| Optical table | Newport Corp | — | RS4000 Series |
| 60X Objective | Nikon | Plan Apo VC 60x WI | |
| 100X Objective | Olympus | PlanApo 100X/1.45 Oil ∞/0.17 | |
| 60X Objective | Olympus | UPlanApo 60X/1.20W | |
| Inverted microscope | Olympus | IX71/IX70/IX81 | |
| Origin | OriginLab | — | |
| Anti-FLAG antibody | Sigma Aldrich | F7425-.2MG | |
| ATP | Sigma Aldrich | A7699 | |
| BME | Sigma Aldrich | 63689-25ML-F | |
| BSA | Sigma Aldrich | A7906 | |
| BSA-biotin | Sigma Aldrich | A8549-10MG | |
| CK | Sigma Aldrich | C3755 | Creatine Phosphokinase from rabbit muscle |
| CP | Sigma Aldrich | P1937 | Phosphocreatine di(tris) salt |
| DTT | Sigma Aldrich | 43815 | DL-Dithiothreitol |
| EGTA | Sigma Aldrich | E3889 | Ethylene glycol-bis(2-aminoethylether)-N,N,N′,N′-tetraacetic acid |
| HCl | Sigma Aldrich | 93363-500G | |
| HEPES | Sigma Aldrich | H0887 | |
| KCl | Sigma Aldrich | P9333 | |
| MgCl2 | Sigma Aldrich | M1028 | |
| NaCl | Sigma Aldrich | S7653 | |
| PCA | Sigma Aldrich | 03930590 | Protocatechuic acid |
| PCD | Sigma Aldrich | P8279 | Protocatechuate-3,4-dioxygenase |
| TMOS | Sigma Aldrich | 341436-25G | Tetramethyl orthosilicate |
| Tris-HCl | Sigma Aldrich | 93363 | |
| Trolox | Sigma Aldrich | 238813 | 6-hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid |
| 1” diameter broadband dielectric mirrors with mounts | Thorlabs | BB1-E02, KM100 | Quantity: 2 |
| ½” diameter posts | Thorlabs | TR4 | Quantity ≥ 6 |
| 10x beam expander | Thorlabs | BE10M-A | |
| 2” diameter broadband dielectric mirrors with mounts | Thorlabs | BB2-E02, KM200 | Quantity: 2 |
| 2” diameter f = 300 mm lens with mount | Thorlabs | LA1256-A, LMR2 | TIR lens |
| Fluorescent alignment target | Thorlabs | VRC2SM1 | |
| Laser safety goggles | Thorlabs | LG3 | |
| ND filter(s) | Thorlabs | FW1AND | |
| Optical beam profiler | Thorlabs | BP209-VIS | |
| Post-mounted iris diaphragm | Thorlabs | ID25 | Quantity: 2 |
| Shearing interferometer | Thorlabs | SI100 | |
| XYZ translation stage, ½” travel | Thorlabs | T12XYZ | |
| Laser | World Star Technologies | TECGL-30 | 532 nm, 30 mW |
References
- Abbe, E. The Relation of Aperture and Power in the Microscope. Journal of the Royal Microscopical Society. 2 (3), 300-309 (1882).
- Abbe, E. The Relation of Aperture and Power in the Microscope (continued). Journal of the Royal Microscopical Society. 2 (4), 460-473 (1882).
- Thompson, R. Precise Nanometer Localization Analysis for Individual Fluorescent Probes. Biophysical Journal. 82 (5), 2775-2783 (2002).
- Yildiz, A., et al. Myosin V Walks Hand-Over-Hand: Single Fluorophore Imaging with 1.5-nm Localization. Science. 300 (5628), 2061-2065 (2003).
- Yildiz, A., Tomishige, M., Vale, R. D., Selvin, P. R. Kinesin Walks Hand-Over-Hand. Science. 303 (5658), 676-678 (2004).
- Yildiz, A., et al. Myosin VI Steps via a Hand-over-Hand Mechanism with Its Lever Arm Undergoing Fluctuations when Attached to Actin. Journal of Biological Chemistry. 279 (36), 37223-37226 (2004).
- Yildiz, A., Selvin, P. R. Fluorescence Imaging with One Nanometer Accuracy: Application to Molecular Motors. Accounts of Chemical Research. 38 (7), 574-582 (2005).
- Toprak, E., Yildiz, A., Hoffman, M. T., Rosenfeld, S. S., Selvin, P. R. Why kinesin is so processive. Proceedings of the National Academy of Sciences. 106 (31), (2009).
- Kural, C., et al. Tracking melanosomes inside a cell to study molecular motors and their interaction. Proceedings of the National Academy of Sciences. 104 (13), 5378-5382 (2007).
- Gordon, M. P., Ha, T., Selvin, P. R. Single-molecule high-resolution imaging with photobleaching. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6462-6465 (2004).
- Qu, X., Wu, D., Mets, L., Scherer, N. F. Nanometer-localized multiple single-molecule fluorescence microscopy. Proceedings of the National Academy of Sciences of the United States of America. 101 (31), 11298-11303 (2004).
- Churchman, L. S., Ökten, Z., Rock, R. S., Dawson, J. F., Spudich, J. A. Single molecule high-resolution colocalization of Cy3 and Cy5 attached to macromolecules measures intramolecular distances through time. Proceedings of the National Academy of Sciences of the United States of America. 102 (5), 1419-1423 (2005).
- Huang, B., Wang, W., Bates, M., Zhuang, X. Three-Dimensional Super-Resolution Imaging by Stochastic Optical Reconstruction Microscopy. Science. 319 (5864), 810-813 (2008).
- Rust, M. J., Bates, M., Zhuang, X. Sub-diffraction-limit imaging by stochastic optical reconstruction microscopy (STORM). Nat Meth. 3 (10), 793-796 (2006).
- Bates, M., Huang, B., Dempsey, G. T., Zhuang, X. Multicolor Super-Resolution Imaging with Photo-Switchable Fluorescent Probes. Science. 317 (5845), 1749-1753 (2007).
- Betzig, E., et al. Imaging Intracellular Fluorescent Proteins at Nanometer Resolution. Science. 313 (5793), 1642-1645 (2006).
- Abramoff, M. D., Magalhães, P. J., Ram, S. J. Image processing with ImageJ. Biophotonics international. 11 (7), 36-42 (2004).
- Enderlein, J., Toprak, E., Selvin, P. R. Polarization effect on position accuracy of fluorophore localization. Optics Express. 14 (18), 8111-8120 (2006).
- Cheezum, M. K., Walker, W. F., Guilford, W. H. Quantitative comparison of algorithms for tracking single fluorescent particles. Biophysical Journal. 81 (4), 2378-2388 (2001).
- Rasnik, I., McKinney, S. A., Ha, T. Nonblinking and long-lasting single-molecule fluorescence imaging. Nature Methods. 3 (11), 891-893 (2006).
- Zhuang, X., et al. A Single-Molecule Study of RNA Catalysis and Folding. Science. 288 (5473), 2048-2051 (2000).
- Aitken, C. E., Marshall, R. A., Puglisi, J. D. An Oxygen Scavenging System for Improvement of Dye Stability in Single-Molecule Fluorescence Experiments. Biophysical Journal. 94 (5), 1826-1835 (2008).

