Ex Situ Normothermique machine perfusion de foies de donneurs
Summary
Nous présentons ici un protocole décrivant ex situ oxygénée machine à perfusion de greffes de foie donateurs. Cet article contient une étape par étape protocole de se procurer et de préparer la greffe du foie pour la machine perfusion, préparer le liquide de perfusion, amorcer la machine à perfusion et d'effectuer oxygénée normothermique machine à perfusion de la greffe de foie.
Abstract
Contrairement à la conservation à froid statique conventionnelle (0-4 ° C), ex situ machine à perfusion peut fournir une meilleure préservation des foies de donneurs. Perfusion continue d'organes offre la possibilité d'améliorer la qualité des organes et permet ex situ évaluation de la viabilité des foies de donneurs avant la transplantation. Cet article vidéo fournit une étape de protocole d'étape pour ex situ de perfusion de la machine normothermique (37 ° C) de foies de donneurs humains en utilisant un dispositif qui fournit une pression et une température contrôlée irrigation sanguine pulsatoire de l'artère hépatique et la perfusion en continu de la veine porte. Le fluide de perfusion est oxygéné par deux creux oxygénateurs à membrane de fibres et la température peut être réglée entre 10 ° C et 37 ° C. Au cours de la perfusion, l'activité métabolique du foie, ainsi que le degré de lésion peut être évaluée par l'analyse biochimique des échantillons prélevés dans le liquide de perfusion. Machine de perfusion est un outil très prometteurà augmenter le nombre de foies qui sont appropriés pour la transplantation.
Introduction
La méthode actuelle de préservation d'organe dans la transplantation du foie est à débusquer avec et le stockage ultérieur des foies de donneurs dans le froid (0-4 ° C) liquide de conservation (tels que l'Université du Wisconsin solution ou une solution d'histidine-tryptophane-Ketoglutarate). Cette méthode est appelée stockage à froid statique (SCS). Bien que le taux métabolique de foies à 0-4 ° C est très faible, il existe toujours une demande pour / min / g de tissu hépatique 0,27 pmol d'oxygène, qui ne peut être assurée pendant SCS 1. La méthode classique de SCS, par conséquent, entraîne un certain degré de blessure (supplémentaire) de foies de donneurs. Bien que ce montant de blessure de conservation est pas un problème dans le foie des donateurs de bonne qualité, il peut devenir un facteur critique et la limitation dans le foie sous-optimales qui ont déjà subi un certain degré de blessure chez le donneur. Pour cette raison, les foies avec une qualité optimale ou critères dits prolongée donateurs (DPE) foies sont souvent rejetées pour la transplantation comme o des risquesf échec de la greffe précoce est considéré comme trop élevé. Les taux élevés de la fonction du greffon retardée, non-fonction primaire, et de sténoses biliaires non anastomotiques (NAS) ont été décrits chez les receveurs de foies de don après le décès circulatoire (DCD), les donateurs âgés ou les bénéficiaires de greffes stéatosiques 2. NAS sont une cause majeure de morbidité et de mortalité après transplantation hépatique. NAS peut se produire dans les deux conduits biliaires extra donateurs et intra-hépatiques et peut être accompagnée de boue biliaire intracanalaire et la formation de fonte 3,4. Bien que l'étiologie de NAS est considérée comme multifactorielle, une lésion d'ischémie / reperfusion des voies biliaires cours de la conservation du greffon et de la transplantation a été identifié comme un important mécanisme sous-jacent de 2,5. Transplantation d'un greffon DCD a été identifié comme l'un des plus importants facteurs de risque pour le développement de NAS. La combinaison d'une période d'ischémie chaude chez un donneur DCD, ischémie froide pendant la conservation d'organes, et la reperfusion ultérieureblessures chez le receveur est pensé pour être responsable de lésions irréversibles des voies biliaires, qui, en combinaison avec une capacité de régénération pauvre des voies biliaires, entraîne des cicatrices fibreuses et le rétrécissement des voies biliaires après transplantation hépatique 2,5. NAS ont été rapportés chez 30% des patients recevant un foie DCD 6-8. Il est devenu clair que la méthode actuelle de SCS des greffes de foie pour la transplantation est insuffisante pour les foies de DPE preinjured telles que celles provenant de donneurs DCD. Les méthodes alternatives sont nécessaires pour accroître et optimiser l'utilisation des foies de DPE pour la transplantation.
perfusion de la machine (MP) est une méthode de conservation d'organes qui peuvent fournir une meilleure préservation de donneurs d'organes, par rapport à SCS. MP pourrait être particulièrement pertinent pour la préservation des greffons de DPE. Un avantage important de MP est la possibilité de fournir de l'oxygène pour la greffe au cours de la période de conservation. MP peut être réalisé à différentes températures,qui ont été classés comme hypothermique (0-10 ° C), subnormothermic (10-36 ° C) et normothermique (36-37 ° C) député (NMP). En fonction de la température utilisée pour le MP, le type de liquide de perfusion doit être ajusté et avec l'augmentation de température de plus de l'oxygène doit être fourni. La première application clinique de MP dans la transplantation de foie humain a été basée sur la perfusion d'hypothermie sans oxygénation active de la 9,10 de fluide de perfusion. Dans les modèles animaux, député oxygénée hypothermique (0-10 ° C) a été montré pour avoir des effets protecteurs contre les lésions d'ischémie / reperfusion du foie greffe 11 et de fournir une meilleure préservation du plexus vasculaire péribiliaire des voies biliaires 12. Subnormothermic MP oxygénée à 20 ° C ou 30 ° C a également été étudié dans des modèles animaux et a été montré précédemment pour fournir la récupération de la fonction du greffon de foie DCD, par rapport à 13,14 SCS. La faisabilité de subnormothermic MP oxygéné des foies humains était recremment rapporté dans une série de sept foies de donneurs humains jetés 15. NMP (37 ° C) permet l'évaluation de la viabilité du greffon et la fonctionnalité avant la transplantation 16,17. En outre, MP permet de réchauffement graduel de la greffe du foie avant la transplantation, ce qui a été démontré pour faciliter la récupération et la réanimation de la greffe 18.
Le dispositif de perfusion utilisé dans le protocole actuel pour perfusion hépatique appareil permet perfusion double (par l'intermédiaire de la veine porte et l'artère hépatique) au moyen de deux pompes centrifuges, qui fournissent un flux continu de portail et un flux pulsatile artérielle. Le système est commandé par la pression, ce qui permet l'auto-régulation de l'écoulement à travers le foie, en fonction de la résistance intrahépatique. Deux creux oxygénateurs à membrane à fibres permettent l'oxygénation de la greffe du foie, ainsi que pour l'élimination de CO 2. La température peut être réglée sur la base du type d'utilisation envisagé MP (de temperat minimum ure de 10 ° C). Débit, la pression et la température sont affichées sur le dispositif en temps réel, permettant un contrôle continu du processus de perfusion. Un nouvel ensemble jetable stérile de tubes, réservoir et oxygénateurs est disponible pour la perfusion de chaque greffon (Figure 1).
Le but de cet article de la vidéo est de prévoir une étape par étape du protocole ex situ pour machine à normothermique perfusion de foies de donneurs humains en utilisant cet appareil de perfusion de foie de conception nouvelle.
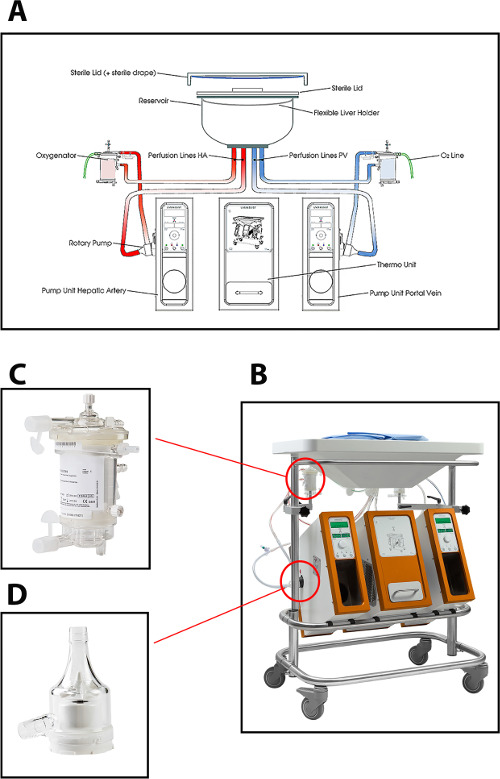
Figure 1: (A) Un dessin schématique, (B) une photo de la machine de perfusion, (C) une vue rapprochée de l'oxygénateur, et (D) de la pompe centrifuge utilisée pour perfusion normothermique de foies de donneurs humains.obtenir = "_ blank"> S'il vous plaît cliquez ici pour voir une version plus grande de cette figure.
Protocol
Representative Results
Discussion
Cette vidéo fournit une étape par étape pour protocole de la machine normothermique perfusion de foies de donneurs humains en utilisant un dispositif qui permet contrôlée double pression de perfusion dans l'artère et la veine porte hépatique. En suivant ce protocole, les défaillances techniques de la machine de perfusion n'a pas eu lieu et tous les greffes étaient bien perfusé et bien oxygénée. Les foies perfuses ex situ ont hémodynamique étaient stables et métaboliquement actif, tel que …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Ce travail de recherche a été soutenue financièrement par des subventions fournies par Innovatief Actieprogramma Groningen (IAG-3), Jan De Cock Kornelis Stichting et Tekke Huizingafonds, le tout dans les Pays-Bas. Nous sommes reconnaissants à tous les coordinateurs de transplantation néerlandais pour identifier les potentiels jeté foies et obtention du consentement éclairé.
Materials
| Liver Assist | Organ Assist | OA.Li.Li.140 | Perfusion device |
| Liver Assist disposable package | Organ Assist | OA.Li.DP.540 | Disposable set and cannulas |
| Meredith No.8 | Vygon Nederlands B.V. | 1362082 | Bile duct cannula |
| Human albumin 200g/l / ALBUMAN | Sanquin | 15522598 | 100 ml |
| Modified parenteral nutrition | Baxter Nederland B.V. | N14G30E | 7.35 ml |
| Multivitamins for infusion / CERNEVIT | Baxter International Inc. | 9800927 | 7 ul |
| Concentrated trace elements for infusion / NUTRITRACE | B. Braun Melsungen AG | 14811332 | 7.35 ml |
| Metronidazole 5mg/ml | Baxter Nederland B.V. | 98181882 | 40 ml |
| Cefazoline / SERVAZOLIN | Sandoz B.V. | 15611337 | 2 ml |
| Fast acting insulin | various vendors | 20 ml | |
| Calcium glubionate, intravenous solution 10%, 137.5 mg/mL | Sandoz | 97038695 | 40 ml |
| Sterile H2O | Fresenius Kabi Nederland B.V. | 98084453 | 51.3 ml |
| NaCl 0.9% | Baxter Nederland B.V. | 15262510 | 160 ml |
| Heparin 5000 IE/ml for i.v. administration | LEO Pharma B.V. | 98026178 | 4 ml |
| Sodium bicarbonate 8,4% | B. Braun Melsungen AG | 97973874 | The amount depends on the pH |
| Packed red blood cell (in SAGM) | Blood bank (Sanquin) | N0012000 | 750 ml |
| Fresh frozen plasma | Blood bank (Sanquin) | N04030A0/N04030B0 | 900 ml |
References
- Plaats, A., et al. Hypothermic machine preservation in liver transplantation revisited: Concepts and criteria in the new millennium. Ann. Biomed. Eng. 32 (4), 623-631 (2004).
- op den Dries, S., Sutton, M. E., Lisman, Y., Porte, R. J. Protection of bile ducts in liver transplantation: Looking beyond ischemia. Transplantation. 92 (4), 373-379 (2011).
- Seehofer, D., Eurich, D., Veltzke-Schlieker, W., Neuhaus, P. Biliary complications after liver transplantation: Old problems and new challenges. Am. J. Transplant. 13 (2), 253-265 (2013).
- Buis, C. I., et al. Nonanastomotic biliary strictures after liver transplantation, part 1: Radiological features and risk factors for early vs. late presentation. Liver. Transpl. 13 (5), 708-718 (2007).
- Karimian, N., op den Dries, S., Porte, R. J. The origin of biliary strictures after liver transplantation: Is it the amount of epithelial injury or insufficient regeneration that counts. J. Hepatol. 58 (6), 1065-1067 (2013).
- Gastaca, M. Biliary complications after orthotopic liver transplantation: A review of incidence and risk factors. Transplant. Proc. 44 (6), 1545-1549 (2012).
- Sanchez-Urdazpal, L., et al. Ischemic-type biliary complications after orthotopic liver transplantation. Hepatology. 16 (1), 49-53 (1992).
- Dubbeld, J., et al. Similar liver transplantation survival with selected cardiac death donors and brain death donors. Br. J. Surg. 97 (5), 744-753 (2010).
- Guarrera, J. V., et al. Hypothermic machine preservation in human liver transplantation: The first clinical series. Am. J. Transplant. 10 (2), 372-381 (2010).
- Henry, S. D., et al. Hypothermic machine preservation reduces molecular markers of ischemia/reperfusion injury in human liver transplantation. Am. J. Transplant. 12 (9), 2477-2486 (2012).
- Schlegel, A., Rougemont, O., Graf, R., Clavien, P. A., Dutkowski, P. Protective mechanisms of end-ischemic cold machine perfusion in DCD liver grafts. J. Hepatol. 58 (2), 278-286 (2013).
- op den Dries, S., et al. Hypothermic oxygenated machine perfusion prevents arteriolonecrosis of the peribiliary plexus in pig livers donated after circulatory death. PLoS. One. 9 (2), e88521 (2014).
- Tolboom, H., et al. Subnormothermic machine perfusion at both 20 degrees C and 30 degrees C recovers ischemic rat livers for successful transplantation. J. Surg. Res. 175 (1), 149-156 (2012).
- Gringeri, E., et al. Subnormothermic machine perfusion for non-heart-beating donor liver grafts preservation in a swine model: A new strategy to increase the donor pool? Transplant. Proc. 44 (7), 2026-2028 (2012).
- Bruinsma, B. G., et al. Subnormothermic machine perfusion for ex vivo preservation and recovery of the human liver for transplantation. Am. J. Transplant. 14 (6), 1400-1409 (2014).
- op den Dries, S., et al. Ex vivo normothermic machine perfusion and viability testing of discarded human donor livers. Am. J. Transplant. 13 (5), 1327-1335 (2013).
- Sutton, M. E., et al. Criteria for viability assessment of discarded human donor livers during ex vivo normothermic machine perfusion. PLoS. One. 9 (11), (2014).
- Minor, T., Efferz, P., Fox, M., Wohlschlaeger, J., Luer, B. Controlled oxygenated rewarming of cold stored liver grafts by thermally graduated machine perfusion prior to reperfusion. Am. J. Transplant. 13 (6), 1450-1460 (2013).
- Makowka, L., et al. Surgical technique of orthotopic liver transplantation. Gastroenterol. Clin. North. Am. 17 (1), 33-51 (1988).
- Hansen, T., et al. Histological examination and evaluation of donor bile ducts received during orthotopic liver transplantation–a morphological clue to ischemic-type biliary lesion?. Virchows Arch. 461 (1), 41-48 (2012).
- Monbaliu, D., Brassil, J. Machine perfusion of the liver: Past, present and future. Curr. Opin. Organ. Transplant. 15 (2), 160-166 (2010).
- Oldani, G., et al. Pre-retrieval reperfusion decreases cancer recurrence after rat ischemic liver graft transplantation. J. Hepatol. 61 (2), 278-285 (2014).
- Tromans, D. Temperature and pressure dependent solubility of oxygen in water: A thermodynamic analysis. Hydrometallurgy. 48 (3), 327-342 (1998).

