Твердые липидов Наночастицы (SLNS) для внутриклеточного Ориентация Приложения
Summary
In this study, a method for synthesizing ultra-small populations of biocompatible nanoparticles was described, as well as several in vitro methods by which to assess their cellular interactions.
Abstract
Nanoparticle-based delivery vehicles have shown great promise for intracellular targeting applications, providing a mechanism to specifically alter cellular signaling and gene expression. In a previous investigation, the synthesis of ultra-small solid lipid nanoparticles (SLNs) for topical drug delivery and biomarker detection applications was demonstrated. SLNs are a well-studied example of a nanoparticle delivery system that has emerged as a promising drug delivery vehicle. In this study, SLNs were loaded with a fluorescent dye and used as a model to investigate particle-cell interactions. The phase inversion temperature (PIT) method was used for the synthesis of ultra-small populations of biocompatible nanoparticles. A 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylphenyltetrazolium bromide (MTT) assay was utilized in order to establish appropriate dosing levels prior to the nanoparticle-cell interaction studies. Furthermore, primary human dermal fibroblasts and mouse dendritic cells were exposed to dye-loaded SLN over time and the interactions with respect to toxicity and particle uptake were characterized using fluorescence microscopy and flow cytometry. This study demonstrated that ultra-small SLNs, as a nanoparticle delivery system, are suitable for intracellular targeting of different cell types.
Introduction
Средств его доставки на основе наночастиц показали большие перспективы для внутриклеточных нацеленных приложений, обеспечивая механизм специально изменить сотовой сигнализации и экспрессию генов. Эти транспортные средства могут быть загружены с препаратами, белков и нуклеиновых кислот, предназначенных для воздействия клеточных ответов и достичь желаемого эффекта в тканях-мишенях. Многие типы наноносителей были исследованы на терапевтического и диагностического пользу в том числе липидов, полимеров, кремний и магнитных материалов. Эти системы являются привлекательными из-за их потенциала для локализованной доставки лекарств, повышения терапевтической концентрации в тканях-мишенях, и снижение системной токсичности.
Твердые липидные наночастицы (SLNS) являются хорошо изученным примером системы доставки наночастиц, которая возникла в качестве перспективного средства доставки лекарственных в последние годы. SLNS может быть легко сформулированы для нескольких приложений, включая био-зондирования 1, 2, косметики и тЛечебно доставка 3-7. Их полезность проистекает из того факта, что они полностью состоит из рассасывающихся, нетоксичных липидов, что приводит к усилению биосовместимости. Во время синтеза, липофильных лекарственных средств могут быть включены в SLn транспортных средств, тем самым увеличивая растворимость лекарственного и пригодность для парентерального введения. SLN транспортные средства также помогают стабилизировать инкапсулированные терапии, уменьшая их деградации и оформление, и максимизации терапевтического действия. Эти транспортные средства, особенно хорошо подходит для длительного действия с контролируемым высвобождением препаратов из-за их стабильности при температуре тела 3,4,8,9. Важно отметить, что инкапсуляция наркотиков в липидных наночастиц изменяет внутренние Фармакокинетические профили молекул наркотиков. Это обеспечивает потенциальное преимущество, позволяя контролируемое высвобождение лекарств с узким терапевтическим индексом. Скорость высвобождения SLn-терапии включены могут быть настроены на основе скорости деградации липидов или скорости диффузии лекарственного средства влипидов матрица.
SLNS часто инженерии накапливаться в тканях-мишенях конкретных. Например, их размер (как правило, больше, чем 10 нм) потенцирует удержание в обращении, где вытекающей сосудистая опухолевой ткани облегчает осаждение. Кроме того, путь введения частиц, как было показано изменить биораспределение с потенциалом для решения конкретных физиологических структур, таких как лимфатические узлы 10,11. По отложения в тканях-мишенях, достижения соответствующих клеточных взаимодействий и возможной интернализации наночастиц является сложной задачей из-за способности клеточных мембран для селективного управления потоком ионов и молекул в и из клетки 12. Для облегчения клеточное поглощение, можно изменить наноносителей с специфическими лигандами, включая пептиды, небольшие молекулы, и моноклональных антител 13,14. Некоторые механизмы, включая как пассивного проникновения и активного транспорта наночастицчерез клеточную мембрану были описаны ранее 3,12,15. В общем, было продемонстрировано, что клетки-наночастиц взаимодействия зависит от физико-химических свойств наночастиц в том числе размер, форма, поверхностный заряд и поверхностной химии, в дополнение к параметрам соты, таких как тип клеток или фазе клеточного цикла 12.
Предыдущая исследования показали, синтез суб-10 нм SLNS для местного и 16 биомаркеров приложений обнаружения 1 с использованием метода 17 температура обращения фаз (PIT). Это нежный метод синтеза, где 2 композиция остается постоянной, пока температура постепенно изменяется. Непрерывное перемешивание нагретого раствора, при охлаждении результатам RT в наноэмульсии. Этот процесс приводит к синтезу SLNS с меньшим размером частиц, чем 1 сообщалось ранее, используя различные методы синтеза липидов нанoparticles 17-22. Полученную фактический размер менее 20 нм, обеспечивает преимущество для нацеливания внутриклеточных применения благодаря увеличенной площади поверхности и возможности для обеспечения клеточных взаимодействий.
Схема SLNS, предназначен для доставки флуоресцентного красителя или терапевтического, показан на рисунке 1. В SLNS состоят из липидов внутреннего (например, линейные алканов), что позволяет включение липофильных соединений (например, красителей или терапевтических) и поверхностно-активного вещества внешней (например, линейные неионное ПАВ) окружен водой. В этом исследовании, были загружены SLNS флуоресцентным красителем и использовали в качестве модели для исследования частиц клеточных взаимодействий. Первичные фибробласты кожи человека и мыши дендритные клетки подвергали воздействию красителя загружены SLN с течением времени для того, чтобы охарактеризовать взаимодействие по отношению к токсичности и поглощение частиц. 3- (4,5-диметилтиазол-2-ил) -2,5-diphenylphenyltetrazolium бромид (МТТ) был Utiliзет, чтобы установить соответствующие уровни дозировки. Флуоресцентная микроскопия и проточной цитометрии было два методы, используемые для изучения поглощения частиц в пробирке.
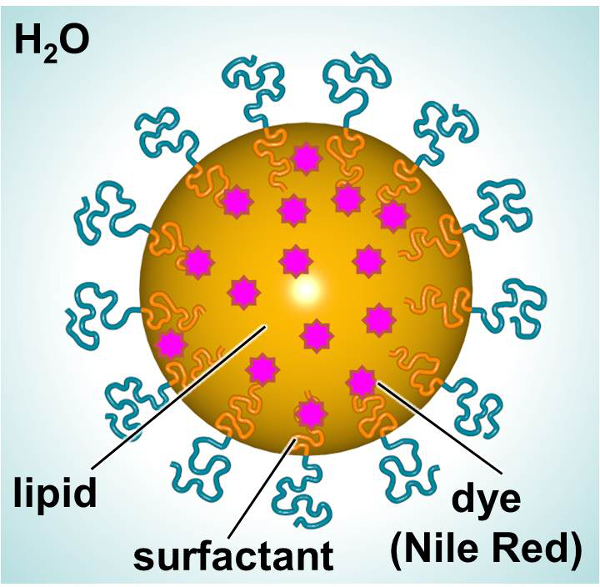
Рисунок 1. Схема СЛН показывающую основные компоненты. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
Protocol
Representative Results
Discussion
В этом исследовании, синтез SLNS и их применимость для внутриклеточных нацеленных приложений были изучены. Эти наночастицы биосовместимые показали обещание как средства доставки для нескольких приложений, включая поставки наркотиков, сайленсинга, вакцин и технологий 25-30. Крохотн…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Research reported in this publication was supported by The Johns Hopkins Applied Physics Laboratory’s Research and Exploratory Development Department, Office of Technology Transfer, and Stuart S. Janney Fellowship Program, in addition to the National Heart, Lung, and Blood Institute of the National Institutes of Health under Award Number R21HL127355.
Materials
| Nile Red (NiR) | Sigma | 19123 | BioReagent, suitable for fluorescence, ≥98.0% |
| Heneicosane | Aldrich | 286052 | 98% |
| Brij O10 | Sigma | P6136 | Brij 97, C18-1E10, Polyoxyethylene (10) oleyl ether |
| Water | Sigma | W3500 | Sterile-filtered, BioReagent, suitable for cell culture |
| Syringe Filter 0.2 µm Supor Membrane Low Protein Binding | Life Sciences | PN4612 | Non-Pyrogenic |
| Nanotrac Ultra | Microtrac | serial number U1985IS | Instrument |
| Differential Scanning Calorimeter | Mettlet-Toledo | —- | Instument |
| Primary human fibroblasts | Life Technologies | C-004-5C | Neonatal (HDFn) |
| Medium 106 | Life Technologies | M-106-500 | A sterile, liquid medium for the culture of human dermal fibroblasts. |
| Low Serum Growth Supplement Kit (LSGS Kit) | Life Technologies | S-003-K | All the components of complete LSGS |
| MTT Cell Proliferation Assay Kit | Trevigen | 4890-025-K | Sensitive kit for the measurement of cell proliferation based upon the reduction of the tetrazolium salt, 3,[4,5-dimethylthiazol-2- yl]-2,5-diphenyl-tetrazolium bromide (MTT) |
| Safire2 microplate reader | Tecan | —- | Instrument |
| Phosphate buffered saline | Sigma | P5493 | For molecular biology |
| Recombinant murine GM-CSF | R&D Systems | 415 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
| Recombinant murine IL-4 | R&D Systems | 404 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
References
- Calderon-Colon, X., et al. Synthesis of sub-10 nm solid lipid nanoparticles for topical and biomarker detection applications. J Nanopart Res. 16 (2252), 1-10 (2014).
- Patwekar, S., et al. Review on nanoparticles used in cosmetics and dermal products. World Journal of Pharmacy and Pharmaceutical Sciences. 3 (8), 1407-1421 (2014).
- Martins, S., et al. Solid lipid nanoparticles as intracellular drug transporters: An investigation of the uptake mechanism and pathway. International Journal of Pharmaceutics. 430, 216-227 (2012).
- Yadav, N., Khatak, S., Sara, U. V. S. Solid Lipid Nanoparticles – A Review. International Journal of Applied Pharmaceuticals. 5 (2), 8-18 (2013).
- Weber, S., Zimmer, A., Solid Pardeike, J. Lipid Nanoparticles (SLN) and Nanostructured Lipid Carriers (NLC) for pulmonary application: a review of the state of the art. Eur J Pharm Biopharm. 86 (1), 7-22 (2014).
- Mahajan, A., Kaur, S., Grewal, N. K., Kaur, S. Solid Lipd Nanoparticles (SLNs) – As Novel Lipd based Nanocarriers for Drugs. International Journal of Advanced Research. 2 (1), 433-441 (2014).
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Malam, Y., Loizidou, M., Seifalian, A. M. Liposomes and nanoparticles: nanosized vehicles for drug delivery in cancer. Trends Pharmacol Sci. 30 (11), 592-599 (2009).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers. Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Ali Khan, A., Mudassir, J., Mohtar, N., Darwis, Y. Advanced drug delivery to the lymphatic system: lipid-based nanoformulations. International journal of nanomedicine. 8, 2733-2744 (2013).
- Oussoren, C., Storm, G. Liposomes to target the lymphatics by subcutaneous administration. Advanced drug delivery reviews. 50, 143-156 (2001).
- Shang, L., Nienhaus, K., Nienhaus, G. U. Engineered nanoparticles interacting with cells: size matters. J Nanobiotechnology. 12, 5 (2014).
- Joshi, M. D., Muller, R. H. Lipid nanoparticles for parenteral delivery of actives. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e.V. 71, 161-172 (2009).
- Torchilin, V. P. Micellar nanocarriers: pharmaceutical perspectives. Pharmaceutical research. 24, 1-16 (2007).
- Ashley, C. E., et al. The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers. Nature materials. 10, 389-397 (2011).
- Patchan, M., et al. Nanotech; Nanotechnology 2013: Bio Sensors Instruments, Medical, Environment and Energy; Chapter 3: Materials for Dru., and Gene Delivery. Nanobandage for controlled release of topical therapeutics. 3, 255-258 (2013).
- Forgiarini, A., Esquena, J., Gonzalez, C., C, S., Koutsoukos, P. Formation and stability of nano-emulsions in mixed nonionic surfactant systems. Trends in colloid and interface science XV. Progress in Colloid and Polymer Science. 118, 184-189 (2001).
- Nantarat, T., Chansakaow, S., Leelapornpisid, P. Optimization, characterization and stability of essential oils blend loaded nanoemulsions by PIC technique for anti-tyrosinase activity. International Journal of Pharmacy and Pharmaceutical Sciences. 7, 308-312 (2015).
- Sevcikova, P., Vltavska, P., Kasparkova, V., Formation Krejci, J. Characterization and Stability of Nanoemulsions Prepared by Phase Inversion. , 132-137 (2011).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C., Buckin, V. Studies of the relation between phase behavior and emulsification methods with nanoemulsion formation. Trends in colloid and interface science XIV. Progress in Colloid and Polymer Science. 115, 36-39 (2000).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C. Formation of nano-emulsions by low-energy emulsification methods at constant temperature. Langmuir. 17 (7), 2076-2083 (2001).
- Cabone, C., Tomasello, B., Ruozi, B., Renis, M., Puglisi, G. Preparation and optimization of PIT solid lipid nanoparticles via statistical factorial design. Eur J Med Chem. 49, 110-117 (2012).
- Raimondi, G., et al. Mammalian Target of Rapamycin Inhibition and Alloantigen-Specific Regulatory T Cells Synergize To Promote Long-Term Graft Survival in Immunocompetent Recipients. J Immunol. 184, 624-636 (2010).
- Jhunjhunwala, S., Raimondi, G., Thomson, A. W., Little, S. R. Delivery of rapamycin to dendritic cells using degradable microparticles. J Control Release. 133 (13), 191-197 (2009).
- Kapse-Mistry, S., Govender, T., Srivastava, R., Yergeri, M. Nanodrug delivery in reversing multidrug resistance in cancer cells.. Front Pharmacol. 5 (159), 1-22 (2014).
- Musacchio, T., Torchilin, V. P. Recent developments in lipid-based pharmaceutical nanocarriers. Front Biosci (Landmark Ed). 1 (16), 1388-1412 (2011).
- Cerpnjak, K., Zvonar, A., Gašperlin, M., Vrečer, F. Lipid-based systems as a promising approach for enhancing the bioavailability of poorly water-soluble drugs). Acta Pharm. 63 (4), 27-445 (2013).
- Rodrìguez-Gascòn, A., Pozo-Rodrìguez, A., Solinìs, M. A. Development of nucleic acid vaccines: use of self-amplifying RNA in lipid nanoparticles. Int J Nanomedicine. 9, 1833-1843 (2014).
- Almeida, A. J., Souto, E. Solid lipid nanoparticles as a drug delivery system for peptides and proteins. Adv Drug Deliv Rev. 59, 478-490 (2007).
- Pardeshi, C., et al. Solid lipid based nanocarriers: an overview. Acta Pharm. 62, 433-472 (2012).
- Attama, A. A., Momoh, M. A., Builders, P. F., Sezer, A. D. Lipid Nanoparticulate Drug Delivery Systems: A Revolution in Dosage Form Design and Development. Recent Advances in Novel Drug Carrier Systems. , 107-140 (2012).

