Solid lipidnanopartikler (SLNs) til intracellulær målretning Applications
Summary
In this study, a method for synthesizing ultra-small populations of biocompatible nanoparticles was described, as well as several in vitro methods by which to assess their cellular interactions.
Abstract
Nanoparticle-based delivery vehicles have shown great promise for intracellular targeting applications, providing a mechanism to specifically alter cellular signaling and gene expression. In a previous investigation, the synthesis of ultra-small solid lipid nanoparticles (SLNs) for topical drug delivery and biomarker detection applications was demonstrated. SLNs are a well-studied example of a nanoparticle delivery system that has emerged as a promising drug delivery vehicle. In this study, SLNs were loaded with a fluorescent dye and used as a model to investigate particle-cell interactions. The phase inversion temperature (PIT) method was used for the synthesis of ultra-small populations of biocompatible nanoparticles. A 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylphenyltetrazolium bromide (MTT) assay was utilized in order to establish appropriate dosing levels prior to the nanoparticle-cell interaction studies. Furthermore, primary human dermal fibroblasts and mouse dendritic cells were exposed to dye-loaded SLN over time and the interactions with respect to toxicity and particle uptake were characterized using fluorescence microscopy and flow cytometry. This study demonstrated that ultra-small SLNs, as a nanoparticle delivery system, are suitable for intracellular targeting of different cell types.
Introduction
Nanopartikler-baserede levering køretøjer har vist meget lovende for intracellulære målretning applikationer, der giver en mekanisme til specifikt at ændre cellulær signalering og genekspression. Disse køretøjer kan indlæses med lægemidler, proteiner og nukleinsyrer til formål at påvirke cellulære reaktioner og opnå en ønsket virkning i målvæv. Mange typer af nanocarriers er blevet udforsket til terapeutisk og diagnostisk fordel, herunder lipider, polymerer, silicium og magnetiske materialer. Disse systemer er attraktive på grund af deres potentiale til lokaliseret lægemiddelafgivelse, øget terapeutisk koncentration i målvæv, og reduktion af systemisk toksicitet.
Faste lipide nanopartikler (SLNs) er en velundersøgte eksempel på en nanopartikel leveringssystem, der er opstået som et lovende lægemiddel afgivelsesvehikel i de seneste år. SLNs kan let formuleres til flere applikationer, herunder bio-sensing 1, kosmetik 2, og therapeutic levering 3-7. Deres anvendelighed skyldes det faktum, at de er sammensat udelukkende af resorberbare, ikke-toksiske lipider, hvilket resulterer i øget biokompatibilitet. Under syntesen, kan lipofile lægemidler inkorporeres i SLN køretøjer, og derved øge lægemiddelopløselighed og egnethed til parenteral indgivelse. SLN køretøjer også bidrage til at stabilisere indkapslede lægemidler, reducere deres nedbrydning og clearance, og maksimere terapeutisk virkning. Disse køretøjer er særligt velegnet til langtidsvirkende, præparater med kontrolleret frigivelse på grund af deres stabilitet ved kropstemperatur 3,4,8,9. Det er vigtigt, indkapsling af lægemidler i lipidnanopartikler ændrer de iboende farmakokinetiske profiler af lægemiddelmolekyler. Dette giver en potentiel fordel ved at tillade kontrolleret frigivelse af lægemidler med et snævert terapeutisk indeks. Frigivelseshastigheden af SLN-inkorporeret terapeutiske kan indstilles på grundlag af lipid nedbrydningshastigheden eller lægemidlet diffusionshastigheden ilipidmatrix.
SLNs er ofte konstrueret til at ophobe sig i bestemte målvæv. For eksempel, deres størrelse (typisk større end 10 nm) potenserer retention i kredsløbet, hvor utætte vaskulatur tumorvæv letter deposition. Desuden har rute for partikel administration vist sig at ændre biodistribution med potentiale til at målrette specifikke fysiologiske strukturer, såsom lymfeknuder 10,11. Efter aflejring i målvæv, opnå passende cellulære interaktioner og eventuel internalisering af nanopartikler er udfordrende på grund af evnen af cellemembraner til selektivt at styre strømmen af ioner og molekyler ind og ud af cellen 12. For at lette celleoptagelse, er det muligt at modificere nanocarriers med specifikke ligander, herunder peptider, små molekyler og monoklonale antistoffer 13,14. Flere mekanismer, herunder både passiv penetration og aktiv transport af nanopartiklerover cellemembranen tidligere er blevet beskrevet 3,12,15. Generelt er det blevet påvist, at celle-interaktioner nanopartikler er påvirket af de fysisk-kemiske egenskaber af nanopartikler herunder størrelse, form, overflade ladning og overfladekemi, foruden cellespecifikke parametre såsom celletype eller cellecyklusfase 12.
En tidligere undersøgelse viste, syntesen af sub-10 nm SLNs for topiske 16 og biomarkør afsløring applikationer 1 hjælp faseomlejringstemperaturen (PIT) metode 17. Dette er en blid syntese metode, hvor 2 sammensætningen forbliver konstant, medens temperaturen gradvist ændres. Kontinuerlig omrøring af den opvarmede opløsning, efterhånden som den afkøles til stuetemperatur resulterer i en nanoemulsion. Denne proces resulterer i syntesen af SLNs med mindre partikelstørrelse 1, end man tidligere rapporteret anvendelse af forskellige fremgangsmåder til syntese af lipid nanoparticles 17-22. Den resulterende størrelse skala, mindre end 20 nm, giver en fordel for intracellulære målretning applikationer på grund af forøget overfladeareal og potentialet for forbedrede cellulære interaktioner.
En skematisk afbildning af SLNs, designet til at levere et fluorescerende farvestof eller terapeutisk, er vist i figur 1. De SLNs består af et lipid indre (f.eks lineær alkan) at tillade inkorporering af lipofile forbindelser (f.eks, farvestoffer eller terapeutiske) og et overfladeaktivt udvendige (f.eks lineær ionisk overfladeaktivt middel) omgivet af vand. I denne undersøgelse blev SLNs fyldt med et fluorescerende farvestof og anvendes som model til at undersøge partikel-celle-interaktioner. Primære humane dermale fibroblaster og mus dendritiske celler blev udsat for farvestof-loaded SLN over tid med henblik på at karakterisere interaktioner med hensyn til toksicitet og partikel-optagelse. A 3- (4,5-dimethylthiazol-2-yl) -2,5-diphenylphenyltetrazolium (MTT) assay blev UtiZed for at etablere passende dosering niveauer. Fluorescensmikroskopi og flowcytometri var to metoder, der anvendes til at undersøge partikel optagelse in vitro.
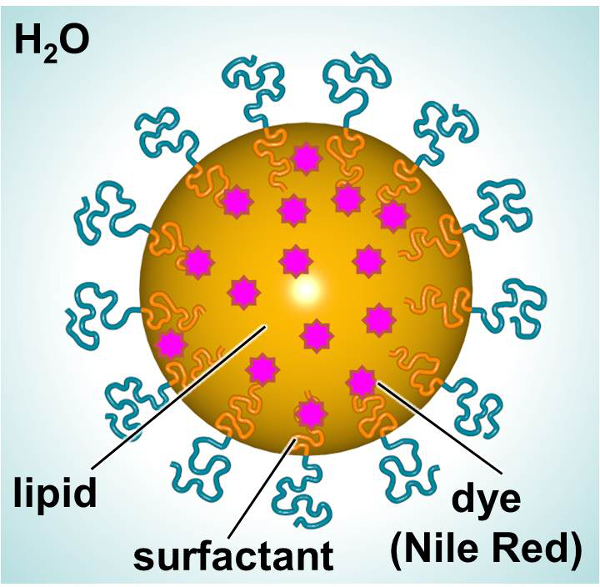
Figur 1. Skematisk af SLN viser de store bestanddele. Klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
I denne undersøgelse blev syntesen af SLNs og deres anvendelighed til intracellulær målretning applikationer udforsket. Disse biokompatible nanopartikler har vist lovende som levering køretøjer til flere programmer, herunder drug delivery, gendæmpning og vaccineteknologier 25-30. Ultra-små SLNs blev syntetiseret ved hjælp af en let proces, og deres samspil med primære hudceller og primære immunceller blev udforsket. SLNs var designet til at omfatte indkapsling af et fluorescerende farvestof (N…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Research reported in this publication was supported by The Johns Hopkins Applied Physics Laboratory’s Research and Exploratory Development Department, Office of Technology Transfer, and Stuart S. Janney Fellowship Program, in addition to the National Heart, Lung, and Blood Institute of the National Institutes of Health under Award Number R21HL127355.
Materials
| Nile Red (NiR) | Sigma | 19123 | BioReagent, suitable for fluorescence, ≥98.0% |
| Heneicosane | Aldrich | 286052 | 98% |
| Brij O10 | Sigma | P6136 | Brij 97, C18-1E10, Polyoxyethylene (10) oleyl ether |
| Water | Sigma | W3500 | Sterile-filtered, BioReagent, suitable for cell culture |
| Syringe Filter 0.2 µm Supor Membrane Low Protein Binding | Life Sciences | PN4612 | Non-Pyrogenic |
| Nanotrac Ultra | Microtrac | serial number U1985IS | Instrument |
| Differential Scanning Calorimeter | Mettlet-Toledo | —- | Instument |
| Primary human fibroblasts | Life Technologies | C-004-5C | Neonatal (HDFn) |
| Medium 106 | Life Technologies | M-106-500 | A sterile, liquid medium for the culture of human dermal fibroblasts. |
| Low Serum Growth Supplement Kit (LSGS Kit) | Life Technologies | S-003-K | All the components of complete LSGS |
| MTT Cell Proliferation Assay Kit | Trevigen | 4890-025-K | Sensitive kit for the measurement of cell proliferation based upon the reduction of the tetrazolium salt, 3,[4,5-dimethylthiazol-2- yl]-2,5-diphenyl-tetrazolium bromide (MTT) |
| Safire2 microplate reader | Tecan | —- | Instrument |
| Phosphate buffered saline | Sigma | P5493 | For molecular biology |
| Recombinant murine GM-CSF | R&D Systems | 415 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
| Recombinant murine IL-4 | R&D Systems | 404 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
References
- Calderon-Colon, X., et al. Synthesis of sub-10 nm solid lipid nanoparticles for topical and biomarker detection applications. J Nanopart Res. 16 (2252), 1-10 (2014).
- Patwekar, S., et al. Review on nanoparticles used in cosmetics and dermal products. World Journal of Pharmacy and Pharmaceutical Sciences. 3 (8), 1407-1421 (2014).
- Martins, S., et al. Solid lipid nanoparticles as intracellular drug transporters: An investigation of the uptake mechanism and pathway. International Journal of Pharmaceutics. 430, 216-227 (2012).
- Yadav, N., Khatak, S., Sara, U. V. S. Solid Lipid Nanoparticles – A Review. International Journal of Applied Pharmaceuticals. 5 (2), 8-18 (2013).
- Weber, S., Zimmer, A., Solid Pardeike, J. Lipid Nanoparticles (SLN) and Nanostructured Lipid Carriers (NLC) for pulmonary application: a review of the state of the art. Eur J Pharm Biopharm. 86 (1), 7-22 (2014).
- Mahajan, A., Kaur, S., Grewal, N. K., Kaur, S. Solid Lipd Nanoparticles (SLNs) – As Novel Lipd based Nanocarriers for Drugs. International Journal of Advanced Research. 2 (1), 433-441 (2014).
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Malam, Y., Loizidou, M., Seifalian, A. M. Liposomes and nanoparticles: nanosized vehicles for drug delivery in cancer. Trends Pharmacol Sci. 30 (11), 592-599 (2009).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers. Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Ali Khan, A., Mudassir, J., Mohtar, N., Darwis, Y. Advanced drug delivery to the lymphatic system: lipid-based nanoformulations. International journal of nanomedicine. 8, 2733-2744 (2013).
- Oussoren, C., Storm, G. Liposomes to target the lymphatics by subcutaneous administration. Advanced drug delivery reviews. 50, 143-156 (2001).
- Shang, L., Nienhaus, K., Nienhaus, G. U. Engineered nanoparticles interacting with cells: size matters. J Nanobiotechnology. 12, 5 (2014).
- Joshi, M. D., Muller, R. H. Lipid nanoparticles for parenteral delivery of actives. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e.V. 71, 161-172 (2009).
- Torchilin, V. P. Micellar nanocarriers: pharmaceutical perspectives. Pharmaceutical research. 24, 1-16 (2007).
- Ashley, C. E., et al. The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers. Nature materials. 10, 389-397 (2011).
- Patchan, M., et al. Nanotech; Nanotechnology 2013: Bio Sensors Instruments, Medical, Environment and Energy; Chapter 3: Materials for Dru., and Gene Delivery. Nanobandage for controlled release of topical therapeutics. 3, 255-258 (2013).
- Forgiarini, A., Esquena, J., Gonzalez, C., C, S., Koutsoukos, P. Formation and stability of nano-emulsions in mixed nonionic surfactant systems. Trends in colloid and interface science XV. Progress in Colloid and Polymer Science. 118, 184-189 (2001).
- Nantarat, T., Chansakaow, S., Leelapornpisid, P. Optimization, characterization and stability of essential oils blend loaded nanoemulsions by PIC technique for anti-tyrosinase activity. International Journal of Pharmacy and Pharmaceutical Sciences. 7, 308-312 (2015).
- Sevcikova, P., Vltavska, P., Kasparkova, V., Formation Krejci, J. Characterization and Stability of Nanoemulsions Prepared by Phase Inversion. , 132-137 (2011).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C., Buckin, V. Studies of the relation between phase behavior and emulsification methods with nanoemulsion formation. Trends in colloid and interface science XIV. Progress in Colloid and Polymer Science. 115, 36-39 (2000).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C. Formation of nano-emulsions by low-energy emulsification methods at constant temperature. Langmuir. 17 (7), 2076-2083 (2001).
- Cabone, C., Tomasello, B., Ruozi, B., Renis, M., Puglisi, G. Preparation and optimization of PIT solid lipid nanoparticles via statistical factorial design. Eur J Med Chem. 49, 110-117 (2012).
- Raimondi, G., et al. Mammalian Target of Rapamycin Inhibition and Alloantigen-Specific Regulatory T Cells Synergize To Promote Long-Term Graft Survival in Immunocompetent Recipients. J Immunol. 184, 624-636 (2010).
- Jhunjhunwala, S., Raimondi, G., Thomson, A. W., Little, S. R. Delivery of rapamycin to dendritic cells using degradable microparticles. J Control Release. 133 (13), 191-197 (2009).
- Kapse-Mistry, S., Govender, T., Srivastava, R., Yergeri, M. Nanodrug delivery in reversing multidrug resistance in cancer cells.. Front Pharmacol. 5 (159), 1-22 (2014).
- Musacchio, T., Torchilin, V. P. Recent developments in lipid-based pharmaceutical nanocarriers. Front Biosci (Landmark Ed). 1 (16), 1388-1412 (2011).
- Cerpnjak, K., Zvonar, A., Gašperlin, M., Vrečer, F. Lipid-based systems as a promising approach for enhancing the bioavailability of poorly water-soluble drugs). Acta Pharm. 63 (4), 27-445 (2013).
- Rodrìguez-Gascòn, A., Pozo-Rodrìguez, A., Solinìs, M. A. Development of nucleic acid vaccines: use of self-amplifying RNA in lipid nanoparticles. Int J Nanomedicine. 9, 1833-1843 (2014).
- Almeida, A. J., Souto, E. Solid lipid nanoparticles as a drug delivery system for peptides and proteins. Adv Drug Deliv Rev. 59, 478-490 (2007).
- Pardeshi, C., et al. Solid lipid based nanocarriers: an overview. Acta Pharm. 62, 433-472 (2012).
- Attama, A. A., Momoh, M. A., Builders, P. F., Sezer, A. D. Lipid Nanoparticulate Drug Delivery Systems: A Revolution in Dosage Form Design and Development. Recent Advances in Novel Drug Carrier Systems. , 107-140 (2012).

