細胞内ターゲティングアプリケーションのための固体脂質ナノ粒子(SLNs)
Summary
In this study, a method for synthesizing ultra-small populations of biocompatible nanoparticles was described, as well as several in vitro methods by which to assess their cellular interactions.
Abstract
Nanoparticle-based delivery vehicles have shown great promise for intracellular targeting applications, providing a mechanism to specifically alter cellular signaling and gene expression. In a previous investigation, the synthesis of ultra-small solid lipid nanoparticles (SLNs) for topical drug delivery and biomarker detection applications was demonstrated. SLNs are a well-studied example of a nanoparticle delivery system that has emerged as a promising drug delivery vehicle. In this study, SLNs were loaded with a fluorescent dye and used as a model to investigate particle-cell interactions. The phase inversion temperature (PIT) method was used for the synthesis of ultra-small populations of biocompatible nanoparticles. A 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylphenyltetrazolium bromide (MTT) assay was utilized in order to establish appropriate dosing levels prior to the nanoparticle-cell interaction studies. Furthermore, primary human dermal fibroblasts and mouse dendritic cells were exposed to dye-loaded SLN over time and the interactions with respect to toxicity and particle uptake were characterized using fluorescence microscopy and flow cytometry. This study demonstrated that ultra-small SLNs, as a nanoparticle delivery system, are suitable for intracellular targeting of different cell types.
Introduction
ナノ粒子ベースの送達ビヒクルは、特に細胞のシグナル伝達および遺伝子発現を変化させるメカニズムを提供する、細胞内標的化用途のための大きな期待を示しています。これらの車両は、細胞応答に影響を与え、標的組織内の所望の効果を達成するように設計された薬物、タンパク質、および核酸を装填することができます。ナノキャリアの多くの種類は、脂質、ポリマー、シリコン、及び磁性材料を含む、治療的および診断的利益のために検討されています。これらのシステムは、ローカライズによる薬物送達のためのそれらの潜在的に魅力的であり、全身毒性の低減と、標的組織に治療濃度を増加させました。
固体脂質ナノ粒子(SLNs)は近年、有望な薬物送達ビヒクルとして浮上しているナノ粒子送達システムのよく研究例です。 SLNsは、容易にバイオセンシング1、化粧品2、およびTを含む複数の用途のために処方することができますherapeutic配信3-7。それらの有用性は、それらが生体適合性を高め、その結果、吸収性、非毒性脂質から完全に構成されているという事実から生じます。合成中に、親油性薬剤は、それによって、非経口投与のための薬剤の溶解性および適合性を増大させる、SLN車両に組み込むことができます。 SLN車両はまたそれらの分解およびクリアランスを減少させ、治療効果を最大化し、カプセル化された治療薬を安定化させるのを助けます。これらの車両は、体温3,4,8,9での安定性のために、制御放出製剤、長時間作用のために特に適しています。重要なことには、脂質ナノ粒子中の薬物のカプセル化は、薬物分子の固有の薬物動態プロファイルを変化させます。これは、狭い治療指数を有する薬物の制御放出を可能にすることによって潜在的な利点を提供します。 SLN内蔵治療薬の放出速度は、脂質の分解速度または中の薬物の拡散速度に基づいて調整することができます脂質マトリックス。
SLNsは、しばしば、特定の標的組織に蓄積するように操作されています。例えば、そのサイズ(通常は10を超えるnm)は、腫瘍組織の漏れやすい血管系は、堆積を促進する循環に保持を増強します。また、粒子の投与経路は、リンパ節10,11のような特定の生理学的構造を標的とする可能性のある生体内分布を変化させることが示されています。標的組織における沈着すると、ナノ粒子の適切な細胞の相互作用および最終的な内在化を達成することは、選択的に、セル12のうち、イオンおよび分子の流れを制御するために、細胞膜の能力に困難です。細胞取り込みを容易にするために、ペプチド、小分子、およびモノクローナル抗体13,14を含む特異的なリガンドを持つナノキャリアを変更することが可能です。受動浸透とナノ粒子の能動輸送の両方を含むいくつかのメカニズム細胞膜を横切って、以前3,12,15に記載されています 。一般的に、細胞-ナノ粒子相互作用は、細胞型または細胞周期相12とセル固有のパラメータに加えて、サイズ、形状、表面電荷及び表面化学を含むナノ粒子の物理化学的特性に影響されることが実証されています。
以前の研究は、転相温度(PIT)法17を用いて、16の局所的バイオマーカー検出アプリケーション1のためのサブ10 nmのSLNsの合成を実証しました。これは、温度を徐々に変化させながら2組成が一定のままで穏やかな合成方法です。加熱した溶液を連続的に攪拌しながら、それはナノエマルジョンで結果を室温に冷却します。このプロセスよりも小さい粒径を有する1 SLNsの合成の結果は、以前に、脂質ナンの合成のための種々の方法を使用して報告しますoparticles 17-22。得られたサイズスケール、20nm未満では、増加による表面積および増強された細胞の相互作用のための潜在的に細胞内標的用途のための利点を提供します。
蛍光色素または治療薬を送達するように設計さSLNsの概略図は、 図 1に示されている。SLNsは、脂質内部(例えば、直鎖アルカン)、親油性化合物(例えば、染料または治療剤)の取り込みを可能にし、界面活性剤の外部から成り水に囲まれた(例えば、線形非イオン性界面活性剤)。本研究では、SLNsは、蛍光色素を負荷した、粒子 – 細胞相互作用を研究するためのモデルとして使用します。初代ヒト皮膚線維芽細胞およびマウス樹状細胞は、毒性及び粒子の取り込みに対する相互作用を特徴付けるために、経時SLNをロードされた色素に曝露しました。 3-(4,5-ジメチルチアゾール-2-イル)-2,5- diphenylphenyltetrazoliumブロミド(MTT)アッセイはutiliました適切な投薬レベルを確立するために、ZED。蛍光顕微鏡およびフローサイトメトリーは 、in vitroでの粒子の取り込みを調べるために用いられる二つの方法でした。
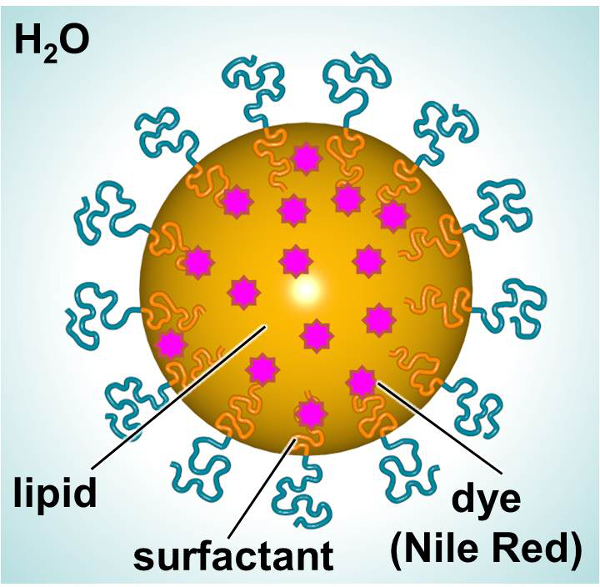
主要な構成要素を示すSLNの図1の回路図。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Protocol
Representative Results
Discussion
本研究では、SLNsの合成および細胞内標的化適用のためのそれらの適用が検討されました。これらの生体適合性ナノ粒子は、薬物送達、遺伝子サイレンシング、およびワクチン技術25-30を含む複数の用途のための送達媒体として有望であることが示されています。超小型SLNsは容易なプロセスを使用して合成し、そして一次皮膚細胞および初代免疫細胞との相互作用を調べました。 SLNs?…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Research reported in this publication was supported by The Johns Hopkins Applied Physics Laboratory’s Research and Exploratory Development Department, Office of Technology Transfer, and Stuart S. Janney Fellowship Program, in addition to the National Heart, Lung, and Blood Institute of the National Institutes of Health under Award Number R21HL127355.
Materials
| Nile Red (NiR) | Sigma | 19123 | BioReagent, suitable for fluorescence, ≥98.0% |
| Heneicosane | Aldrich | 286052 | 98% |
| Brij O10 | Sigma | P6136 | Brij 97, C18-1E10, Polyoxyethylene (10) oleyl ether |
| Water | Sigma | W3500 | Sterile-filtered, BioReagent, suitable for cell culture |
| Syringe Filter 0.2 µm Supor Membrane Low Protein Binding | Life Sciences | PN4612 | Non-Pyrogenic |
| Nanotrac Ultra | Microtrac | serial number U1985IS | Instrument |
| Differential Scanning Calorimeter | Mettlet-Toledo | —- | Instument |
| Primary human fibroblasts | Life Technologies | C-004-5C | Neonatal (HDFn) |
| Medium 106 | Life Technologies | M-106-500 | A sterile, liquid medium for the culture of human dermal fibroblasts. |
| Low Serum Growth Supplement Kit (LSGS Kit) | Life Technologies | S-003-K | All the components of complete LSGS |
| MTT Cell Proliferation Assay Kit | Trevigen | 4890-025-K | Sensitive kit for the measurement of cell proliferation based upon the reduction of the tetrazolium salt, 3,[4,5-dimethylthiazol-2- yl]-2,5-diphenyl-tetrazolium bromide (MTT) |
| Safire2 microplate reader | Tecan | —- | Instrument |
| Phosphate buffered saline | Sigma | P5493 | For molecular biology |
| Recombinant murine GM-CSF | R&D Systems | 415 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
| Recombinant murine IL-4 | R&D Systems | 404 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
References
- Calderon-Colon, X., et al. Synthesis of sub-10 nm solid lipid nanoparticles for topical and biomarker detection applications. J Nanopart Res. 16 (2252), 1-10 (2014).
- Patwekar, S., et al. Review on nanoparticles used in cosmetics and dermal products. World Journal of Pharmacy and Pharmaceutical Sciences. 3 (8), 1407-1421 (2014).
- Martins, S., et al. Solid lipid nanoparticles as intracellular drug transporters: An investigation of the uptake mechanism and pathway. International Journal of Pharmaceutics. 430, 216-227 (2012).
- Yadav, N., Khatak, S., Sara, U. V. S. Solid Lipid Nanoparticles – A Review. International Journal of Applied Pharmaceuticals. 5 (2), 8-18 (2013).
- Weber, S., Zimmer, A., Solid Pardeike, J. Lipid Nanoparticles (SLN) and Nanostructured Lipid Carriers (NLC) for pulmonary application: a review of the state of the art. Eur J Pharm Biopharm. 86 (1), 7-22 (2014).
- Mahajan, A., Kaur, S., Grewal, N. K., Kaur, S. Solid Lipd Nanoparticles (SLNs) – As Novel Lipd based Nanocarriers for Drugs. International Journal of Advanced Research. 2 (1), 433-441 (2014).
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Malam, Y., Loizidou, M., Seifalian, A. M. Liposomes and nanoparticles: nanosized vehicles for drug delivery in cancer. Trends Pharmacol Sci. 30 (11), 592-599 (2009).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers. Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Ali Khan, A., Mudassir, J., Mohtar, N., Darwis, Y. Advanced drug delivery to the lymphatic system: lipid-based nanoformulations. International journal of nanomedicine. 8, 2733-2744 (2013).
- Oussoren, C., Storm, G. Liposomes to target the lymphatics by subcutaneous administration. Advanced drug delivery reviews. 50, 143-156 (2001).
- Shang, L., Nienhaus, K., Nienhaus, G. U. Engineered nanoparticles interacting with cells: size matters. J Nanobiotechnology. 12, 5 (2014).
- Joshi, M. D., Muller, R. H. Lipid nanoparticles for parenteral delivery of actives. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e.V. 71, 161-172 (2009).
- Torchilin, V. P. Micellar nanocarriers: pharmaceutical perspectives. Pharmaceutical research. 24, 1-16 (2007).
- Ashley, C. E., et al. The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers. Nature materials. 10, 389-397 (2011).
- Patchan, M., et al. Nanotech; Nanotechnology 2013: Bio Sensors Instruments, Medical, Environment and Energy; Chapter 3: Materials for Dru., and Gene Delivery. Nanobandage for controlled release of topical therapeutics. 3, 255-258 (2013).
- Forgiarini, A., Esquena, J., Gonzalez, C., C, S., Koutsoukos, P. Formation and stability of nano-emulsions in mixed nonionic surfactant systems. Trends in colloid and interface science XV. Progress in Colloid and Polymer Science. 118, 184-189 (2001).
- Nantarat, T., Chansakaow, S., Leelapornpisid, P. Optimization, characterization and stability of essential oils blend loaded nanoemulsions by PIC technique for anti-tyrosinase activity. International Journal of Pharmacy and Pharmaceutical Sciences. 7, 308-312 (2015).
- Sevcikova, P., Vltavska, P., Kasparkova, V., Formation Krejci, J. Characterization and Stability of Nanoemulsions Prepared by Phase Inversion. , 132-137 (2011).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C., Buckin, V. Studies of the relation between phase behavior and emulsification methods with nanoemulsion formation. Trends in colloid and interface science XIV. Progress in Colloid and Polymer Science. 115, 36-39 (2000).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C. Formation of nano-emulsions by low-energy emulsification methods at constant temperature. Langmuir. 17 (7), 2076-2083 (2001).
- Cabone, C., Tomasello, B., Ruozi, B., Renis, M., Puglisi, G. Preparation and optimization of PIT solid lipid nanoparticles via statistical factorial design. Eur J Med Chem. 49, 110-117 (2012).
- Raimondi, G., et al. Mammalian Target of Rapamycin Inhibition and Alloantigen-Specific Regulatory T Cells Synergize To Promote Long-Term Graft Survival in Immunocompetent Recipients. J Immunol. 184, 624-636 (2010).
- Jhunjhunwala, S., Raimondi, G., Thomson, A. W., Little, S. R. Delivery of rapamycin to dendritic cells using degradable microparticles. J Control Release. 133 (13), 191-197 (2009).
- Kapse-Mistry, S., Govender, T., Srivastava, R., Yergeri, M. Nanodrug delivery in reversing multidrug resistance in cancer cells.. Front Pharmacol. 5 (159), 1-22 (2014).
- Musacchio, T., Torchilin, V. P. Recent developments in lipid-based pharmaceutical nanocarriers. Front Biosci (Landmark Ed). 1 (16), 1388-1412 (2011).
- Cerpnjak, K., Zvonar, A., Gašperlin, M., Vrečer, F. Lipid-based systems as a promising approach for enhancing the bioavailability of poorly water-soluble drugs). Acta Pharm. 63 (4), 27-445 (2013).
- Rodrìguez-Gascòn, A., Pozo-Rodrìguez, A., Solinìs, M. A. Development of nucleic acid vaccines: use of self-amplifying RNA in lipid nanoparticles. Int J Nanomedicine. 9, 1833-1843 (2014).
- Almeida, A. J., Souto, E. Solid lipid nanoparticles as a drug delivery system for peptides and proteins. Adv Drug Deliv Rev. 59, 478-490 (2007).
- Pardeshi, C., et al. Solid lipid based nanocarriers: an overview. Acta Pharm. 62, 433-472 (2012).
- Attama, A. A., Momoh, M. A., Builders, P. F., Sezer, A. D. Lipid Nanoparticulate Drug Delivery Systems: A Revolution in Dosage Form Design and Development. Recent Advances in Novel Drug Carrier Systems. , 107-140 (2012).

