Sólido lípidos nanopartículas (GLC) Aplicaciones para intracelular de focalización
Summary
In this study, a method for synthesizing ultra-small populations of biocompatible nanoparticles was described, as well as several in vitro methods by which to assess their cellular interactions.
Abstract
Nanoparticle-based delivery vehicles have shown great promise for intracellular targeting applications, providing a mechanism to specifically alter cellular signaling and gene expression. In a previous investigation, the synthesis of ultra-small solid lipid nanoparticles (SLNs) for topical drug delivery and biomarker detection applications was demonstrated. SLNs are a well-studied example of a nanoparticle delivery system that has emerged as a promising drug delivery vehicle. In this study, SLNs were loaded with a fluorescent dye and used as a model to investigate particle-cell interactions. The phase inversion temperature (PIT) method was used for the synthesis of ultra-small populations of biocompatible nanoparticles. A 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenylphenyltetrazolium bromide (MTT) assay was utilized in order to establish appropriate dosing levels prior to the nanoparticle-cell interaction studies. Furthermore, primary human dermal fibroblasts and mouse dendritic cells were exposed to dye-loaded SLN over time and the interactions with respect to toxicity and particle uptake were characterized using fluorescence microscopy and flow cytometry. This study demonstrated that ultra-small SLNs, as a nanoparticle delivery system, are suitable for intracellular targeting of different cell types.
Introduction
Vehículos de administración basados en nanopartículas han mostrado una gran promesa para aplicaciones dirigidas intracelulares, proporcionando un mecanismo para alterar específicamente la señalización celular y la expresión génica. Estos vehículos pueden ser cargados con fármacos, proteínas y ácidos nucleicos diseñados para afectar las respuestas celulares y lograr un efecto deseado en los tejidos diana. Muchos tipos de nanovehículos se han explorado para el beneficio terapéutico y de diagnóstico incluyendo lípidos, polímeros, silicio y materiales magnéticos. Estos sistemas son atractivos debido a su potencial para la entrega localizada de fármacos, aumento de la concentración terapéutica en tejidos diana, y la reducción de la toxicidad sistémica.
Nanopartículas lipídicas sólidas (GLC) son un ejemplo bien estudiado de un sistema de liberación de nanopartículas que ha surgido como un vehículo de suministro de fármaco prometedor en los últimos años. SLNs se pueden formular fácilmente para múltiples aplicaciones, incluyendo la detección de bio-1, cosméticos 2, y tentrega herapeutic 3-7. Su utilidad se deriva del hecho de que se componen enteramente de, lípidos no tóxicos reabsorbibles, resulta en una mayor biocompatibilidad. Durante la síntesis, fármacos lipófilos se pueden incorporar en vehículos SLN, lo que aumenta la solubilidad del fármaco y la idoneidad para la administración parenteral. Vehículos SLN también ayudan a estabilizar la terapéutica encapsulados, reduciendo su degradación y la limpieza, y la maximización de la acción terapéutica. Estos vehículos son particularmente bien adaptado para acción prolongada, preparaciones de liberación controlada debido a su estabilidad en 3,4,8,9 la temperatura corporal. Es importante destacar que la encapsulación de fármacos en nanopartículas lipídicas altera los perfiles farmacocinéticos intrínsecas de las moléculas de fármaco. Esto proporciona una ventaja potencial al permitir la liberación controlada de fármacos con un índice terapéutico estrecho. La velocidad de liberación de la terapéutica incorporado SLN-puede ser sintonizado basa en la tasa de degradación de lípidos o de la tasa de difusión del fármaco en elmatriz lipídica.
SLNs son a menudo diseñados para acumularse en tejidos diana específicos. Por ejemplo, su tamaño (típicamente mayor que 10 nm) potencia la retención en la circulación, donde la vasculatura tumoral con fugas de tejido facilita la deposición. Además, la vía de administración de partículas se ha demostrado que altera la biodistribución con el potencial para apuntar estructuras fisiológicas específicas, tales como los ganglios linfáticos 10,11. Tras la deposición en los tejidos diana, el logro de las interacciones celulares apropiadas y eventual internalización de nanopartículas es un reto debido a la capacidad de las membranas celulares para controlar selectivamente el flujo de iones y moléculas dentro y fuera de la celda 12. Para facilitar la absorción celular, es posible modificar nanovehículos con ligandos específicos que incluyen péptidos, moléculas pequeñas, y anticuerpos monoclonales 13,14. Varios mecanismos que incluyen tanto la penetración pasiva y transporte activo de nanopartículasa través de la membrana celular se han descrito previamente 3,12,15. En general, se ha demostrado que las interacciones célula-nanopartículas están influenciados por las propiedades fisicoquímicas de las nanopartículas incluyendo el tamaño, forma, carga superficial y la química de superficie, además de los parámetros específicos de células tales como el tipo celular o fase del ciclo celular 12.
Una investigación anterior demostró la síntesis de sub-10 GLC nm de tópicos 16 y biomarcadores aplicaciones de detección de 1 utilizando el método de la temperatura de inversión de fases (PIT) 17. Este es un método de síntesis suave donde la composición 2 se mantiene constante mientras que la temperatura se cambia gradualmente. Agitación continua de la solución calentada, mientras se enfría a los resultados de RT en una nanoemulsión. Este proceso resulta en la síntesis de GLC con tamaño de partícula menor 1 que se informó anteriormente utilizando diversos métodos para la síntesis de lípidos nanoparticles 17-22. La escala de tamaño resultante, a menos de 20 nm, proporciona una ventaja para aplicaciones de focalización intracelulares debido a una mayor área de superficie y el potencial para las interacciones celulares mejoradas.
A esquemática de GLC, diseñado para ofrecer un colorante fluorescente o terapéutico, se muestra en la Figura 1. Los SLNs constan de un lípido interior (por ejemplo, alcano lineal) permitiendo la incorporación de compuestos lipófilos (por ejemplo, tintes o agentes terapéuticos) y un exterior tensioactivo (tensioactivo no iónico, por ejemplo, lineal) rodeada de agua. En este estudio, SLNs se cargaron con un colorante fluorescente y se usan como un modelo para investigar las interacciones célula-partícula. Fibroblastos dérmicos humanos primarios y células dendríticas de ratones fueron expuestos a teñir-cargadas SLN lo largo del tiempo con el fin de caracterizar las interacciones con respecto a la toxicidad y la captación de partículas. A 3- (4,5-dimetiltiazol-2-il) -2,5-diphenylphenyltetrazolium (MTT) ensayo fue utilized el fin de establecer los niveles de dosificación apropiados. La microscopía de fluorescencia y citometría de flujo fueron dos métodos empleados para examinar la captación de partículas in vitro.
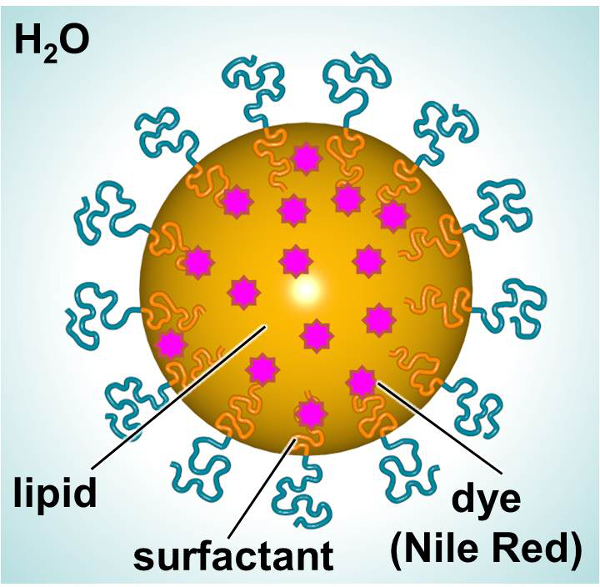
Figura 1. Esquema de GLC que muestra los componentes principales. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
En este estudio, la síntesis de GLC y su aplicabilidad para aplicaciones dirigidas intracelulares fueron exploradas. Estas nanopartículas biocompatibles se han mostrado prometedores como vehículos de administración para múltiples aplicaciones, incluyendo la administración de fármacos, el silenciamiento de genes y tecnologías de vacunas 25-30. Ultra-pequeños GLC se sintetizaron utilizando un proceso fácil, y sus interacciones con las células cutáneas primarias y células inmunes primarias fueron ex…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Research reported in this publication was supported by The Johns Hopkins Applied Physics Laboratory’s Research and Exploratory Development Department, Office of Technology Transfer, and Stuart S. Janney Fellowship Program, in addition to the National Heart, Lung, and Blood Institute of the National Institutes of Health under Award Number R21HL127355.
Materials
| Nile Red (NiR) | Sigma | 19123 | BioReagent, suitable for fluorescence, ≥98.0% |
| Heneicosane | Aldrich | 286052 | 98% |
| Brij O10 | Sigma | P6136 | Brij 97, C18-1E10, Polyoxyethylene (10) oleyl ether |
| Water | Sigma | W3500 | Sterile-filtered, BioReagent, suitable for cell culture |
| Syringe Filter 0.2 µm Supor Membrane Low Protein Binding | Life Sciences | PN4612 | Non-Pyrogenic |
| Nanotrac Ultra | Microtrac | serial number U1985IS | Instrument |
| Differential Scanning Calorimeter | Mettlet-Toledo | —- | Instument |
| Primary human fibroblasts | Life Technologies | C-004-5C | Neonatal (HDFn) |
| Medium 106 | Life Technologies | M-106-500 | A sterile, liquid medium for the culture of human dermal fibroblasts. |
| Low Serum Growth Supplement Kit (LSGS Kit) | Life Technologies | S-003-K | All the components of complete LSGS |
| MTT Cell Proliferation Assay Kit | Trevigen | 4890-025-K | Sensitive kit for the measurement of cell proliferation based upon the reduction of the tetrazolium salt, 3,[4,5-dimethylthiazol-2- yl]-2,5-diphenyl-tetrazolium bromide (MTT) |
| Safire2 microplate reader | Tecan | —- | Instrument |
| Phosphate buffered saline | Sigma | P5493 | For molecular biology |
| Recombinant murine GM-CSF | R&D Systems | 415 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
| Recombinant murine IL-4 | R&D Systems | 404 | >97%, by SDS-PAGE under reducing conditions and visualized by silver stain. |
References
- Calderon-Colon, X., et al. Synthesis of sub-10 nm solid lipid nanoparticles for topical and biomarker detection applications. J Nanopart Res. 16 (2252), 1-10 (2014).
- Patwekar, S., et al. Review on nanoparticles used in cosmetics and dermal products. World Journal of Pharmacy and Pharmaceutical Sciences. 3 (8), 1407-1421 (2014).
- Martins, S., et al. Solid lipid nanoparticles as intracellular drug transporters: An investigation of the uptake mechanism and pathway. International Journal of Pharmaceutics. 430, 216-227 (2012).
- Yadav, N., Khatak, S., Sara, U. V. S. Solid Lipid Nanoparticles – A Review. International Journal of Applied Pharmaceuticals. 5 (2), 8-18 (2013).
- Weber, S., Zimmer, A., Solid Pardeike, J. Lipid Nanoparticles (SLN) and Nanostructured Lipid Carriers (NLC) for pulmonary application: a review of the state of the art. Eur J Pharm Biopharm. 86 (1), 7-22 (2014).
- Mahajan, A., Kaur, S., Grewal, N. K., Kaur, S. Solid Lipd Nanoparticles (SLNs) – As Novel Lipd based Nanocarriers for Drugs. International Journal of Advanced Research. 2 (1), 433-441 (2014).
- Buse, J., El-Aneed, A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems: current research and advances. Nanomedicine (Lond). 5, 1237-1260 (2010).
- Malam, Y., Loizidou, M., Seifalian, A. M. Liposomes and nanoparticles: nanosized vehicles for drug delivery in cancer. Trends Pharmacol Sci. 30 (11), 592-599 (2009).
- Lim, S. B., Banerjee, A., Onyuksel, H. Improvement of drug safety by the use of lipid-based nanocarriers. Journal of controlled release : official journal of the Controlled Release Society. 163, 34-45 (2012).
- Ali Khan, A., Mudassir, J., Mohtar, N., Darwis, Y. Advanced drug delivery to the lymphatic system: lipid-based nanoformulations. International journal of nanomedicine. 8, 2733-2744 (2013).
- Oussoren, C., Storm, G. Liposomes to target the lymphatics by subcutaneous administration. Advanced drug delivery reviews. 50, 143-156 (2001).
- Shang, L., Nienhaus, K., Nienhaus, G. U. Engineered nanoparticles interacting with cells: size matters. J Nanobiotechnology. 12, 5 (2014).
- Joshi, M. D., Muller, R. H. Lipid nanoparticles for parenteral delivery of actives. European journal of pharmaceutics and biopharmaceutics : official journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik e.V. 71, 161-172 (2009).
- Torchilin, V. P. Micellar nanocarriers: pharmaceutical perspectives. Pharmaceutical research. 24, 1-16 (2007).
- Ashley, C. E., et al. The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers. Nature materials. 10, 389-397 (2011).
- Patchan, M., et al. Nanotech; Nanotechnology 2013: Bio Sensors Instruments, Medical, Environment and Energy; Chapter 3: Materials for Dru., and Gene Delivery. Nanobandage for controlled release of topical therapeutics. 3, 255-258 (2013).
- Forgiarini, A., Esquena, J., Gonzalez, C., C, S., Koutsoukos, P. Formation and stability of nano-emulsions in mixed nonionic surfactant systems. Trends in colloid and interface science XV. Progress in Colloid and Polymer Science. 118, 184-189 (2001).
- Nantarat, T., Chansakaow, S., Leelapornpisid, P. Optimization, characterization and stability of essential oils blend loaded nanoemulsions by PIC technique for anti-tyrosinase activity. International Journal of Pharmacy and Pharmaceutical Sciences. 7, 308-312 (2015).
- Sevcikova, P., Vltavska, P., Kasparkova, V., Formation Krejci, J. Characterization and Stability of Nanoemulsions Prepared by Phase Inversion. , 132-137 (2011).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C., Buckin, V. Studies of the relation between phase behavior and emulsification methods with nanoemulsion formation. Trends in colloid and interface science XIV. Progress in Colloid and Polymer Science. 115, 36-39 (2000).
- Forgiarini, A., Esquena, J., Gonzalez, C., Solans, C. Formation of nano-emulsions by low-energy emulsification methods at constant temperature. Langmuir. 17 (7), 2076-2083 (2001).
- Cabone, C., Tomasello, B., Ruozi, B., Renis, M., Puglisi, G. Preparation and optimization of PIT solid lipid nanoparticles via statistical factorial design. Eur J Med Chem. 49, 110-117 (2012).
- Raimondi, G., et al. Mammalian Target of Rapamycin Inhibition and Alloantigen-Specific Regulatory T Cells Synergize To Promote Long-Term Graft Survival in Immunocompetent Recipients. J Immunol. 184, 624-636 (2010).
- Jhunjhunwala, S., Raimondi, G., Thomson, A. W., Little, S. R. Delivery of rapamycin to dendritic cells using degradable microparticles. J Control Release. 133 (13), 191-197 (2009).
- Kapse-Mistry, S., Govender, T., Srivastava, R., Yergeri, M. Nanodrug delivery in reversing multidrug resistance in cancer cells.. Front Pharmacol. 5 (159), 1-22 (2014).
- Musacchio, T., Torchilin, V. P. Recent developments in lipid-based pharmaceutical nanocarriers. Front Biosci (Landmark Ed). 1 (16), 1388-1412 (2011).
- Cerpnjak, K., Zvonar, A., Gašperlin, M., Vrečer, F. Lipid-based systems as a promising approach for enhancing the bioavailability of poorly water-soluble drugs). Acta Pharm. 63 (4), 27-445 (2013).
- Rodrìguez-Gascòn, A., Pozo-Rodrìguez, A., Solinìs, M. A. Development of nucleic acid vaccines: use of self-amplifying RNA in lipid nanoparticles. Int J Nanomedicine. 9, 1833-1843 (2014).
- Almeida, A. J., Souto, E. Solid lipid nanoparticles as a drug delivery system for peptides and proteins. Adv Drug Deliv Rev. 59, 478-490 (2007).
- Pardeshi, C., et al. Solid lipid based nanocarriers: an overview. Acta Pharm. 62, 433-472 (2012).
- Attama, A. A., Momoh, M. A., Builders, P. F., Sezer, A. D. Lipid Nanoparticulate Drug Delivery Systems: A Revolution in Dosage Form Design and Development. Recent Advances in Novel Drug Carrier Systems. , 107-140 (2012).

