Utarbeidelse og analyse av<em> In Vitro</em> Tredimensjonal brystkreft Surrogates
Summary
We demonstrate a method to generate 3D breast cancer surrogates, which can be cultured using a perfusion bioreactor system to deliver oxygen and nutrients. Following growth, surrogates are fixed and processed to paraffin for evaluation of parameters of interest. The evaluation of one such parameter, cell density, is explained.
Abstract
Tredimensjonal (3D) kulturen er en mer fysiologisk relevante metode for å modellere oppførselen celle in vitro enn todimensjonale kultur. Karsinomer, inkludert brystkarsinomer, er komplekse 3D vev sammensatt av kreft epitelceller og stromale komponenter, inkludert fibroblaster og ekstracellulære matriks (ECM). Men de fleste in vitro-modeller av bryst-karsinom bestå bare av kreft epitelceller, utelatelse av stroma og derfor 3D-arkitekturen av en tumor in vivo. Passende 3D modellering av carcinoma er viktig for presis forståelse av tumorbiologi, adferd og respons på behandling. Imidlertid er varigheten av kulturen og volum av 3D-modeller begrenset av tilgjengeligheten av oksygen og næringsstoffer i kulturen. Heri viser vi en fremgangsmåte hvor brystkreft epitelceller og stromale fibroblaster er innlemmet i ECM for å generere en 3D-brystkreft surrogat som inneholder stroma og kan dyrkes som enfast 3D-struktur, eller ved hjelp av en perfusjon bioreaktor system for å levere oksygen og næringsstoffer. Følgende oppsett og en innledende vekstperioden, kan surrogater brukes til prekliniske narkotika testing. Alternativt kan de cellulære og matriks-komponenter av surrogat modifiseres for å ta opp en rekke biologiske spørsmål. Etter at kulturen blir surrogater fiksert og bearbeidet til parafin, på en måte som ligner på behandlingen av kliniske bryst karsinom prøver, for evaluering av parametere av interesse. Evalueringen av en slik parameter, tettheten av celler som er tilstede, er beskrevet, hvor ImageJ og CellProfiler bildeanalyse programvaresystemer blir tilført mikrofotografier av histologiske snitt av surrogater for å kvantifisere antallet kjerneholdige celler pr området. Dette kan brukes som en indikator på endringen i celletallet over tid, eller forandringen i celletallet som følge av varierende vekstbetingelser og behandlinger.
Introduction
Tredimensjonale (3D) kultur modeller som mer nøyaktig etterligner svulsten arkitektur og mikromiljøet in vivo er viktig for studier med sikte å dissekere det komplekse samspillet mellom celler og deres mikromiljøet og for å teste effekten av kandidat terapi. Tumor dimensionality påvirker oksygen og næringsstoffer gradienter, ensartethet av legemiddeleksponering, interstitiell trykk / blodstrøm, og 3D-arkitektur 1-4. Tilstedeværelsen av en passende stromal mikromiljø bidrar til tumor dimensjonalitet og påvirker celle-ECM-signalisering og parakrin signalering mellom stromale celler og maligne epitelceller. Effektene av svulst dimensjonalitet og mikromiljøet på cellular funksjon er godt etablert, med begge faktorer forandre narkotika respons 1,3,5-8. I tillegg cellulære vekstkinetikk, metabolske priser og cellesignalisering skiller mellom todimensjonal (2D) kultur og kultur i 3D, med disse faktorene Affecting cellulær respons 1,3,8-10.
In vitro, kan svulsten surrogat mikromiljøet moduleres ved å ta representative ECM bestanddeler og stromale cellepopulasjoner. Ondartede epitelceller er påvirket av ECM og kreft-assosiert stromale celler enten i en synergistisk / beskyttende måte for å fremme tumorprogresjon eller i en undertrykkende måte for å hemme ytterligere tumorutbredelse 5,6,10. I begge sammenheng kan stroma påvirke behandlingsrespons og legemiddelavlevering via parakrin signalering og / eller ved å øke trykket interstitielt i tumoren som resulterer i redusert medikamentavgivelse 1,6. Derfor vil tilsetning av ECM og stromale celler inn i prekliniske modeller hjelp rekapitulere aspekter av tumor som ikke kan modelleres godt i 2D kultur.
Heri en metode for å etablere brystkreft surrogater som inneholder en recapitulative mikromiljøet, blant annet ECM bestanddeler og stromal celler, i et 3D-volum, er beskrevet. I bryst karsinom, er det stromale cellepopulasjon overveiende består av kreft forbundet fibroblaster (CAF) og stromal ECM er i stor grad består av kollagen type I med en mindre andel av matriks-komponenter som er funnet i basalmembranen, inkludert laminin og kollagen type IV 1,4,11-13. Derfor er disse komponentene av brystkreft mikromiljøet (dvs. CAF, kollagen jeg, og basalmembran) har blitt innarbeidet i surrogater. Denne fremgangsmåten kan brukes til å generere faststoff, un-perfusert 3D surrogater (figur 1A) eller kan tilpasses til å omfatte perfusjon av medium gjennom surrogat via en bioreaktor system (figur 1B). Begge tilnærmingene er beskrevet her. Denne metoden kan også bli modifisert for å inkludere andre stromale elementer, så som tumor-assosierte makrofager, eller for å modellere andre faste tumorer ved å justere de cellulære og ECM-komponenter, etter behov.
<pclass = "jove_content"> For brystcarcinom surrogat er beskrevet her, har vi benyttet MDA-MB-231 (231) brystkreftcellelinje, CAF tidligere isolert fra human brystcarcinoma 14, og en ECM bestående av 90% collagen I ( 6 mg / ml) og 10% vekstfaktor redusert basalmembran materiale (BM). Surrogat enten dyrkes i et 8-brønners kammer sleiden (fast surrogat) eller en bioreaktor systemet benyttes for å tilveiebringe kontinuerlig nærings perfusjon (perfusert surrogat). Enhver perfusjon bioreaktor system som kan romme et volum på ECM som inneholder celler kan brukes 15. Som et eksempel, vil vi beskrive fremstillingen av vev surrogater i vårt system bioreaktor. Dette systemet ble utviklet internt og er ikke kommersielt tilgjengelig. Fordi vårt fokus her er om utarbeidelse og analyse av 3D vev surrogater, vi har ikke gått inn i omfattende detalj om detaljene i produksjon og montering av våre bioreaktor systemet. Imidlertid er en detaljert beskrivelse avsystemet, og dens utvikling har blitt publisert 16. På denne bioreaktor systemet, er en polydimetylsiloksan (PDMS) strømningskanal som brukes til å huse surrogat, som er støttet av en PDMS skum (dannet ved anvendelse av metoder som ligner de beskrevet av Calcagnile et al. 17). Dette volum er gjennomtrengt med 4 mikrokanaler (hver 400 pm i diameter) som er kontinuerlig perfuserte av medium via en microphysiologic pumpe for å tilføre oksygen og næringsstoffer til surrogat.Aktuelle analyse av de surrogater er avgjørende for å oppnå relevant informasjon angående cellulær funksjon i respons til behandling eller andre manipulasjoner. Surrogater kan bli analysert ved forskjellige metoder, inkludert direkte avbildning av intakte surrogater ved hjelp av konfokal mikroskopi eller andre former for ikke-invasiv avbildning, indirekte cellulær analyse ved analysering av kondisjonerte medier, eller perfusatet, for utskilte produkter eller analyse på histologiske snitt etter fiksering og prosessering tilparafin. En slik parameter som kan evalueres på histologiske snitt er celletetthet. Vi presenterer en metode for å måle celletetthet (dvs. antallet kjerneholdige celler pr tverrsnittsarealet) ved hjelp av semi-automatisert bildeprosesseringsteknikker anvendt på mikrofotografier av surrogat histologiske snitt farget med hematoksylin og eosin (H & E). Celletettheten kan bli brukt som en indikator for den relative endringen i celletallet over tid, eller som et resultat av varierende vekstbetingelser og behandlinger.
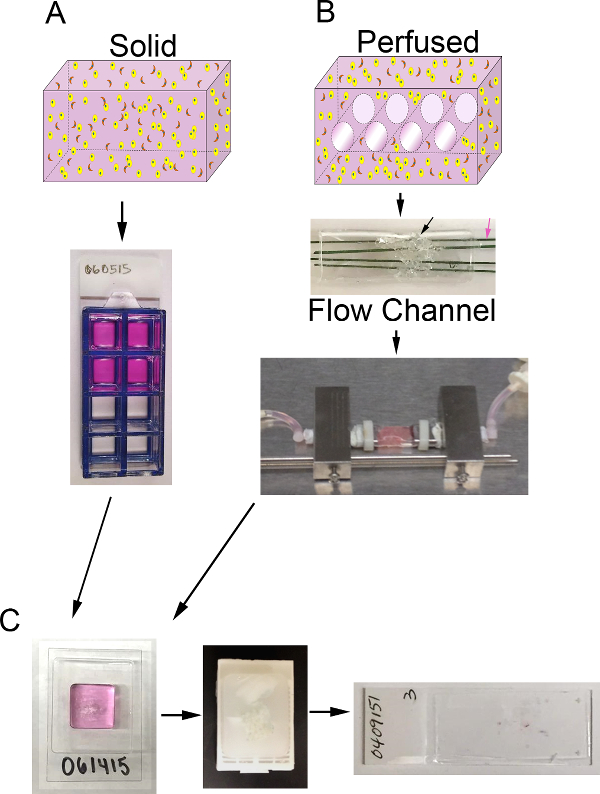
Figur 1. 3D-volum og bioreaktor systemet. A) Skjematisk av prosessen for å generere solide 3D surrogater. Øverst: tegneserie av solid 3D volum som inneholder ECM (rosa), epitelceller carcinoma celler (gul), og CAF (oransje); Bunn:. Ovenfra 8-brønn kammer lysbilde som inneholder surrogater B) Skjematisk av prosessen for å generere dynket 3D surrogater. Top: cartoon av 3D-volumet med kanaler for å tillate medium perfusjon og som inneholder ECM (rosa), epitelceller carcinomceller (gul), og CAF (oransje); Midten: bilde av PDMS strømningskanalen inneholder PDMS skum (svart pil) skal injiseres med celle + ECM og gjennomsyret av polymer-belagt rustfritt ståltråder (rosa pil) som måler 400 mikrometer i diameter; Bunn:. Bildet av PDMS strømningskanal inneholdende et surrogat og koblet til bioreaktoren system for å muliggjøre kontinuerlig medium perfusjon (peristaltisk pumpe og media reservoaret ikke vist) C) bilder fra behandlingstrinn for både faste og perfuserte surrogater etter kultur. Venstre: bilde av cryomold inneholder prøven behandlingen gel og surrogat; Midten: bilde av en parafinblokk som inneholder et fast og behandlet surrogat; Høyre:. Bilde av en glassplate med en H & E-fargede histologisk snitt av en surrogat Klikk her for å vise enstørre versjon av dette tallet.
Protocol
Representative Results
Discussion
Heri, har en fremgangsmåte for 3D-kultur er beskrevet som innbefatter komponenter av vevet mikromiljøet, inkludert den ekstracellulære matriks (ECM) og humane stromale fibroblaster, i et volum som mer nøye modeller human brystcancer for å muliggjøre utvikling av en recapitulative 3D morfologi . 3D dyrkningsmetode som er beskrevet er mer representativt for humane sykdommer enn tradisjonelle 2D cellekultur ved at flere celletyper er inkorporert i et 3D-volum av ECM. Det er blitt bemerket at disse parameterne (dv…
Disclosures
The authors have nothing to disclose.
Acknowledgements
The University of Alabama at Birmingham Center for Metabolic Bone Disease performed the histologic processing and sectioning of surrogates. Southern Research (Birmingham, AL) provided support for the manufacture of the bioreactor system. Funding was provided by the United States Department of Defense Breast Cancer Research Program (BC121367).
Materials
| Dulbecco's Modified Eagel Medium 1x (DMEM) | Corning CellGro | 10-014-CV | |
| Fetal Bovine Serum (FBS) | Atlanta Biologicals | S11150 | |
| 0.25% Trypsin + 2.21 mM EDTA 1x | Corning | 25-053-CI | |
| Tissue Culture plates, 100mm | CellTreat Scientific Products | 229620 | Sterile |
| Tissue Culture plates, 35mm | CellTreat Scientific Products | 229638 | For PDMS foam formation |
| 9" Glass pipette | Fisher | 13-678-20D | Sterile |
| 10 ml pipette | CellTreat Scientific Products | 229210B | Sterile |
| 1000 µl piptette tips | FisherBrand | 02-717-166 | Sterile Filtered |
| 200 µl pipette tips | FisherBrand | 02-717-141 | Sterile Filtered |
| 10 µl pipette tips | FisherBrand | 02-717-158 | Sterile Filtered |
| 15 ml conical tubes | CellTreat Scientific Products | 229410 | Sterile |
| 50 ml conical tubes | CellTreat Scientific Products | 229422 | Sterile |
| 1.5 ml microcentrifuge tubes | FisherBrand | 05-408-129 | Sterile |
| Trypan blue | Corning Cellgro | 25-900-CI | Sterile |
| Sylgard 184 | Electron Microscopy Sciences | 24236-10 | PDMS elastomer and curing agent. Used for our in-house bioreactor. |
| PDMS Foam | Made in-house for use in our in-house bioreactor. | ||
| High Concentration Bovine Collagen Type I | Advanced Biomatrix | 5133-A | FibriCol ~10 mg/mL |
| Growth Factor Reduced Matrigel (Basement Membrane) | Corning | 354230 | Basement membrane material |
| Sodium Bicarbonate | Sigma | S8761 | |
| Molecular Biology Grade Water | Fisher | BP2819-1 | |
| DMEM 10x | Sigma-Aldrich | D2429 | |
| Nunc Lab-Tek Chamber Slide System | Thermo Scientific | 177402 | 8-well |
| Bioreactor | Made in-house. | ||
| Spring-Back 304 Stainless Steel—Coated with PTFE polymer | McMaster-Carr | 1749T19 | Stainless steel wires to generate microchannels in our in-house bioreactor system. 0.016" Diameter |
| BioPharm Plus platinum-cured silicone pump tubing, L/S 14 | Masterflex | EW-96440-14 | For use in our in-house bioreactor system. Tubing ID: 1.6 mm, Hose barb size: 1/16 in. |
| 2-Stop Tubing Sets, non-flared PVC, 1.52 mm ID | Cole-Parmer | EW-74906-36 | For use in our in-house bioreactor system (with microperistalitic pump). |
| Six Channel precision micro peristaltic pump | Cole-Parmer | EW-74906-04 | For use with our in-house bioreactor system |
| Labtainer BPC Bag – 2 Ports, Luer Lock 50mL |
Thermo Scientific | SH3065711 | Example Media Reservoir |
| Tuberculin Syringes | BD Medical | 309625 | 26 gauge 3/8 in. needle; Sterile |
| Dissecting Tissue Forceps | FisherBrand | 13-812-36 | 5.5 inch |
| Mini Tube Rotator | Boekel Scientific | 260750 | Equipment option for surrogate rotation. Used with carousel for 50 ml tubes (model number 260753) |
| 50 ml tube carousel | Boekel Scientific | 260753 | Used with mini tube rotator |
| Bambino Hybridization Oven | Boekel Scientific | 230301 | Equipment option for surrogate rotation |
| HistoGel Specimen Processing Gel | Thermo Scientific | HG-4000-012 | Specimen Processing Gel described in Step 5.2 |
| Cryomold | Andwin Scientific | 4566 | 15 mm x 15 mm x 5 mm |
| Tissue Marking Dye | Cancer Diagnostics, inc. | 03000P | Can be used to mark surrogates, allowing multiple samples to be included in one tissue cassette |
| Hinged tissue cassettes | FisherBrand | 22-272-416 | |
| Formalin | Fisher | 23-245-685 | |
| GoldSeal Plain Glass Slides | Thermo Scientific | 3048-002 | |
| Xylene | Fisher | X3P-1GAL | |
| Ethanol, 200 proof (100%), USP | Decon Laboratories, Inc. | 2805M | |
| Hematoxylin | Thermo Scientific Richard-Allan Scientific | 7211 | |
| Clarifier | Thermo Scientific Richard-Allan Scientific | 7401 | |
| Bluing Solution | Thermo Scientific Richard-Allan Scientific | 7301 | |
| Eosin Y | Thermo Scientific Richard-Allan Scientific | 7111 | |
| Cytoseal XYL mounting media | Thermo Scientific Richard-Allan Scientific | 83124 | |
| Coverslips | Fisher Scientific | 12-548-5G |
References
- Hakanson, M., Textor, M., Charnley, M. Engineered 3D environments to elucidate the effect of environmental parameters on drug response in cancer. Integr Biol (Camb). 3 (1), 31-38 (2011).
- Horning, J. L., et al. 3-D tumor model for in vitro evaluation of anticancer drugs. Mol Pharm. 5 (5), 849-862 (2008).
- Dhiman, H. K., Ray, A. R., Panda, A. K. Three-dimensional chitosan scaffold-based MCF-7 cell culture for the determination of the cytotoxicity of tamoxifen. Biomaterials. 26 (9), 979-986 (2005).
- Place, A. E., Jin Huh, S., Polyak, K. The microenvironment in breast cancer progression: biology and implications for treatment. Breast Cancer Res. 13 (6), 227 (2011).
- Mao, Y., Keller, E. T., Garfield, D. H., Shen, K., Wang, J. Stromal cells in tumor microenvironment and breast cancer. Cancer Metastasis Rev. 32 (1-2), 303-315 (2013).
- Paulsson, J., Micke, P. Prognostic relevance of cancer-associated fibroblasts in human cancer. Semin Cancer Biol. 25, 61-68 (2014).
- Roskelley, C. D., Desprez, P. Y., Bissell, M. J. Extracellular matrix-dependent tissue-specific gene expression in mammary epithelial cells requires both physical and biochemical signal transduction. Proc. Natl. Acad. Sci. 91, 12378-12382 (1994).
- Pickl, M., Ries, C. H. Comparison of 3D and 2D tumor models reveals enhanced HER2 activation in 3D associated with an increased response to trastuzumab. Oncogene. 28 (3), 461-468 (2008).
- Ivascu, A., Kubbies, M. Rapid generation of single-tumor spheroids for high-throughput cell function and toxicity analysis. J Biomol Screen. 11 (8), 922-932 (2006).
- Lovitt, C. J., Shelper, T. B., Avery, V. M. Advanced cell culture techniques for cancer drug discovery. Biology (Basel). 3 (2), 345-367 (2014).
- Bergamaschi, A., et al. Extracellular matrix signature identifies breast cancer subgroups with different clinical outcome. J Pathol. 214 (3), 357-367 (2008).
- Oskarsson, T. Extracellular matrix components in breast cancer progression and metastasis. The Breast. 22, S66-S72 (2013).
- Kelley, L. C., Lohmer, L. L., Hagedorn, E. J., Sherwood, D. R. Traversing the basement membrane in vivo: A diversity of strategies. JBC. 204 (3), 291-301 (2014).
- Sadlonova, A., et al. Breast fibroblasts modulate epithelial cell proliferation in three-dimensional in vitro co-culture. Breast Cancer Res. 4, (2004).
- Wendt, D., Marsano, A., Jakob, M., Heberer, M., Martin, I. Oscillating perfusion of cell suspensions through three-dimensional scaffolds enhances cell seeding efficiency and uniformity. Biotechnol Bioeng. 84 (2), 205-214 (2003).
- Marshall, L. E., et al. Flow-perfusion bioreactor system for engineered breast cancer surrogates to be used in preclinical testing. J Tissue Eng Regen Med. , (2015).
- Calcagnile, P., Fragouli, D., Mele, E., Ruffilli, R., Athanassiou, A. Polymeric foams with functional nanocomposite cells. RSC Adv. 4, 19177-19182 (2014).
- Naba, A., Clauser, K. R., Lamar, J. M., Carr, S. A., Hynes, R. O. Extracellular matrix signatures of human mammary carcinoma identify novel metastasis promoters. eLife. 3, (2014).
- Lochter, A., Bissell, M. J. Involvement of extracellular matrix constituents in breast cancer. Semin Cancer Biol. 6 (3), 165-173 (1995).
- Joiner, K. S., Spangler, E. A. Evaluation of HistoGel-embedded specimens for use in veterinary diagnostic pathology. J Vet Diagn Invest. 24 (4), 710-715 (2012).
- Varsegi, G. M., Shidham, V. Cell Block Preparation from Cytology Specimen with Predominance of Individually Scattered Cells. J Vis Exp. (29), e1316 (2009).
- Sadlonova, A., et al. Human Breast Fibroblasts Inhibit Growth of the MCF10AT Xenograft Model of Proliferative Breast Disease. Am J Pathol. 170 (3), (2007).
- Otali, D., He, Q., Stockard, C. R., Grizzle, W. E. Preservation of immunorecognition by transferring cells from 10% neutral buffered formalin to 70% ethanol. Biotech Histochem. 88, 170-180 (2013).
- Webster, S. S., Jenkins, L., Burg, K. J. L. Histological Techniques for Porous, Absorbable, Polymeric Scaffolds, Used in Tissue Engineering. J Histotechnol. 26 (1), 57-65 (2003).
- Troy, T. -. C., Arabzadeh, A., Enikanolaiye, A., Lariviere, N., Turksen, K. Immunohistochemistry on Paraffin Sections of Mouse Epidermis Using Fluorescent Antibodies. J Vis Exp. (11), (2008).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Kwon, Y. -. J., et al. Gli1 enhances migration and invasion via up-regulation of MMP-11 and promotes metastasis in ERa negative breast cancer cell lines. Clin Exp Metastasis. (28), (2011).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for Immunohistochemistry on Cryosectioned Rat Brain Tissue: Example Staining for Microglia and Neurons. J Vis Exp. (99), e52293 (2015).
- Pal, A., Kleer, C. G. Three dimensional cultures: a tool to study normal acinar architecture vs. malignant transformation of breast cells. J Vis Exp. (86), e51311 (2014).
- Hasselbach, L. A., et al. Optimization of High Grade Glioma Cell Culture from Surgical Specimens for Use in Clinically Relevant Animal Models and 3D Immunochemistry. J Vis Exp. (83), e51088 (2014).
- Foty, R. A Simple Hanging Drop Cell Culture Protocol for Generation of 3D Spheroids. J Vis Exp. (51), e2720 (2011).
- Materne, E. -. M., et al. The Multi-organ Chip – A Microfluidic Platform for Long-term Multi-tissue Coculture. J Vis Exp. (98), e52526 (2015).
- Sadlonova, A., et al. Identification of Molecular Distinctions Between Normal Breast-Associated Fibroblasts and Breast Cancer-Associated Fibroblasts. Cancer Microenviron. 2, 9-21 (2009).
- Wang, J. D., Douville, N. J., Takayama, S., ElSayed, M. Quantitative analysis of molecular absorption into PDMS microfluidic channels. Ann Biomed Eng. 40 (9), 1862-1873 (2012).
- Halldorsson, S., Lucumi, E., Gomez-Sjoberg, R., Fleming, R. M. Advantages and challenges of microfluidic cell culture in polydimethylsiloxane devices. Biosens Bioelectron. 63, 218-231 (2015).
- Regehr, K. J., et al. Biological implications of polydimethylsiloxane-based microfluidic cell culture. Lab Chip. 9 (15), 2132-2139 (2009).
- Burdett, E., Kasper, F. K., Mikos, A. G., Ludwig, J. A. Engineering tumors: a tissue engineering perspective in cancer biology. Tissue Eng Part B Rev. 16 (3), 351-359 (2010).
- Caruso, R. A., et al. Mechanisms of coagulative necrosis in malignant epithelial tumors (Review). Oncol Lett. 8 (4), 1397-1402 (2014).
- Elmore, S. Apoptosis: A Review of Programmed Cell Death. Toxicol Pathol. 35 (4), 495-516 (2007).
- Majno, G., Joris, I. Apoptosis, oncosis, and necrosis. An overview of cell death. Am J Pathol. 146 (1), 3-15 (1995).
- Ogino, S., et al. Molecular pathological epidemiology of epigenetics: emerging integrative science to analyze environment, host, and disease. Mod Pathol. 26 (4), 465-484 (2013).
- Otali, D., et al. Combined effects of formalin fixation and tissue processing on immunorecognition. Biotech Histochem. 84 (5), 223-247 (2009).

