की प्रतिक्रिया रिकॉर्डिंग Intracellular वोल्टेज के लिए electrophysiological विधि<em> ड्रोसोफिला</em> फोटोरिसेप्टर और लाइट उत्तेजनाओं को इन्तेर्नयूरोंस<em> Vivo</em
Summary
Sharp microelectrodes enable accurate electrophysiological characterization of photoreceptor and visual interneuron output in living Drosophila. Here we show how to use this method to record high-quality voltage responses of individual cells to controlled light stimulation. This method is ideal for studying neural information processing in insect compound eyes.
Abstract
Voltage responses of insect photoreceptors and visual interneurons can be accurately recorded with conventional sharp microelectrodes. The method described here enables the investigator to measure long-lasting (from minutes to hours) high-quality intracellular responses from single Drosophila R1-R6 photoreceptors and Large Monopolar Cells (LMCs) to light stimuli. Because the recording system has low noise, it can be used to study variability among individual cells in the fly eye, and how their outputs reflect the physical properties of the visual environment. We outline all key steps in performing this technique. The basic steps in constructing an appropriate electrophysiology set-up for recording, such as design and selection of the experimental equipment are described. We also explain how to prepare for recording by making appropriate (sharp) recording and (blunt) reference electrodes. Details are given on how to fix an intact fly in a bespoke fly-holder, prepare a small window in its eye and insert a recording electrode through this hole with minimal damage. We explain how to localize the center of a cell’s receptive field, dark- or light-adapt the studied cell, and to record its voltage responses to dynamic light stimuli. Finally, we describe the criteria for stable normal recordings, show characteristic high-quality voltage responses of individual cells to different light stimuli, and briefly define how to quantify their signaling performance. Many aspects of the method are technically challenging and require practice and patience to master. But once learned and optimized for the investigator’s experimental objectives, it grants outstanding in vivo neurophysiological data.
Introduction
फल मक्खी (ड्रोसोफिला मेलानोगास्टर) परिसर आंख तंत्रिका की छवि नमूना और प्रसंस्करण के लिए फोटोरिसेप्टर और interneuron सरणियों के कार्यात्मक संगठन जांच के लिए एक महान मॉडल प्रणाली है, और पशुओं के दर्शन के लिए। प्रणाली सबसे पूरा तारों आरेख 1,2 है और आनुवंशिक जोड़तोड़ और 3-10 (उच्च संकेत करने वाली शोर अनुपात और समय-संकल्प का) सटीक तंत्रिका गतिविधि की निगरानी करने के लिए मिलनसार है।
ड्रोसोफिला आंख युक्त ~ 750 कदाचित नियमित लेंस से ढकी संरचनाओं ommatidia कहा जाता है, जो एक साथ एक मनोरम दृश्य क्षेत्र है कि उसके सिर के चारों ओर लगभग हर दिशा को शामिल किया उड़ प्रदान मॉड्यूलर है। आंख की प्राथमिक जानकारी के नमूने इकाइयों इसकी rhabdomeric फोटोरिसेप्टर 7,8,11 हैं। प्रत्येक ommatidium आठ फोटोरिसेप्टर कोशिकाओं (R1-R8), जो एक ही पहलू लेंस का हिस्सा है, लेकिन सात अलग अलग दिशाओं के लिए गठबंधन कर रहे होते हैं। नदीम बाहरी फोटोरिसेप्टर R1-R6 की गिरफ्तारीई नीले-हरे रंग की रोशनी के लिए सबसे अधिक संवेदनशील, भीतरी कोशिकाओं R7 और R8, जो एक दूसरे के और एक ही दिशा की ओर इशारा करने शीर्ष पर झूठ का वर्णक्रम संवेदनशीलता, प्रदर्शनी तीन विशिष्ट उपप्रकार: पीला, पीले और पृष्ठीय रिम क्षेत्र (नाटकीय) 12 15।
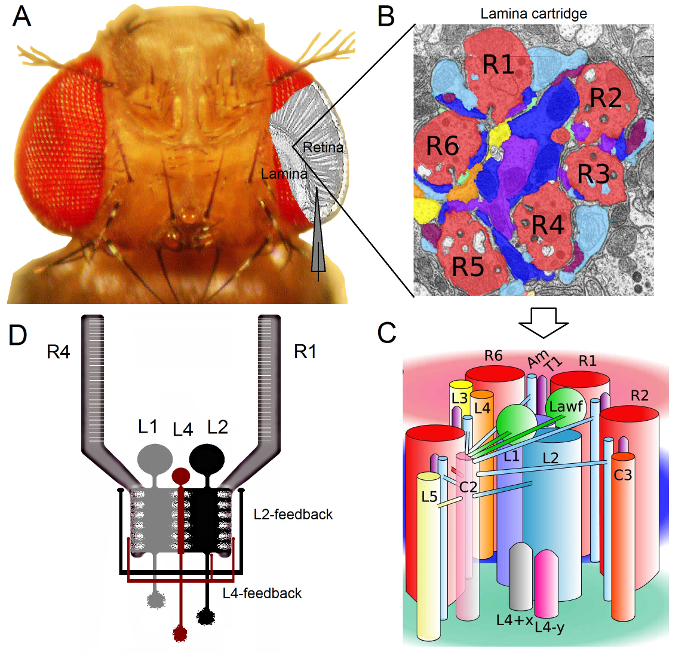
चित्रा 1. ड्रोसोफिला आँखों के कार्यात्मक संगठन। (क) दो पहला ऑप्टिक गैन्ग्लिया, रेटिना और पटल, मक्खी आंख के अंदर ग्रे में डाला जाता है। रेटिना R1-R6 फोटोरिसेप्टर और पटल बड़े Monopolar कोशिकाओं (LMCS: एल 1-L3) आसानी से पारंपरिक तेज microelectrode रिकॉर्डिंग करने के लिए विवो में पहुंच रहे हैं। योजनाबद्ध इलेक्ट्रोड रेटिना में R1-R6 से रिकॉर्ड करने के लिए सामान्य पथ प्रकाश डाला गया। एक पथ पटल में LMCS से रिकॉर्ड करने के लिए समानांतर इलेक्ट्रोड में बदलाव करने के लिए छोड़ दिया है। (बी) लामिना retinotopically अंग की एक मैट्रिक्स हैized कारतूस, जिनमें से प्रत्येक न्यूरॉन्स कि दृश्य अंतरिक्ष में एक विशिष्ट छोटे से क्षेत्र से जानकारी प्रक्रियाओं के साथ पैक किया जाता है। तंत्रिका superposition के कारण, विभिन्न पड़ोसी ommatidia से छह फोटोरिसेप्टर एक ही पटल कारतूस करने के लिए उनके एक्सोन (R1-R6) भेजने के लिए, एल 1-L3 और एक amacrine सेल (एएम) को histaminergic उत्पादन synapses के गठन। (सी) R1-R6 अक्षतंतु टर्मिनल और (L4, L5, Lawf, सी 2, सी 3 और T1 सहित), अंदर एक पटल कारतूस जटिल है दृश्य इन्तेर्नयूरोंस के बीच तंत्रिका जानकारी के प्रसार। (डी) R1-R6 फोटोरिसेप्टर एक्सोन एल 2 और L4 Monopolar कोशिकाओं से synaptic फीडबैक प्राप्त करते हैं। (बी) और (सी) रिवेरा-अल्बा एट अल 2 से संशोधित किया। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
ड्रोसोफिला आंख तंत्रिका superposition प्रकार 16 वर्ष की है। यह टी का मतलबपटल और मज्जा: टोपी पड़ोसी ommatidia सात से संबंधित आठ फोटोरिसेप्टर है, जो अंतरिक्ष में एक ही बिंदु पर देखो के तंत्रिका संकेतों, अगले दो neuropils में एक तंत्रिका कारतूस पर एक साथ जमा कर रहे हैं। छह बाहरी फोटोरिसेप्टर R1-R6 परियोजना पटल में तंत्रिका स्तंभों के लिए अपने अक्षतंतु टर्मिनलों (चित्रा 1), R7 और R8 कोशिकाओं को इस परत को बायपास और उनके मज्जा स्तंभ 17-19 इसी के साथ synaptic संपर्क बनाने हैं। ये सटीक वायरिंग, मक्खी जल्दी दर्शन के retinotopic मानचित्रण के लिए तंत्रिका सब्सट्रेट का उत्पादन हर पटल (आंकड़े 1 ए सी) जिस और मज्जा स्तंभ (कारतूस) अंतरिक्ष में एक बिंदु का प्रतिनिधित्व करता है।
पटल 1,2,20 में और amacrine सेल (एएम): R1-R6 फोटोरिसेप्टर से प्रत्यक्ष आदानों बड़े Monopolar कोशिकाओं (एल 1, एल 2 और L3 LMCS) से प्राप्त कर रहे हैं। इनमें से एल 1 और एल 2 सबसे बड़ा कोशिकाओं, प्रमुख सूचना रास्ते (चित्रा -1) मध्यस्थता, whi हैंचर्चा का जवाब ऑन और ऑफ चलती किनारों, और इस तरह प्रस्ताव डिटेक्टर 21,22 के कम्प्यूटेशनल आधार बनेगी। व्यवहार प्रयोगों चलता है कि मध्यवर्ती इसके विपरीत पर, दो रास्ते की सुविधा के विपरीत दिशाओं की गति धारणा: बैक-टू-सामने एल 1 और एल 2 कोशिकाओं 23,24 में सामने से वापस। कनेक्टिविटी आगे निकलता है L4 न्यूरॉन्स पड़ोसी कारतूस 25,26 के बीच पार्श्व संचार करने में महत्वपूर्ण भूमिका निभा सकते हैं। पारस्परिक synapses ही में स्थित एल 2 और L4 कोशिकाओं और दो आसन्न कारतूस के बीच पाए गए। डाउनस्ट्रीम, प्रत्येक एल 2 सेल और उसके तीन जुड़े L4 कोशिकाओं को एक आम लक्ष्य को उनके axons परियोजना, मज्जा, जहां पड़ोसी कारतूस से जानकारी के लिए माना जाता है में Tm2 न्यूरॉन सामने से वापस गति 27 के प्रसंस्करण के लिए एकीकृत किया जा सके। हालांकि एल 1 न्यूरॉन्स दोनों अंतराल जंक्शनों और synapses के माध्यम से ही कारतूस L2S से इनपुट प्राप्त करते हैं, वे सीधे L4S और इसलिए आसन्न पटल कारतूस से जुड़े नहीं हैं।
<pवर्ग = "jove_content"> R1-R6 फोटोरिसेप्टर एक्सोन के लिए Synaptic फीडबैक एल 2 / L4 सर्किट से संबंधित न्यूरॉन्स द्वारा ही प्रदान की जाती हैं लेकिन न एल 1 मार्ग 1,2 (चित्रा -1)। नदीम ही कारतूस कनेक्शन R1 और R2 के लिए एल 2 से और L4 से R5 करने के लिए चुनिंदा हैं, सभी R1-R6 फोटोरिसेप्टर या तो की L4 या दोनों पड़ोसी कारतूस से synaptic प्रतिक्रिया प्राप्त करते हैं। इसके अलावा, वहाँ आर 1, आर 2, R4 और R5 करने बजे से मजबूत synaptic कनेक्शन हैं, और glia कोशिकाओं को भी synaptically नेटवर्क से जुड़े हैं और इस तरह की तंत्रिका छवि प्रसंस्करण 6 में भाग ले सकते हैं। अंत में, axonal अंतराल जंक्शनों, पड़ोसी R1-R6 और R6 और R7 / R8 के बीच फोटोरिसेप्टर पटल में जोड़ने, एक कारतूस 14,20,28 में असममित जानकारी प्रतिनिधित्व और प्रसंस्करण के लिए योगदान करते हैं।व्यक्तिगत फोटोरिसेप्टर और लगभग बरकरार ड्रोसोफिला में दृश्य इन्तेर्नयूरोंस से intracellular वोल्टेज रिकॉर्डिंग उच्च संकेत करने वाली शोर आर प्रदानउप millisecond संकल्प 3,5,7-10,29, जो लॉग इन न्यूरॉन्स के बीच तेजी से तंत्रिका संगणना की भावना बनाने के लिए आवश्यक है पर Atio डेटा। 100 मिसे संकल्प – परिशुद्धता के इस स्तर मौजूदा ऑप्टिकल इमेजिंग तकनीक है, जो काफी noisier कर रहे हैं और आम तौर पर 10 से कम काम से असंभव है। इसके अलावा, क्योंकि इलेक्ट्रोड बहुत छोटे और तेज सुझाव दिया है, विधि सेल शरीर के लिए ही सीमित नहीं है, लेकिन छोटे सक्रिय तंत्रिका संरचनाओं से प्रत्यक्ष रिकॉर्डिंग प्रदान कर सकते हैं; ऐसे LMCS 'वृक्ष के समान पेड़ या फोटोरिसेप्टर एक्सोन, जो पैच दबाना इलेक्ट्रोड का बहुत बड़ा युक्तियाँ तक नहीं पहुँचा जा सकता है। महत्वपूर्ण बात है, विधि भी संरचनात्मक रूप से कम आक्रामक और सबसे पैच दबाना अनुप्रयोगों से भी हानिकारक है, और इसलिए कम से अध्ययन 'कोशिकाओं intracellular परिवेश और जानकारी नमूने प्रभावित करता है। इस प्रकार, पारंपरिक तेज microelectrode तकनीक योगदान दिया है, और तंत्रिका सूचनाओं में योगदान, मौलिक खोजों और मूल अंतर्दृष्टि पर रखउचित समय के पैमाने पर सूचना प्रसंस्करण; दृष्टि 3-10 के बारे में हमारी समझ को यंत्रवत में सुधार।
यह लेख बताते हैं कि कैसे ड्रोसोफिला R1-R6 फोटोरिसेप्टर और LMCS से विवो intracellular रिकॉर्डिंग में Juusola प्रयोगशाला में प्रदर्शन कर रहे हैं। इस प्रोटोकॉल, कैसे एक उपयुक्त इलेक्ट्रोफिजियोलॉजी रिग का निर्माण करने का वर्णन मक्खी तैयार है, और रिकॉर्डिंग प्रदर्शन करेंगे। कुछ प्रतिनिधि डेटा प्रस्तुत किया जाता है, और कुछ सामान्य मुद्दों और संभावित समाधानों पर चर्चा की जाती है कि जब इस पद्धति का उपयोग सामना हो सकता है।
Protocol
Representative Results
Discussion
We have presented the basic key steps of how to use sharp conventional microelectrodes to record intracellular responses of R1-R6 photoreceptors and LMCs in intact fly eyes. This method has been optimized, together with bespoke hardware and software tools, over the last 18 years to provide high-quality long-lasting recordings to answer a wide range of experimental questions. By investing time and resources to construct robust and precise experimental set-ups, and to produce microelectrodes with favorable electrical properties, high-quality recordings can become the norm in any laboratory working on Drosophila visual neurophysiology. Whilst well-designed recording and light stimulation systems are important for swift execution of different experimental paradigms, there are three procedural steps that are even more critical to achieving successful recordings: (i) to make the fly preparation with minimal eye damage, (ii) to pull microelectrodes with the right electrical properties, and (iii) to drive the recording electrode into the eye without breaking its tip. Ultimately, to record meaningful data, the investigator has to understand the physical basis of electrophysiology and how to fabricate suitable microelectrodes for the targeted cell-types.
Therefore, the limitations of this technique are primarily set by the patience, experience and technical ability of the investigator. Because this technique can take a long time to master for small Drosophila cells, it is advisable for trainee electrophysiologists to first practice with larger insect eyes, such as the blowfly36 or locust35, using the same rig. Once performing high-quality intracellular recordings from the larger photoreceptors and interneurons becomes routine, it is time to move on to the Drosophila eye. Another limitation of the technique concerns cellular identification. Penetrated Drosophila cells can be loaded electrophoretically with dyes, including Lucifer yellow or neurobiotin. However, because of the small tip size of the microelectrodes, electrophoresis works less efficiently than with lower resistance electrodes, such as patch-electrodes. Furthermore, the dye-filled microelectrodes characteristically have less favorable electrical properties, making it much harder to record high-quality responses with them from Drosophila photoreceptors and LMCs.
A technical problem that occurs sometimes is unstable input signal, or a complete lack of it. This is often associated with the voltage signal being either constantly drifting or higher/lower than the amplifier’s recording range. On most occasions, this behavior is caused by the recording electrode being blocked (or its tip being too fine – having too high a resistance or intramural capacitance – to properly conduct fast signal changes). Although one can try to unblock the tip by buzzing the electrode capacitance, which sometimes works, often the situation is best resolved by simply changing the recording electrode. This may further require parameter adjustments in the microelectrode puller instrument to lower the tip resistance of the new electrodes. The electrode tip can also become blocked in preparations, for which it took too much time to cover the corneal hole by petroleum jelly. Prolonged air-contact can dry up the freshly exposed retinal tissue, turning its surface layer into a glue-like substance. If this is the case, the investigator typically sees a red blob of tissue stuck on the recording electrode when pulling it out of the eye. The only solution here is to make a new preparation. Petroleum jelly may provide many benefits for electrophysiological recordings: (i) it prevents the coagulation of the hemolymph that could break the electrode tip; (ii) it coats the electrode tip reducing its intramural capacitance, which lowers the electrode’s time constant, and thus has the potential to improve the temporal resolution of the recorded neural signals40,41; (iii) it keeps the electrode tip clean, facilitating penetrations; and after penetration, (iv) it may even help to seal the electrode tip to the cell membrane42.
The signal can further be unstable or lost when the silver-chloride wire of the electrode-holder is broken or dechloridized; in which case just replace or rechloridize the old wire. The missing signal can also result from one (or both) of the electrode-holders not being securely connected to their jacks. However, it is extremely unusual that a piece of equipment would be malfunctioning. If signal is undetectable and all other possibilities have been exhausted, test that each part of the recording apparatus, including the headstage, amplifier, low-pass filters and AD/DA-converters, are connected properly and functioning normally. One way to achieve this is to replace each instrument with another from a rig that is known to operate normally. Alternatively, use a signal generator to check the performance of the electronic components one by one.
But perhaps the most common technical problem facing the electrophysiologist is that of recording noise. Broadly, recording noise is the observed electrical activity other than the direct neuronal response to a given stimulus. Because the fly preparation, when properly done, is very stable, the observed noise (beyond the natural variably of the responses) most often results from ground-loops in the recording equipment, or is picked up from nearby electrical devices. Such noise is typically 50/60 Hz mains hum and its harmonics; but sometimes composed of more complex waveforms. To work out the origin of the noise, remove the fly preparation holder from the set-up, connect the recording and reference electrodes through a drop of fly Ringer (or place them in a small Ringer’s solution bath; see step 1.2.6) and record the signal in CC- or bridge-mode. If noise is observable on the recorded signal, this likely means that the noise is external to the fly preparation.
Another good test for identifying the origin of noise is to replace the electrode-holders with an electric cell model connected to the amplifier. In an ideally configured and grounded set-up, the recorded signal should now be practically noise-free, showing only stochastic bit-noise from the AD-converter (in the best case not even that!). If noise is still present, then recheck that all rig equipment is properly grounded. A convenient approach to detect ground-loops is to: (i) disconnect all the grounding wires from all the parts within the rig; (ii) ensure that, after doing this, every single part is actually isolated from ground, by means of an ohm-meter; (iii) connect the parts, one by one, to the central ground directly, not through any other part of the rig. Try also changing the equipment configurations. For example, sometimes moving the computer and monitor further away from the rig can reduce noise; yet at other times, moving the computer inside the equipment rack reduces noise. It is also worth unplugging nearby equipment to see if noise is reduced, or shield additional components. Furthermore, try unplugging or replacing different components of the recording equipment, especially BNC cables (which can have faulty ground connections). If only bit-noise is observed when using the cell model, the initial noise source is either the electrodes or the fly preparation itself. For example, it could be that the reference electrode is inadvertently touching a motor nerve or active muscle fibers inside the head capsule (or disturbing flight muscles in the thorax – if placed there). It is usually simplest to prepare a new fly for recording, taking care to minimize damage to the fly. But if the noise persists and is broadband, it is likely that the electrodes are suboptimal for the experiments; too sharp/fine (hence too noisy) or just wrong for the purpose; we have even seen quartz-electrodes acting as antennas – picking up faint broadcasting signals! Although iteration of the puller-instrument parameter settings to generate the just right microelectrodes for consistent high-quality recordings from specific cell-types can take a lot of effort, it is worth it. Once the recording electrodes are well-tailored for the experiments, they can provide long-lasting recordings of outstanding quality.
Sharp microelectrode recording techniques can be similarly applied to study neural information processing in multitude of preparations, including different processing layers in the insect eyes and brain43,44. Because the microelectrode tips can be made very fine, these typically damage the studied cells less than most patch-clamp applications. Importantly, the modern sample-and-hold microelectrode amplifiers enable good control of the tips’ electrical properties40,45-47. Thus, when correctly applied, this technique can provide reliable data from both in vivo3,5,7-10,44 or in vitro48 preparations with high signal-to-noise ratio at sub-millisecond resolution. Such precision would be impossible with today’s optical imaging techniques, which are noisier and slower. Moreover, the method can be used to characterize small cells’ electrical membrane properties both in current- and voltage-clamp configurations5,29,33,36,40-42,49, providing valuable data for biophysical and empirical modeling approaches7,8,11,33,49-54 that link experiments to theory.
Disclosures
The authors have nothing to disclose.
Acknowledgements
The authors thank Mick Swann, Chris Askham and Martin Gautrey for their important contributions in designing and building many electrical and mechanical components of the rigs. MJ’s current research is supported by the Biotechnology and Biological Sciences Research Council (BBSRC Grant: BB/M009564/1), the State Key Laboratory of Cognitive Neuroscience and Learning open research fund (China), High-End Foreign Expert Grant (China), Jane and Aatos Erkko Foundation Fellowship (Finland), and the Leverhulme Trust grant (RPG-2012-567).
Materials
| Stereo Zoom Microscope for making the fly preparation | Olympus | SZX12 DFPLFL1.6x PF eyepieces: WHN30x-H/22 | Capable of ~150X magnification with long working distance; bespoke heavy steel table mount stand |
| Stereomicroscope in the intracellular set-up | · Olympus | Olympus SZX7; eyepieces: WHN30x-H/22 | 30x eyepieces are needed for seeing the electrode tip reflections well when driving it through the small corneal hole into the eye |
| · Nikon | Nikon SMZ645; eyepieces: C-W30x/7 | ||
| Anti-vibration Table | · Melles Griot | With metric M6 holes on the breadboard | Our bespoke rigs have a large hole drilled through the thick breadboard that lets in the fly preparation platform pole (houses a copper heatsink with electronics) from below |
| · Newport | |||
| Micromanipulators | · Narishige | · Narishige NMN-21 | In our intracellular set-ups, different micromanipulator systems are used for driving the shap recording electrodes into the fly eye. All the listed manipulators are succesfully providing long-lasting stable recordings from Drosophila photoreceptors and LMCs. |
| · Huxley Bertram | · Huxley xyz-axis with fine manual control | ||
| · Sensapex | · Sensapex triple axis | ||
| · Märzhäuser | · Märzhäuser DC-3K with additional x-axis piezo stepper and MS 314 controller | ||
| Magnetic Stands | Any magnetic base with on/off switch will do | For example, to manage cables inside the Faraday cage | |
| Electrode Holders | Harvard Apparatus | ESP/W-F10N | |
| Silver Wire | World Precision Instruments | AGW1510 | 0.3-0.5 mm diameter; needs to be chloridized for the electrode holders |
| Fiber Optic Light Source | Many different, including Olympus | ||
| Fiber Optic Bundles | · UltraFine Technology | To deliver the LED light stimulus to the Cardan arm system. We use both liquid and quartz light guides (range from UV to IR) | |
| · Thorn Labs | |||
| Fly Cathing Tube | P80-50P 50ml Cent. Tube PP., Pack of 100 Pcs | Cut the conical bottom off from 50 ml Plastic Centrifuge Tube and glue a 1 ml pipette tip on it. | |
| Digital Acquisition System | National Instruments | ||
| Single-electrode current/voltage-clamp microelectrode amplifier | npi SEC-10LX | http://www.npielectronic.de/products/amplifiers/sec-single-electrode-clamp/sec-10lx.html | Outstanding performer! |
| Head-stage | Standard (+/- 150 nA) | For npi SEC-10LX | |
| LED light sources and drivers | · 2-channel OptoLED (Cairn Research Ltd., UK) | Many of our stimulus systems are in-house built | |
| · Self-designed and constructed | |||
| Acquisition and Analyses Software | Many companies to choose from | Biosyst; custom written Matlab-based system for experimental and theoretical work in the Juusola laboratory | |
| Personal Computer or Mac | Ensure that PC or Mac is compatible with data acquisition system and software | ||
| Cardan arm system | Self-designed and constructed | Providing accurate x,y,z-positioning of the light stimuli | |
| Peltier temperature control system | Self-designed and constructed | ||
| Faraday Cage | Self-constructed | Electromagnetic noise shielding | |
| Filamented Borosilicate Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5-0.7 mm | |||
| Filamented Quartz Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5-0.7 mm | |||
| Pipette Puller | Sutter Instrument Company | Model P-2000 laser Flaming/Brown Micropipette Puller | For borosilicate reference electrodes, use the preset program #11 (patch electrodes): Heat = 350; Filament = 4; Velocity 36; Delay = 200).1.2.1). For borosilicate recording electrodes, use the preset program #12 (this typically pulls good conventional sharps for photoreceptor recordings): Heat = 355; Filament = 4; Velocity 50; Delay = 225; Pull = 150. For LMC recordings, which require electrodes with finer tips, these values need to be adjusted. For pulling quartz capillaries, P-2000 manual suggests programs for fine tipped microelectrodes. These programs’ preset parameters serve as useful starting points for systematic modifications to generate electrodes with good penetration success and low recording noise. |
| Extracellular Ringer Solution for the reference electrode | Chemicals from Fisher Scientific | 10326390, NaCl 10010310, KCl 10147753, TES 10161800, CaCl2 10159872, MgCl2 10000430, sucrose | See the recipe in the protocol section |
| 3 M KCl solution for filling the filamented recording microelectrode | Salts from Fisher Scientific | 10010310, KCl | |
| Petroleum jelly | Vaselin | ||
| Non-stainless steel razor blades | |||
| Blade holder/breaker | Fine Science Tools By Dumont | 10053-09 | 9 cm |
| Blu-tack | Bostik | Alternatively, use molding clay | |
| Forceps | Fine Science Tools By Dumont | 11252-00 | #5SF (super-fine tips) |
References
- Meinertzhagen, I. A., O’Neil, S. D. Synaptic Organization of Columnar Elements in the Lamina of the Wild-Type in Drosophila-Melanogaster. J Comp Neurol. 305, 232-263 (1991).
- Rivera-Alba, M., et al. Wiring Economy and Volume Exclusion Determine Neuronal Placement in the Drosophila Brain. Curr Biol. 21, 2000-2005 (2011).
- Abou Tayoun, A. N., et al. The Drosophila SK Channel (dSK) Contributes to Photoreceptor Performance by Mediating Sensitivity Control at the First Visual Network. J Neurosci. 31, 13897-13910 (2011).
- Juusola, M., Hardie, R. C. Light adaptation in Drosphila photoreceptors: II. Rising temperature increases the bandwidth of reliable signaling. J Gen Physiol. 117, 27-41 (2001).
- Juusola, M., Hardie, R. C. Light adaptation in Drosophila photoreceptors: I. Response dynamics and signaling efficiency at 25 degrees. C. J Gen Physiol. 117, 3-25 (2001).
- Pantazis, A., et al. Distinct roles for two histamine receptors (hclA and hclB) at the Drosophila photoreceptor synapse. J Neurosci. 28, 7250-7259 (2008).
- Song, Z., Juusola, M. Refractory sampling links efficiency and costs of sensory encoding to stimulus statistics. J Neurosci. 34, 7216-7237 (2014).
- Song, Z., et al. Stochastic, Adaptive Sampling of Information by Microvilli in Fly Photoreceptors. Curr Biol. 22, 1371-1380 (2012).
- Zheng, L., et al. Feedback network controls photoreceptor output at the layer of first visual synapses in Drosophila. J Gen Physiol. 127, 495-510 (2006).
- Zheng, L., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye I Dynamics. Plos One. 4, (2009).
- Hardie, R. C., Juusola, M. Phototransduction in Drosophila. Curr opin neurobiol. 34, 37-45 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35, 827-841 (2002).
- Wernet, M. F., et al. Homothorax switches function of Drosophila photoreceptors from color to polarized light sensors. Cell. 115, 267-279 (2003).
- Wardill, T. J., et al. Multiple Spectral Inputs Improve Motion Discrimination in the Drosophila Visual System. Science. 336, 925-931 (2012).
- Hardie, R. C., Ottoson, D. . Progress in Sensory Physiology. 5, 1-79 (1985).
- Borst, A. Drosophila’s View on Insect Vision. Curr Biol. 19, 36-47 (2009).
- Kirschfeld, K. Die Projektion Der Optischen Umwelt Auf Das Raster Der Rhabdomere Im Komplexauge Von Musca. Exp Brain Res. 3, 248-270 (1967).
- Morante, J., Desplan, C. Photoreceptor axons play hide and seek. Nat Neurosci. 8, 401-402 (2005).
- Fischbach, K. F., Hiesinger, P. R. Optic lobe development. Adv Exp Med Biol. 628, 115-136 (2008).
- Shaw, S. R. Early Visual Processing in Insects. J Exp Biol. 112, 225-251 (1984).
- Joesch, M., Schnell, B., Raghu, S. V., Reiff, D. F., Borst, A. ON and OFF pathways in Drosophila motion vision. Nature. 468, 300-304 (2010).
- Clark, D. A., Bursztyn, L., Horowitz, M. A., Schnitzer, M. J., Clandinin, T. R. Defining the Computational Structure of the Motion Detector in Drosophila. Neuron. 70, 1165-1177 (2011).
- Rister, J., et al. Dissection of the peripheral motion channel in the visual system of Drosophila melanogaster. Neuron. 56, 155-170 (2007).
- Vogt, N., Desplan, C. The first steps in Drosophila motion detection. Neuron. 56, 5-7 (2007).
- Strausfeld, N. J., Braitenberg, V. Compound Eye of Fly (Musca-Domestica) – Connections between Cartridges of Lamina Ganglionaris. Z Vergl Physiol. 70, 95-104 (1970).
- Strausfeld, N. J., Campos-Ortega, J. L4-Monopolar Neuron – Substrate for Lateral Interaction in Visual System of Fly Musca-Domestica (L). Brain Res. 59, 97-117 (1973).
- Takemura, S. Y., et al. Cholinergic Circuits Integrate Neighboring Visual Signals in a Drosophila Motion Detection Pathway. Curr Biol. 21, 2077-2084 (2011).
- Shaw, S. R., Frohlich, A., Meinertzhagen, I. A. Direct Connections between the R7/8 and R1-6 Photoreceptor Subsystems in the Dipteran Visual-System. Cell Tissue Res. 257, 295-302 (1989).
- Wolfram, V., Juusola, M. Impact of rearing conditions and short-term light exposure on signaling performance in Drosophila photoreceptors. J Neurophysiol. 92, 1918-1927 (2004).
- Nikolaev, A., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye II Mechanisms. Plos One. 4, (2009).
- Land, M. F. . Compound eye structure: Matching eye to environment. Adaptive Mechanisms in the Ecology of Vision. , (1999).
- Shannon, C. E. A Mathematical Theory of Communication. At&T Tech J. 27, 379-423 (1948).
- Niven, J. E., et al. The contribution of Shaker K+ channels to the information capacity of Drosophila photoreceptors. Nature. 421, 630-634 (2003).
- Randall, A. S., et al. Speed and sensitivity of phototransduction in Drosophila depend on degree of saturation of membrane phospholipids. J Neurosci. 35, 2731-2746 (2015).
- Faivre, O., Juusola, M. Visual Coding in Locust Photoreceptors. Plos One. 3, e2173 (2008).
- Gonzalez-Bellido, P. T., Wardill, T. J., Juusola, M. Compound eyes and retinal information processing in miniature dipteran species match their specific ecological demands. P Natl Acad Sci USA. 108, 4224-4229 (2011).
- Juusola, M., Kouvalainen, E., Järvilehto, M., Weckström, M. Contrast Gain, Signal-to-Noise Ratio, and Linearity in Light-Adapted Blowfly Photoreceptors. J Gen Physiol. 104, 593-621 (1994).
- Juusola, M., Uusitalo, R. O., Weckstrom, M. Transfer of Graded Potentials at the Photoreceptor Interneuron Synapse. J Gen Physiol. 105, 117-148 (1995).
- Juusola, M., de Polavieja, G. G. The rate of information transfer of naturalistic stimulation by graded potentials. J Gen Physiol. 122, 191-206 (2003).
- Weckstrom, M., Kouvalainen, E., Juusola, M. Measurement of Cell Impedance in Frequency-Domain Using Discontinuous Current Clamp and White-Noise-Modulated Current Injection. Pflug Arch Eur J Phy. 421, 469-472 (1992).
- Juusola, M. Measuring Complex Admittance and Receptor Current by Single Electrode Voltage-Clamp. J Neurosci Meth. 53, 1-6 (1994).
- Juusola, M., Seyfarth, E. A., French, A. S. Rapid coating of glass-capillary microelectrodes for single-electrode voltage-clamp. J Neurosci Meth. 71, 199-204 (1997).
- Haag, J., Borst, A. Neural mechanism underlying complex receptive field properties of motion-sensitive interneurons. Nat Neurosci. 7, 628-634 (2004).
- Rien, D., Kern, R., Kurtz, R. Synaptic transmission of graded membrane potential changes and spikes between identified visual interneurons. Eur J Neurosci. 34, 705-716 (2011).
- Muller, A., et al. Switched single-electrode voltage-clamp amplifiers allow precise measurement of gap junction conductance. Am J Physiol-Cell Ph. 276, C980-C987 (1999).
- Polder, H. R., Swandulla, D., Konnerth, A., Lux, H. D. An Improved, High-Current Single Electrode Current Voltage Clamp System. Pflug Arch Eur J Phy. 402, R35-R35 (1984).
- Richter, D. W., Pierrefiche, O., Lalley, P. M., Polder, H. R. Voltage-clamp analysis of neurons within deep layers of the brain. J Neurosci Meth. 67, 121-131 (1996).
- Juusola, M., French, A. S. The efficiency of sensory information coding by mechanoreceptor neurons. Neuron. 18, 959-968 (1997).
- Vähäsöyrinki, M., Niven, J. E., Hardie, R. C., Weckström, M., Juusola, M. Robustness of neural coding in Drosophila photoreceptors in the absence of slow delayed rectifier K+ channels. J Neurosci. 26, 2652-2660 (2006).
- Friederich, U., Coca, D., Billings, S., Juusola, M. Data Modelling for Analysis of Adaptive Changes in Fly Photoreceptors. Lect Notes Comput Sc. 5863, 34-48 (2009).
- Asyali, M. H., Juusola, M. Use of Meixner functions in estimation of Volterra kernels of nonlinear systems with delay. Ieee T Bio-Med Eng. 52, 229-237 (2005).
- French, A. S., et al. The Dynamic Nonlinear Behavior of Fly Photoreceptors Evoked by a Wide-Range of Light Intensities. Biophys J. 65, 832-839 (1993).
- Juusola, M., French, A. S. Visual acuity for moving objects in first- and second-order neurons of the fly compound eye. J Neurophysiol. 77, 1487-1495 (1997).
- Juusola, M., Weckstrom, M., Uusitalo, R. O., Korenberg, M. J., French, A. S. Nonlinear models of the first synapse in the light-adapted fly retina. J Neurophysiol. 74, 2538-2547 (1995).

