Brug Multi-fluorerede galdesyrer og<em> In vivo</em> Magnetic Resonance Imaging til måling Bile Acid Transport
Summary
Værktøjer til at diagnosticere galdesyre malabsorption og måle galdesyretransport in vivo er begrænsede. En innovativ tilgang med levende dyr beskrives der bruger kombineret proton (1H) plus fluor (19F) magnetisk resonans; denne hidtil ukendte metodik har translationel potentiale til at screene for galdesyre malabsorption i klinisk praksis.
Abstract
Sammen med deres traditionelle rolle som rengøringsmidler, der letter fedt absorption, spirende litteratur indikerer, at galdesyrer er potente signalmolekyler, der påvirker flere organer; de modulerer tarmmotilitet og hormon produktion, og ændre vaskulær tonus, glucosemetabolisme, lipidmetabolisme, og energiudnyttelse. Ændringer i fækale galdesyrer kan ændre tarmen microbiome og fremme kolon patologi herunder cholerrheic diarré og tyktarmskræft. Nøgleregulatorer af fækal galdesyre sammensætning er tyndtarmens Apikal Natrium-afhængig galdesyretransportør (ASBT) og fibroblastvækstfaktor-19 (FGF19). Reduceret udtryk og funktion af ASBT nedsætter tarmens galdesyre up-take. Endvidere in vitro-data tyder på, at nogle FDA-godkendte lægemidler inhiberer ASBT funktion. Mangelfulde FGF19 release øger hepatisk galdesyresyntese og frigivelse i tarmene til niveauer, der overstiger ASBT. Enten ASBT dysfunktion eller FGF19-mangel øger fECAL galdesyrer og kan forårsage kronisk diarré og fremme kolon neoplasi. Desværre, at værktøjer måle galdesyre malabsorption og handlinger lægemidler på galdesyretransport in vivo er begrænsede. For at forstå de komplekse virkninger af galdesyrer er teknikker krævede, at tillade samtidig overvågning af galdesyrer i tarmen og metaboliske væv. Dette førte os til at opfatte en innovativ metode til at måle galdesyretransport i levende dyr ved anvendelse af en kombination af proton (1H) og fluor (19F) magnetisk resonans (MRI). Hidtil ukendte sporstoffer til fluor (19F) -baseret levende dyr MRI blev skabt og afprøvet, både in vitro og in vivo. Styrker af denne fremgangsmåde omfatter manglende eksponering for ioniserende stråling og translationel potentiale for klinisk forskning og praksis.
Introduction
Sammen med deres klassiske rolle som detergenter, der letter fedt absorption fra tarmene, er galdesyrer dukket op som potente signalmolekyler påvirker flere organer ud over dem, der er forbundet med deres enterohepatiske cirkulation 1,2. Ud over at kontrollere deres egen metabolisme, galdesyrer modulerer flere aspekter af gastrointestinal fysiologi (fx tarm motilitet og inkretin hormon produktion, kolon fysiologi, og kræft modtagelighed) og har systemiske virkninger på vaskulær tone, glukose og lipid metabolisme og energiudnyttelse. Mens nogle af disse virkninger medieres i tarmen, andre skyldes postprandiale ændringer i systemiske galdesyre-niveauer, som bemærket i overvægtige patienter eller efter gastrisk bypass kirurgi. For at belyse de komplekse metaboliske virkninger af galdesyrer kræves ny teknologi, der tillader samtidig overvågning af galdesyre-niveauer i forskellige anatomiske rum, i mavetarmkanalen og metabolic væv (lever, bugspytkirtel, skeletmuskulatur og fedt). Indhentning sådan tidsmæssig og geografisk information kræver innovativ teknologi – in vivo imaging ved hjælp af nye galdesyre sporstoffer som beskrevet her er sådan en ny tilgang.
Bile syre sammensætning og fordeling i anatomiske rum reguleres af faktorer, der modulerer deres hepatisk syntese og ileal optagelse, herunder kost, kirurgi, brug af antibiotika og ændringer i tarmfloraen. En vigtig regulator af intestinal galdesyreoptagelse for deres enterohepatiske cirkulation 3 (figur 1) er det ileale Apikal Natrium-afhængig galdesyretransportør (ASBT; SLC10A2). Selvom passiv absorption sker gennem tarmene, ASBT medierer optagelse af 95% af tarm galdesyrer, så normalt er begrænset spild af galdesyrer i afføring. ASBT-deficiente (Slc10a2 – / -) mus har forøget fækale galdesyrer og en formindsket galde acid pool 4.
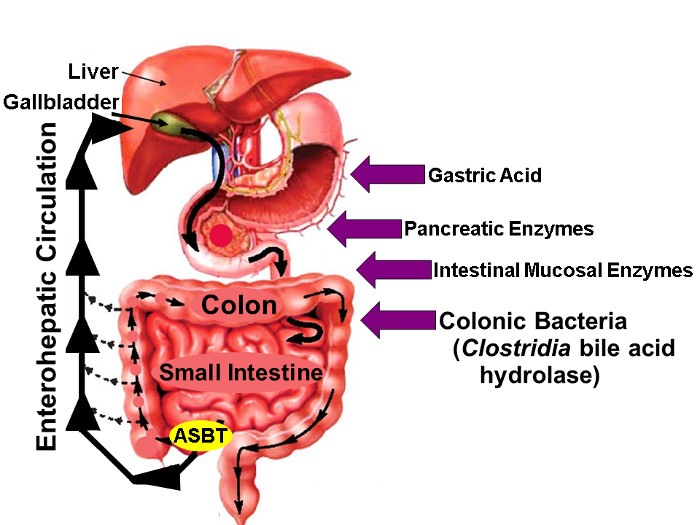
Figur 1: enterohepatiske cirkulation af galdesyrer.
Illustration af enterohepatisk cirkulation, hvorved galdesyrer syntetiseres i leveren, udskilles i Biliær Tree, Opbevaret i galdeblæren, frigives i proksimale Tyndtarmen med Måltider og aktivt taget op via ASBT i distal ileum. Hvorimod små mængder galdesyrer absorberes passivt i hele tarmen, er ca. 95% af intestinale galdesyrer transporteres aktivt af ASBT resulterer i minimal (ca. 5%) tab i afføringen som opvejes af en tilsvarende mængde ny galdesyresyntese i leveren, hvorved en stabil galdesyrebeholdning opretholdelse. Pilene til højre identificere faktorer, der kan påvirke indfødte og fluor-mærket galdesyre stabilitet, herunder mavesyre, pancreas og tarm slimhinder enzymer, og de fleste importantly, hydrolytiske enzymer frigivet af Clostridialt arter, som koloniserer den distale tyndtarm og tyktarmen. (Modificeret med tilladelse 16) Klik her for at se en større version af dette tal.
Galdesyre malabsorption kan kategoriseres i tre typer, som hver især øger fækale dihydroxy galdesyrer og derved forårsage intermitterende eller kronisk diarré. Type 1 resultater fra grov ileum patologi (fx resektion, Crohns sygdom) 5. Type 3 resultater fra kolecystektomi, vagotomi, cøliaki, bakteriel overvækst, og pancreas insufficiens. I modsætning hertil personer med »primær« (type 2) galdesyre malabsorption udgøre en formidabel diagnostisk udfordring, fordi de mangler sådanne forhenværende forhold og ikke har tegn på patologi i ileum. Derfor er primær galdesyre malabsorption almindeligvis fejldiagnosticeret som diarré-predominant irritabel tyktarm (IBS-D), måske den mest almindelige årsag til gastroenterologi-relaterede ambulante besøg. Det er blevet anslået, at en tredjedel af patienterne med IBS-D har primær galdesyre malabsorption; i USA, kan det repræsentere flere millioner personer 5. Nylige resultater tyder, at primær BAM stammer fra nedsat feedback inhibering af hepatisk galdesyresyntese af intestinal fibroblastvækstfaktor-19 (FGF19), ikke fra nedsat ekspression eller funktion af ASBT.
I primær galdesyre malabsorption, lave plasmaniveauer af FGF19 undlader at slukke hepatisk galdesyresyntese – den deraf følgende stigning i tarm galdesyrer mætter galde syre transportører, herunder ASBT og augmented spild af galdesyrer i fæces forårsager diarré 6 (Figur 2). Mus mangelfuld i Fgf15 (murine FGF19) har en udvidet galdesyre pool og øget fækal galdesyrer 7.
<p class= "Jove_content">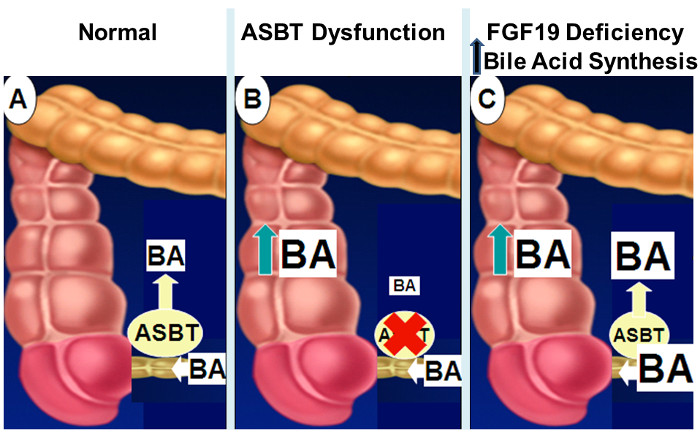
Figur 2: Mekanismer af Intestinal Bile Acid Malabsorption.
Normalt som vist i panel A, er ca. 95% af intestinale galdesyrer absorberes af aktiv transport i distal ileum via ASBT. Når ASBT ekspression eller aktivitet er formindsket (panel B), nedsat intestinal galdesyreoptagelse resulterer i spild af galdesyrer i colon. Med nedsat FGF19 signalering (panel C), manglen på feedback-hæmning af hepatisk galdesyresyntese resulterer i øgede koncentrationer af tarm galdesyrer, der overstiger ASBT transportkapacitet spild af galdesyrer i tyktarmen. Klik her for at se en større udgave af dette tal.
Langsigtet, kronisk forøgelse i fækal galde acids kan fremme kolon neoplasi. Colon neoplasi skyldes progressiv slimhinde dysplasi forbundet med somatiske genmutationer, men miljømæssige faktorer, der øger fecal galdesyrer kan fremskynde og forøge denne proces. Hos gnavere øget fækale galdesyrer enten som følge af exogen administration eller ASBT mangel fremmer kolon dysplasi og tumordannelse 8-10.
Især provokerende resultater viser, at almindeligt anvendte lægemidler, der er godkendt af Food and Drug Administration (FDA) kraftigt inhiberer galde syre transport med ASBT in vitro 11. Hvis disse medikamenter reducerer tyndtarmens galdesyretransport in vivo og øge fecal galde syre niveauer, vil den potentielle indvirkning på tyktarmen patologi være om. Selv en lille stigning i tyktarmen patologi tilskrives brug af et sådant lægemiddel kan have en stor indvirkning sundhed. En værktøjskasse, der kan vurdere sandsynligheden af disse in vitro resultater og epidemiologisk observationer ville anspore yderligere forskning, herunder post-markedsføring.
På trods af behovet, praktiske analyser identificere mennesker med galdesyre malabsorption mangler. Direkte måling af fækale galdesyrer blev afvist år siden som besværlige, upraktisk, og upålidelig fem. Alternative tilgange omfatter måling tilbageholdelse af et radioaktivt selen-mærket cholsyre derivat (75 SeHCAT) og plasmaniveauer af 7α-hydroxy-4-cholesten-3-on (C4), eller et terapeutisk forsøg med galdesyrebindemidler. 75 SeHCAT test har begrænset tilgængelighed i Europa og er ikke FDA-godkendt eller til rådighed til brug i USA selv beskedne stråling eksponering (0,26 mSv / 75 SeHCAT test) fra diagnostisk test giver anledning til bekymring, og bakteriel overvækst og fremskreden leversygdom kan forvirre 75 SeHCAT resultater. C4 test er potentielt attraktiv eftersom kun plasma er påkrævet, men det har lav positiv-prædiktiv value og test er ikke bredt tilgængelige. Måling serumniveauer af FGF19 har lignende begrænsninger. Ofte klinikere ty til en terapeutisk forsøg med galdesyresekvestranter, men denne fremgangsmåde kan ikke give en endelig diagnose af galdesyre malabsorption 5.
Af disse årsager blev en hidtil ukendt MRI fremgangsmåde udtænkt til at måle galdesyre transport og distribution in vivo ved anvendelse af innovative multi-fluorerede galdesyrer (MFBA-MRI). MFBA indeholdende tre atomer af fluor (19F), en stabil isotop af 100% naturlig forekomst, transporteres på samme måde som native galdesyrer 12, og kan anvendes til at visualisere galdesyretransport med en kombination af proton (1H) og fluor ( 19 F) MRI, en følsom, sikker metode uden ioniserende stråling 13,14.
Protocol
Representative Results
Discussion
Syntesen af CA-Lys-TFA og CA-sar-TFMA og in vitro analyse af deres transport, der anvender stabilt transficerede Madin-Darby hunde nyre celler, der udtrykker ASBT og humane embryonale nyreceller udtrykker natrium / taurocholat co-transporterende polypeptid (Ntcp) er detaljeret andetsteds 13,14. Her er der fokus på oral administration af MFBA ved tvangsfodring levende dyr, efterfulgt af høst af galdeblæren, lever og blod til analyse af MFBA indhold, og, især, billeddannelse MFBA i galdeblæren ved…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev støttet af National Institutes of Health, National Institute of Diabetes og Digestive og nyresygdomme (tilskud numre R21 DK093406 og T32 DK067872 til JP.R.) og en VA Merit tildeling (tilskud nummer 1BX002129 til JP.R.).
Materials
| Duall size-21 all glass tissue grinder | Kimble Chase Life Science, Vineland, NJ | 885351-0022 | |
| Bruker BioSpec 70/30USR Avance III 7T horizontal bore MR Scanner | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Bruker 40 mm 19F/1H dual-tuned linerar volume coil | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Waters Acquity UPLC System with Quadrupole Detector | Waters Corporation, Milford, MA | ||
| Waters Acquity UPLC ethylene bridged hybrid C8 1.7 μm 2.1 X 50 mm column | Waters Corporation, Milford, MA | ||
| Gavage Needle | Braintree Scientific, INC. | N-010 | 20 G-1.5" curved 2.25mm ball |
| 2 Stainless Steel Hemostats | VWR | 10755-018 | 4 and 5 inch, straight |
| Ketamine | MWI Veterinary Supply | 501090 | Ketamin zetamine 100 mg / ml |
| Xylazine | Akorn, Inc. | 20 mg/ml | |
| Intraperitoneal Catheter | Abbott | AbbocathTM-T.I.V. G720-A01 4535-42 | 24-G x 0.75" |
References
- Thomas, C., Pellicciari, R., Pruzanski, M., Auwerx, J., Schoonjans, K. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 7, 678-693 (2008).
- Vallim, T. Q., Edwards, P. A. Bile acids have the gall to function as hormones. Cell Metab. 10, 162-164 (2009).
- Dawson, P. A., Karpen, S. J. Thematic Review Series: Intestinal Lipid Metabolism: New Developments and Current Insights Intestinal transport and metabolism of bile acids. Journal of Lipid Research. 56, 1085-1099 (2015).
- Dawson, P. A., et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice. J Biol Chem. 278, 33920-33927 (2003).
- Pattni, S., Walters, J. R. Recent advances in the understanding of bile acid malabsorption. Br Med Bull. 92, 79-93 (2009).
- Walters, J. R., et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid biosynthesis. Clin Gastroenterol Hepatol. 7, 1189-1194 (2009).
- Hofmann, A. F., Mangelsdorf, D. J., Kliewer, S. A. Chronic diarrhea due to excessive bile acid synthesis and not defective ileal transport: a new syndrome of defective fibroblast growth factor 19 release. Clin Gastroenterol Hepatol. 7, 1151-1154 (2009).
- Flynn, C., et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci. Mol Carcinog. 46, 60-70 (2007).
- Glinghammar, B., Rafter, J. Carcinogenesis in the colon: interaction between luminal factors and genetic factors. Eur J Cancer Prev. 8, S87-S94 (1999).
- Bernstein, C., et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch Toxicol. 85, 863-871 (2011).
- Zheng, X., Ekins, S., Raufman, J. P., Polli, J. E. Computational models for drug inhibition of the human apical sodium-dependent bile acid transporter. Mol Pharm. 6, 1591-1603 (2009).
- Vivian, D., et al. Design and characterization of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile Acid transporter activity. Pharm Res. 30, 1240-1251 (2013).
- Vivian, D., et al. Design and evaluation of a novel trifluorinated imaging agent for assessment of bile acid transport using fluorine magnetic resonance imaging. J Pharm Sci. 103, 3782-3792 (2014).
- Vivian, D., et al. In vivo performance of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile acid transport. Mol Pharm. 11, 1575-1582 (2014).
- Raufman, J. P., et al. In Vivo Magnetic Resonance Imaging to Detect Biliary Excretion of 19F-Labeled Drug in Mice. Drug Metab Dispos. 39, 736-739 (2011).
- Ridlon, J. M., Kang, D. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47, 241-259 (2006).
- Frisch, K., et al. N-methyl-11C]cholylsarcosine, a novel bile acid tracer for PET/CT of hepatic excretory function: radiosynthesis and proof-of-concept studies in pigs. J Nucl Med. 53, 772-778 (2012).

