Разведению и двухцепочечную РНК-опосредованный нокдаун гена в Скрыть Beetle,<em> Кожеед пятнистый</em
Summary
Здесь мы представляем протоколы для выращивания в средней зародышевой жука, кожеед пятнистый (D. тасиШиз) в лабораторных условиях . Мы также разделяем протоколы для эмбрионального и родителей RNAi и методы для анализа эмбриональные фенотипы для изучения функции генов у этого вида.
Abstract
Advances in genomics have raised the possibility of probing biodiversity at an unprecedented scale. However, sequence alone will not be informative without tools to study gene function. The development and sharing of detailed protocols for the establishment of new model systems in laboratories, and for tools to carry out functional studies, is thus crucial for leveraging the power of genomics. Coleoptera (beetles) are the largest clade of insects and occupy virtually all types of habitats on the planet. In addition to providing ideal models for fundamental research, studies of beetles can have impacts on pest control as they are often pests of households, agriculture, and food industries. Detailed protocols for rearing and maintenance of D. maculatus laboratory colonies and for carrying out dsRNA-mediated interference in D. maculatus are presented. Both embryonic and parental RNAi procedures-including apparatus set up, preparation, injection, and post-injection recovery-are described. Methods are also presented for analyzing embryonic phenotypes, including viability, patterning defects in hatched larvae, and cuticle preparations for unhatched larvae. These assays, together with in situ hybridization and immunostaining for molecular markers, make D. maculatus an accessible model system for basic and applied research. They further provide useful information for establishing procedures in other emerging insect model systems.
Introduction
В 1998 году , Огонь и Мелло сообщил , что двухцепочечной РНК (дцРНК) может вызывать ингибирование функции генов в Caenorhabditis Элеганс 1. Эта реакция вызвана дсРНК была названа РНК – интерференция (RNAi), и такие RNAi-опосредованной ген глушителей , как сообщалось, сохраняется у животных, растений и грибов 2-7. У растений и некоторых животных, функции RNAi системно, а это означает , что эффект может распространиться на другие клетки / ткани , где дцРНК не непосредственно вводить (обзор в 8-10). Ученые использовали этот эндогенный клеточный ответ RNAi путем разработки дцРНК целевых генов , представляющих интерес, тем самым сбивая функцию гена без прямого манипулирования геном (обзор в 11-14).
RNAi является мощным инструментом для функциональных исследований из-за следующих преимуществ. Во-первых, даже при минимальной информации о последовательности гена, ген может быть направлена с помощью RNAi. Это особенно важно для стudies не-модельных организмов, не имеющих геномные или транскриптомных данных. Во-вторых, в организмах, где ответ РНКи робастно системным, RNAi-опосредованной нокдаун гена может быть выполнен практически в любом стадии развития. Эта функция очень полезна для изучения функции плейотропных генов. В- третьих, в некоторых случаях, RNAi эффекты распространяются на гонады и потомству, таким образом, что фенотипы наблюдаются у потомства 15,16. Это явление, известное как родительская RNAi (pRNAi), особенно выгодно для генов, влияющих на эмбриональное развитие, а многочисленное потомство производится одним закачиваемой родителем может быть рассмотрено без прямого манипулирования яиц. По этим причинам, pRNAi является методом выбора. Тем не менее, если pRNAi неэффективен, например, для генов, необходимых для оогенеза, то эмбриональная RNAi (eRNAi) должен быть использован. В-четвертых, РНК-интерференция может быть использован для создания эквивалент серии аллельного в том, что количество дцРНК поставляется может варьироваться в диапазоне производить слабого до сильного дефектов, Такая градация фенотипов может быть полезным для понимания функции гена, когда ген участвует в сложном процессе и / или полной потере функции летально. В-пятых, поставка дсРНК как правило, легко и практически осуществимо, особенно у животных, показывая надежные системные реакции RNAi. дцРНК могут быть введены путем микроинъекции 1,5, питание / проглатывания 17,18, замачивание, 19,20 и вирус / доставки бактерии опосредованные 21,22. В-шестых, в отличие от некоторых методов нацеливание / редактирования генов, нет необходимости скрининга для организмов, несущих мутацию или проводить генетические кресты для генерации гомозиготы при использовании RNAi. Таким образом, по сравнению со многими другими методами для изучения функции генов, RNAi быстро, недорого, и может быть применен для крупномасштабных экранов 23-25.
Широкая полезность RNAi обеспечивает средства для проведения функциональных исследований в широком диапазоне организмов, расширение спектра видов для изучения beyond традиционные модельные системы, для которых были разработаны генетические инструменты. Например, исследования с использованием не-модельных систем необходимы , чтобы дать понимание эволюции генов и генных сетей путем сравнения функции ортологах из видов , представляющих различные режимы развития или имеющие различные морфологические особенности 26-29. Эти типы исследований обеспечит лучшее понимание биологического разнообразия, с последствиями как для прикладных и фундаментальных исследований.
Будучи крупнейшей группой животных на планете, насекомые предоставляют прекрасную возможность для изучения механизмов, лежащих разнообразия. Кроме того, насекомые, как правило, маленькие, имеют короткие жизненные циклы, высокая плодовитость, и просты в тыл в лаборатории. За последние два десятилетия, RNAi был успешно применен у насекомых , охватывающих заказы, в том числе двукрылых (мух истинные) 5, чешуекрылые (бабочки и моли) 30, жесткокрылые (жуки) 16,31, перепончатокрылых (sawfложь, осы, муравьи и пчелы) 32, Hemiptera (истинные ошибки), Isoptera (термиты) 34, Blattodea (тараканы) 35, прямокрылые (сверчки, кузнечики, саранча, и katydids) 36 и Phthiraptera (вши) 37. Успешное применение RNAi предоставило функциональные данные для исследований в паттернирования раннего эмбриогенеза (передне-задней оси 32, спинным-вентральной оси 28, сегментация 26,38), определение пола 39,40, хитин / кутикулы биосинтез 41, экдизол сигнализации 42, социальное поведение 43, и многое другое. Методы RNAi , разработанные для разных видов насекомых могут иметь дополнительное преимущество в том , что они, вероятно, будут полезны для борьбы с вредителями (обзор 44-46). RNAi эффекты будут Гено-специфические, а также видовой специфичностью, до тех пор, как несохраняющимся регионы выбраны для таргетинга. Для получения полезных видов насекомых, как пчелами и шелкопрядов, ориентированных на гены, жизненно важных для выживаниявирусы или паразиты , чтобы контролировать инфекцию может обеспечить новую стратегию защиты этих видов 47,48.
Кожеед пятнистый (D. тасиШиз), общее название скрыть жук, распространяется по всему миру , за исключением Антарктиды. Как holometabolous насекомое, жизненный цикл D. тасиШиз включает в себя эмбрионального, личиночного, Куколочные и взрослых стадий (рисунок 1). Потому что он питается плотью, D. тасиШиз используется в музеях для скелетируют мертвых животных и судебно – энтомологи могут использовать его , чтобы оценить время смерти 49,50. D. тасиШиз питается продуктами животного происхождения, включая туш, сушеное мясо, сыр и куколок / коконов других насекомых и тем самым наносит ущерб домашним хозяйствам, которые хранятся продукты питания, и шелк, сыр, и мясной промышленности 51,52. Применение RNAi в этом жука может обеспечить эффективный и экологически чистый способ минимизировать его экономические последствия. Наша лаборатория использовала Д. тасиШиз как новый мОдел насекомых для изучения сегментации 53. Помимо того , что поддается лабораторным разведению, D. тасиШиз представляет интерес для фундаментальных исследований , так как он является разработчиком промежуточного росток, что делает его полезным для изучения видов перехода между кратко- и развития долгосрочных ростка.
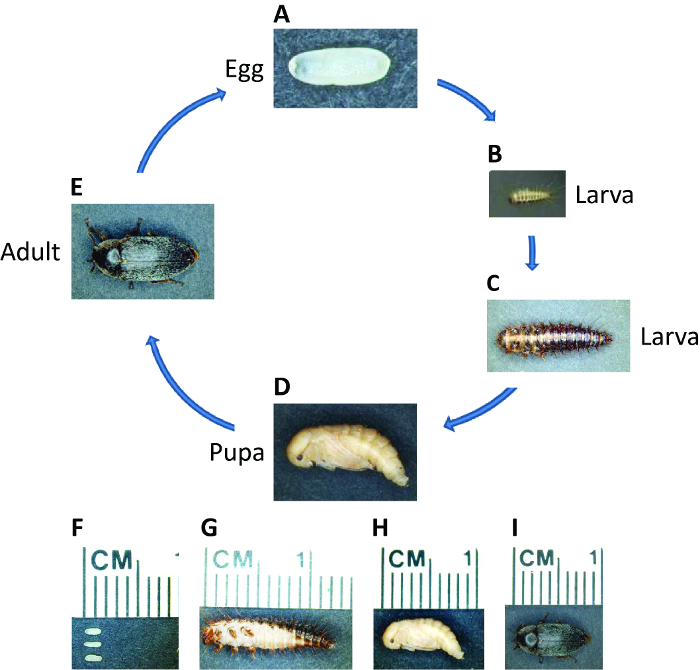
Рисунок 1: Жизненный цикл Д. тасиШиз. Фотографии Д. тасиШиз на разных этапах жизни, как указано. Жизненный цикл от яйца до взрослой особи занимает три недели при 30 ° С, но уже при более низких температурах. (A, F) свежеуложенную эмбрионы от белого до светло – желтого цвета, овальные, около 1,5 мм в длину. Эмибриогенеза ~ 55 часов при 30 ° С. (B, C и G) Личинки имеют темные пигментные полосы и покрыты щетинками. Личинки пройти через несколько возрастах в зависимости от окружающей среды, и их длина может быть увеличен до более чем 1 см. (D, H) </strОнг> Молодые куколки светло-желтые. Окукливание занимает ~ 5 – 7 дней при 30 ° С. (E, I) Вскоре после вылупления, темная пигментация появляется над телом взрослого жука. Взрослые могут жить до нескольких месяцев и одна самка может отложить сотни эмбрионов в течение ее жизни. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Ранее мы показали , что RNAi является эффективным в нокдаун функции гена в D. тасиШиз 53. Вот наш опыт выращивания D. тасиШиз колонии в лаборатории совместно вместе с протоколами шаг за шагом как для эмбрионального и родительского RNAi настройке, инъекции, уход после инъекции, а также анализ фенотипической. ДцРНК-опосредованные нокдаун и методы анализа ген , введенный здесь не только предоставить подробную информацию для решения вопросов в области D. тасиШиз, но также имеют потенциальное значение Foг применение RNAi в других / видов насекомых, не модель Beetle.
Protocol
Representative Results
Discussion
В то время были разработаны небольшое количество сложных модельных систем (мышей, мух, червей) в течение 20 – го века, 21 – й век видел волна новых систем животных , которые разрабатываются в лабораториях по всему миру. Эти новые системы позволяют ученым решать сравнительные, эво…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We thank Drs. Alison Heffer and Yong Lu for setting up the microinjection apparatus and sharing their invaluable knowledge and experience with insect RNAi. This work was supported by the National Institutes of Health (R01GM113230 to L.P.).
Materials
| Dermestes maculatus live beetles | Our lab or Carolina Biological Supply | #144168 | Our lab strain was verified by COI barcoding; strain variation from Carolina cannot be ruled out |
| Wet cat food | Fancy Feast | Chunks of meat with gravy. Can buy at most pet food and grocery stores | |
| Dry dog food | Purina Puppy Chow | Can buy at most pet food and grocery stores | |
| Insect cage (size medium, 30.5x19x20.3 cm) | Exo Terra | PT2260 | For colony maintenance. Can use larger cage if needed |
| Insect cage (size mini, 17.8×10.2×12.7 cm) | Exo Terra | PT2250 | For embryo collection |
| Petri dish | VWR | 89038-968 | |
| Cotton ball | Fisher | 22-456-883 | |
| Megascript T7 transcription kit | Fisher | AM1334 | For 40 reactions |
| Pneumatic pump | WPI | PV830 | |
| Capillary holder | WPI | ||
| Micromanipulator | NARISHIGE | MN-151 | |
| Black filter paper (90 mm) | VWR | 28342-010 | |
| Food coloring (green) | McCormick | ||
| Borosilicate glass capillary | Hilgenberg | 1406119 | |
| Needle puller (micropipette puller) | Sutter Instrument Co. | P-97 | |
| Microscope glass slide | WorldWide Life Sciences Division | 41351157 | |
| Sealing film (Parafilm M) | Fisher | 13-374-12 | |
| Model 801 Syringe (10 µl ) | Hamilton | 7642-01 | |
| Needle (32-gauge) | Hamilton | 7762-05 | |
| Fixation Solution (Pampel's) | BioQuip Products, Inc. | 1184C | Toxic, needs to be handled in fume hood |
| Forcep (DUMONT #5) | Fine Science Tools | 11252-30 | |
| Cover slip (24X50 mm, No. 1.5) | Globe Scientific | 1415-15 | |
| Eppendorf Femtotips Microloader pipette tip | Fisher | E5242956003 | |
| Dissecting microscopy for embryo injection | Leica | M420 | |
| Dissecting microscopy for larval phenotypic visualization | Zeiss | SteREO Discover. V12 | |
| DIC microscopy | Zeiss | AXIO Imager. M1 | |
References
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Wianny, F., Zernicka-Goetz, M. Specific interference with gene function by double-stranded RNA in early mouse development. Nat Cell Biol. 2, 70-75 (2000).
- Svoboda, P., Stein, P., Hayashi, H., Schultz, R. M. Selective reduction of dormant maternal mRNAs in mouse oocytes by RNA interference. Development. 127, 4147-4156 (2000).
- Zimmermann, T. S., et al. RNAi-mediated gene silencing in non-human primates. Nature. 441, 111-114 (2006).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95, 1017-1026 (1998).
- Cogoni, C., et al. Transgene silencing of the al-1 gene in vegetative cells of Neurospora is mediated by a cytoplasmic effector and does not depend on DNA-DNA interactions or DNA methylation. EMBO J. 15, 3153-3163 (1996).
- Napoli, C., Lemieux, C., Jorgensen, R. Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes in trans. Plant Cell. 2, 279-289 (1990).
- van Roessel, P., Brand, A. H. Spreading silence with Sid. Genome Biol. 5, 208 (2004).
- Grishok, A. RNAi mechanisms in Caenorhabditis elegans. FEBS Lett. 579, 5932-5939 (2005).
- Jose, A. M., Hunter, C. P. Transport of sequence-specific RNA interference information between cells. Annu Rev Genet. 41, 305-330 (2007).
- Hannon, G. J. RNA interference. Nature. 418, 244-251 (2002).
- Hammond, S. M., Caudy, A. A., Hannon, G. J. Post-transcriptional gene silencing by double-stranded RNA. Nat Rev Genet. 2, 110-119 (2001).
- Dorsett, Y., Tuschl, T. siRNAs: applications in functional genomics and potential as therapeutics. Nat Rev Drug Discov. 3, 318-329 (2004).
- Agrawal, N., et al. RNA interference: biology, mechanism, and applications. Microbiol Mol Biol Rev. 67, 657-685 (2003).
- Grishok, A., Tabara, H., Mello, C. C. Genetic requirements for inheritance of RNAi in C. elegans. Science. 287, 2494-2497 (2000).
- Bucher, G., Scholten, J., Klingler, M. Parental RNAi in Tribolium (Coleoptera). Curr Biol. 12, 85-86 (2002).
- Timmons, L., Fire, A. Specific interference by ingested dsRNA. Nature. 395, 854 (1998).
- Turner, C. T., et al. RNA interference in the light brown apple moth, Epiphyas postvittana (Walker) induced by double-stranded RNA feeding. Insect Mol Biol. 15, 383-391 (2006).
- Tabara, H., Grishok, A., Mello, C. C. RNAi in C. elegans: soaking in the genome sequence. Science. 282, 430-431 (1998).
- Eaton, B. A., Fetter, R. D., Davis, G. W. Dynactin is necessary for synapse stabilization. Neuron. 34, 729-741 (2002).
- Travanty, E. A., et al. Using RNA interference to develop dengue virus resistance in genetically modified Aedes aegypti. Insect Biochem Mol Biol. 34, 607-613 (2004).
- Whitten, M. M., et al. Symbiont-mediated RNA interference in insects. Proc Biol Sci. 283, (2016).
- Schmitt-Engel, C., et al. The iBeetle large-scale RNAi screen reveals gene functions for insect development and physiology. Nat Commun. 6, 7822 (2015).
- Dönitz, J., et al. iBeetle-Base: a database for RNAi phenotypes in the red flour beetle Tribolium castaneum. Nucleic Acids Res. 43, 720-725 (2015).
- Ulrich, J., et al. Large scale RNAi screen in Tribolium reveals novel target genes for pest control and the proteasome as prime target. BMC Genomics. 16, 674 (2015).
- Choe, C. P., Miller, S. C., Brown, S. J. A pair-rule gene circuit defines segments sequentially in the short-germ insect Tribolium castaneum. Proc. Natl. Acad. Sci. U. S. A. 103, 6560-6564 (2006).
- Angelini, D. R., Kaufman, T. C. Functional analyses in the hemipteran Oncopeltus fasciatus reveal conserved and derived aspects of appendage patterning in insects. Dev Biol. 271, 306-321 (2004).
- Lynch, J. A., Peel, A. D., Drechsler, A., Averof, M., Roth, S. EGF signaling and the origin of axial polarity among the insects. Curr Biol. 20, 1042-1047 (2010).
- Tenlen, J. R., McCaskill, S., Goldstein, B. RNA interference can be used to disrupt gene function in tardigrades. Dev Genes Evol. 223, 171-181 (2013).
- Quan, G. X., Kanda, T., Tamura, T. Induction of the white egg 3 mutant phenotype by injection of the double-stranded RNA of the silkworm white gene. Insect Mol Biol. 11, 217-222 (2002).
- Brown, S. J., Mahaffey, J. P., Lorenzen, M. D., Denell, R. E., Mahaffey, J. W. Using RNAi to investigate orthologous homeotic gene function during development of distantly related insects. Evol Dev. 1, 11-15 (1999).
- Lynch, J. A., Brent, A. E., Leaf, D. S., Pultz, M. A., Desplan, C. Localized maternal orthodenticle patterns anterior and posterior in the long germ wasp Nasonia. Nature. 439, 728-732 (2006).
- Liu, P. Z., Kaufman, T. C. hunchback is required for suppression of abdominal identity, and for proper germband growth and segmentation in the intermediate germband insect Oncopeltus fasciatus. Development. 131, 1515-1527 (2004).
- Zhou, X., Wheeler, M. M., Oi, F. M., Scharf, M. E. RNA interference in the termite Reticulitermes flavipes through ingestion of double-stranded RNA. Insect Biochem Mol Biol. 38, 805-815 (2008).
- Ciudad, L., Piulachs, M. D., Bellés, X. Systemic RNAi of the cockroach vitellogenin receptor results in a phenotype similar to that of the Drosophila yolkless mutant. FEBS J. 273, 325-335 (2006).
- Mito, T., et al. Non-canonical functions of hunchback in segment patterning of the intermediate germ cricket Gryllus bimaculatus. Development. 132, 2069-2079 (2005).
- Yoon, K. S., et al. Brief exposures of human body lice to sublethal amounts of ivermectin over-transcribes detoxification genes involved in tolerance. Insect Mol Biol. 20, 687-699 (2011).
- Rosenberg, M. I., Brent, A. E., Payre, F., Desplan, C. Dual mode of embryonic development is highlighted by expression and function of Nasonia pair-rule genes. Elife. 3, 01440 (2014).
- Hasselmann, M., et al. Evidence for the evolutionary nascence of a novel sex determination pathway in honeybees. Nature. 454, 519-522 (2008).
- Shukla, J. N., Palli, S. R. Sex determination in beetles: production of all male progeny by parental RNAi knockdown of transformer. Sci Rep. 2, 602 (2012).
- Arakane, Y., et al. The Tribolium chitin synthase genes TcCHS1 and TcCHS2 are specialized for synthesis of epidermal cuticle and midgut peritrophic matrix. Insect Mol Biol. 14, 453-463 (2005).
- Cruz, J., Mané-Padròs, D., Bellés, X., Martìn, D. Functions of the ecdysone receptor isoform-A in the hemimetabolous insect Blattella germanica revealed by systemic RNAi in vivo. Dev Biol. 297, 158-171 (2006).
- Guidugli, K. R., et al. Vitellogenin regulates hormonal dynamics in the worker caste of a eusocial insect. FEBS Lett. 579, 4961-4965 (2005).
- Zhang, H., Li, H. C., Miao, X. X. Feasibility, limitation and possible solutions of RNAi-based technology for insect pest control. Insect Sci. 20, 15-30 (2013).
- Huvenne, H., Smagghe, G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: a review. J Insect Physiol. 56, 227-235 (2010).
- Price, D. R., Gatehouse, J. A. RNAi-mediated crop protection against insects. Trends Biotechnol. 26, 393-400 (2008).
- Paldi, N., et al. Effective gene silencing in a microsporidian parasite associated with honeybee (Apis mellifera) colony declines. Appl Environ Microbiol. 76, 5960-5964 (2010).
- Kanginakudru, S., et al. Targeting ie-1 gene by RNAi induces baculoviral resistance in lepidopteran cell lines and in transgenic silkworms. Insect Mol Biol. 16, 635-644 (2007).
- Magni, P. A., Voss, S. C., Testi, R., Borrini, M., Dadour, I. R. A Biological and Procedural Review of Forensically Significant Dermestes Species (Coleoptera: Dermestidae). J Med Entomol. 52, 755-769 (2015).
- Zanetti, N. I., Visciarelli, E. C., Centeno, N. D. The Effect of Temperature and Laboratory Rearing Conditions on the Development of Dermestes maculatus (Coleoptera: Dermestidae). J Forensic Sci. , (2015).
- Veer, V., Negi, B. K., Rao, K. M. Dermestid beetles and some other insect pests associated with stored silkworm cocoons in India, including a world list of dermestid species found attacking this commodity. Journal of Stored Products Research. 32, 69-89 (1996).
- Xiang, J., Forrest, I. S., Pick, L. Dermestes maculatus: an intermediate-germ beetle model system for evo-devo. Evodevo. 6, 32 (2015).
- Fontenot, E. A., Arthur, F. H., Hartzer, K. L. Oviposition of Dermestes maculatus DeGeer, the hide beetle, as affected by biological and environmental conditions. Journal of Stored Products Research. 64, 154-159 (2015).
- Heffer, A., Grubbs, N., Mahaffey, J., Pick, L. The evolving role of the orphan nuclear receptor ftz-f1, a pair-rule segmentation gene. Evol Dev. 15, 406-417 (2013).
- Heffer, A., Shultz, J. W., Pick, L. Surprising flexibility in a conserved Hox transcription factor over 550 million years of evolution. Proc. Natl. Acad. Sci. U. S. A. 107, 18040-18045 (2010).
- Wilson, M. J., Dearden, P. K. Pair-rule gene orthologues have unexpected maternal roles in the honeybee (Apis mellifera). PLoS One. 7, 46490 (2012).
- Dawes, R., Dawson, I., Falciani, F., Tear, G., Akam, M. Dax, a locust Hox gene related to fushi-tarazu but showing no pair-rule expression. Development. 120, 1561-1572 (1994).
- Erezyilmaz, D. F., Kelstrup, H. C., Riddiford, L. M. The nuclear receptor E75A has a novel pair-rule-like function in patterning the milkweed bug, Oncopeltus fasciatus. Dev Biol. 334, 300-310 (2009).
- Stuart, J. J., Brown, S. J., Beeman, R. W., Denell, R. E. A deficiency of the homeotic complex of the beetle Tribolium. Nature. 350, 72-74 (1991).
- Aranda, M., Marques-Souza, H., Bayer, T., Tautz, D. The role of the segmentation gene hairy in Tribolium. Dev Genes Evol. 218, 465-477 (2008).
- Mito, T., et al. even-skipped has gap-like, pair-rule-like, and segmental functions in the cricket Gryllus bimaculatus, a basal, intermediate germ insect (Orthoptera). Dev Biol. 303, 202-213 (2007).
- Patel, N. H., Ball, E. E., Goodman, C. S. Changing role of even-skipped during the evolution of insect pattern formation. Nature. 357, 339-342 (1992).
- Nüsslein-Volhard, C., Wieschaus, E. Mutations affecting segment number and polarity in Drosophila. Nature. 287, 795-801 (1980).
- Jürgens, G., Wieschaus, E., Nüsslein-Volhard, C., Kluding, H. Mutations affecting the pattern of the larval cuticle in Drosophila melanogaster. II. Zygotic loci on the third chromosome. Wilhelm Roux’s archives of developmental biology. 193, 283-295 (1984).
- Wakimoto, B. T., Kaufman, T. C. Analysis of larval segmentation in lethal genotypes associated with the Aantennapedia gene complex in Drosophila melanogaster. Dev. Biol. 81, 51-64 (1981).
- Yu, Y., et al. The nuclear hormone receptor Ftz-F1 is a cofactor for the Drosophila homeodomain protein Ftz. Nature. 385, 552-555 (1997).
- Nüsslein-Volhard, C., Wieschaus, E., Kluding, H. Mutations affecting the pattern of the larval cuticle in Drosophila melanogaster. I.Zygotic loci on the second chromosome. Wilhelm Roux’s archives of developmental biology. 193, 267-282 (1984).
- Wieschaus, E., Nüsslein-Volhard, C., Jürgens, G. Mutations affecting the pattern of the larval cuticle in Drosophila melanogaster. III.Zygotic loci on the X-chromosome and fourth chromosome. ‘Wilhelm Roux’s archives of developmental biology. 193, 296-307 (1984).
- Guichet, A., et al. The nuclear receptor homologue Ftz-F1 and the homeodomain protein Ftz are mutually dependent cofactors. Nature. 385, 548-552 (1997).
- Fontenot, E. A., Arthur, F. H., Hartzer, K. L. Effect of diet and refugia on development of Dermestes maculatus DeGeer reared in a laboratory. J Pest Sci. 88, 113-119 (2014).
- Yang, Y., et al. Biodegradation and Mineralization of Polystyrene by Plastic-Eating Mealworms: Part 1. Chemical and Physical Characterization and Isotopic Tests. Environ Sci Technol. 49, 12080-12086 (2015).
- Kitzmann, P., Schwirz, J., Schmitt-Engel, C., Bucher, G. RNAi phenotypes are influenced by the genetic background of the injected strain. BMC Genomics. 14, 5 (2013).
- Chandler, C. H., Chari, S., Tack, D., Dworkin, I. Causes and consequences of genetic background effects illuminated by integrative genomic analysis. Genetics. 196, 1321-1336 (2014).
- Montagutelli, X. Effect of the genetic background on the phenotype of mouse mutations. J Am Soc Nephrol. 11, 101-105 (2000).
- Doetschman, T. Influence of genetic background on genetically engineered mouse phenotypes. Methods Mol Biol. 530, 423-433 (2009).

