En mikroflödessystem med Surface Mönstring för utredning Kavitation Bubble (s) -cell Interaktion och den resulterande bioeffekter vid encelliga nivå
Summary
A microfluidic chip was fabricated to produce pairs of gold dots for tandem bubble generation and fibronectin-coated islands for single-cell patterning nearby. The resultant flow field was characterized by particle image velocimetry and was employed to study various bioeffects, including cell membrane poration, membrane deformation, and intracellular calcium response.
Abstract
I detta manuskript, beskriver vi först tillverkningsprotokollet av en mikroflödessystem chip med guld prickar och fibronektinbelagda regioner på samma glassubstrat, som just styr generering av tandem bubblor och enskilda celler mönstrade närheten med väldefinierade platser och former. Vi visar då är alstrandet av tandembubblor genom användning av två pulsade lasrar belyser ett par guld prickar med några-mikrosekund tidsfördröjningen. Vi visualiserar bubblan-bubblan interaktion och jet bildning av höghastighetsavbildning och karakterisera den resulterande flödesfältet med hjälp av partikel bild Velocimetry (PIV). Slutligen presenterar vi några tillämpningar av denna teknik för enskild cell analys, inklusive cellmembran Abp med makromolekyl upptag, lokal membran deformation bestäms av förskjutningar av bifogade integrinbindande pärlor, och intracellulär kalcium svar från ratiometrisk avbildning. Våra resultat visar att en snabb och riktningsprutningsflödet är proproduceras vid tandem bubblan interaktion, som kan införa en mycket lokal skjuvspänning på ytan av en cell odlas i omedelbar närhet. Vidare kan olika bioeffekter induceras genom förändring av styrkan hos sprutan flödet genom att justera standoff avståndet från cellen till tandem bubblor.
Introduction
Det finns en växande insikt om att cellulär heterogenitet, som härrör från den stokastiska uttrycket av gener, proteiner och metaboliter, finns inom ett stort cellpopulation och fungerar som en grundläggande princip i biologi för att möjliggöra cell anpassning och evolution 1. Därför är det ofta felaktiga och otillförlitliga att använda populationsbaserade mätningar bulk att förstå funktionen hos individuella celler och deras interaktioner. Utveckla ny teknik för encelliga analys är därför av stort intresse inom biologisk och farmakologisk forskning, och kan användas, till exempel för att bättre förstå de viktigaste signalvägar och processer i stamcellsbiologi och cancerterapi 2-4. Under de senaste åren har framväxten av mikroflödes plattformar underlättas avsevärt encelliga analys, där positioneringen, behandling och observation av svaret från enskilda celler har utförts med nya analytiska strategier 5.
Kavitation spelar en viktig roll i en mängd olika biomedicinska tillämpningar, inklusive behandling av cancer genom hög intensitet fokuserat ultraljud (HIFU) 6, den icke-invasiv fragmentering av njursten efter stötvågen litotripsi (SWL) 7, läkemedel eller gentillförsel genom sonoporation 8, och den nyligen rapporterade förstörelse av celler eller vävnader av hydrodynamiskt bubbla kavitation 9,10. Trots detta, de dynamiska processer av kavitation bubblan (er) interaktioner med biologisk vävnad och celler har inte väl förstått. Detta beror på slumpmässig i kavitation initierings- och bubbla dynamik produceras av ultraljud, stötvågor, och lokal hydrauliska trycket; Dessutom finns det en brist på möjliggöra tekniker för att lösa de inneboende komplexa och snabba svar av biologiska celler, speciellt vid enkelcellnivån.
På grund av dessa utmaningar, är det inte förvånande att mycket få studier har been rapporterade att undersöka bubbel cell-interaktioner under väl kontrollerade experimentella förhållanden. Till exempel, membran Abp av enskilda celler fångade i suspension 11 och impulsiva stor deformation av humana röda blodkroppar 12 har visats med hjälp av lasergenererade enstaka bubblor i mikroflödessystem kanaler. Den senare tekniken kan emellertid bara producera mycket liten deformation i eukaryota celler på grund av närvaron av kärnan 13. Dessutom är det svårt att övervaka bioeffekter nedströms vid behandling av celler i suspension. I andra studier har ultraljudsexcitering av ett cellbundet mikrobubblor (eller ultraljudkontrastmedel) för framställning av membran porering och / eller intracellulära kalciumsvar i enskilda adherenta celler rapporterats 8. Membran porering av enskilda adherenta celler kan även framställas genom användning av lasergenererade tandem bubblor i ett tunt vätskeskikt innehållande Ijusabsorberande Trypan blå lösning 14, ellergenom en oscillerande gasbubbla som genereras av mikrolaserpulser bestrålar genom ett optiskt absorberande substrat i microchambers 15. Vid jämförelse, har den optiskt absorberande substratet en fördel framför laserabsorberande Trypan blå lösning eftersom de senare är giftig för celler. Ännu viktigare, lasergenererade bubblor är mer kontrollerbar när det gäller bubbel storlek och placering än akustiskt glada bubblor. Icke desto mindre, i alla dessa tidigare studier, cellformen, orientering och adhesionsförhållanden var inte kontrolleras, vilket väsentligen kan påverka cellsvaret och bioeffekter produceras av mekaniska spänningar 16.
För att övervinna dessa nackdelar i tidigare studier har vi nyligen utvecklat ett experimentellt system för bubbla generation, cell mönstring, bubbla-bubbla-cell-interaktioner, och realtids bioanalyser cellsvar i ett mikroflödessystem chip konstruerats med hjälp av en unik kombination av mikro Techniques. Tre huvuddrag som skiljer vårt experimentella system från andra i området är: 1) mönstring av mikrometerstorlek guld prickar på glassubstrat för att möjliggöra lokal laser absorption för bubbla generation 17; 2) den mönstring av mikrometerstorlek öar av extracellulär matris (ECM) för cellvidhäftning på samma substrat för att styra både läge och geometrin hos enskilda celler; och 3) komprimering av dimensionen av interaktionen bubble-bubble-cell domän från 3D till en kvasi-2D utrymme för att underlätta i planet visualisering av bubbel-bubbel-interaktioner, jetting flödesfält, cell deformation och bioeffekter, alla fångas i en strömlinjeformad avbildningssekvens (Figur 1d).
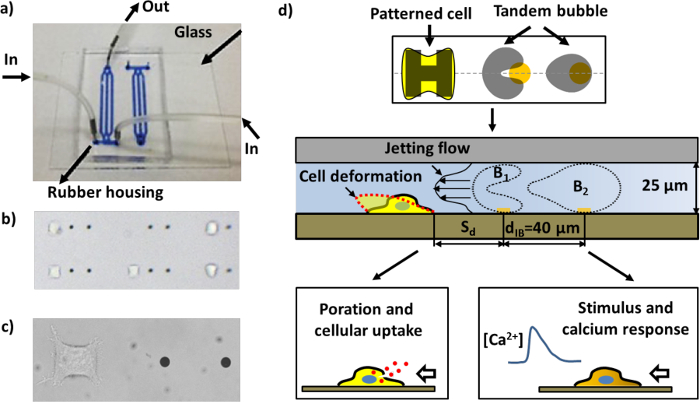
Figur 1: Den mikroflödessystem chip och scheman för olika analyser. a) En sammansatt mikroflödessystem chip med kanaler fyllda med blått bläck för visualisering. b) En region inuti mikroflödeschip med mönstrade celler och guld punkter (avståndet mellan de två guld prickar i närhet är 40 | j, m). Många par av arbetsenheter kan arrangeras i en kanal. c) Närbild bilden av en enda arbetsenhet bestående av ett par guld prickar och en HeLa cell fäst vid cell mönstring region. d) Skiss över enhetens funktion. En enda cell vidhäftar och sprider på "H" -formad ö belagd med fibronektin. Ett par kavitationsbubblor (tandem bubbla) med motfas oscillation produceras genom att belysa pulsade laserstrålar på guld prickar (se figur 4a), vilket leder till generering av en snabb och lokaliserad stråle rör sig mot målcellen i närheten. Cellen kan deformeras, dats för makromolekylärt upptag, och / eller stimuleras med ett kalciumsvar, beroende på den standoff avståndet (S d) i cellen till den tandem bubblan.f = "http://ecsource.jove.com/files/ftp_upload/55106/55106fig1large.jpg" target = "_ blank"> Klicka här för att se en större version av denna siffra.
Denna plattform kan kombineras ytterligare med fluorescensanalyser och funktionaliserade pärlorna bundna till cellytan för kavitations-inducerad bioeffekter. I synnerhet, öppnar denna plattform vägen för tillförlitliga och kvantifierbara analyser vid encelliga nivå. Hittills har vi använt enheten för analys av tandem bubbla-inducerad cellmembranet deformation, cell Abp och intracellulär upptagning, livskraft, apoptos, och intracellulär kalciumsvar. I följande protokoll, beskriver vi processen för chiptillverkning och förfarandet för att analysera de olika bioeffekter nämns ovan. Dessutom är verksamheten i chipet också beskrivits.
Protocol
Representative Results
Discussion
Encelliga analys, i kombination med levande cell imaging, har förbättrats avsevärt vår förståelse av de dynamiska och ofta varierande processer i enskilda celler, såsom fenotyp utveckling och immunsvar 23. I motsats till den konventionella cellkultur i skålar eller kolvar, mikrofluidiksystem möjliggöra exakt kontroll av mikromiljön, ner till den encelliga nivå, i realtid. Följaktligen framsteg inom mikroflödesteknik och tekniker har i hög grad förbättrat genomströmning och reproducerbarhet a…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We would like to acknowledge the use of the clean room facility SMIF at Duke University. We also want to thank Hao Qiang for his assistance in measuring the jet velocity. The authors thank Todd Rumbaugh of Hadland Imaging for providing the Shimadzu HPV-X camera used in this study.The work was funded in part by NIH through grants 5R03EB017886-02 and 4R37DK052985-20.
Materials
| Reagent/Materials | |||
| 75x38mm Plain Microscope Slides | Corning | 2947-75X38 | |
| Acetone | Sigma Aldrich, Co. | 320110 | ACS reagent, ≥99.5% |
| Isopropyl alcohol | Sigma Aldrich, Co. | W292907 | ≥99.7%, FCC, FG |
| Sulfuric acid | Sigma Aldrich, Co. | 320501 | ACS reagent, 95.0-98.0% |
| Hydrogen peroxide | Sigma Aldrich, Co. | 216763 | 30 wt.% in H2O |
| Primer P-20 | Microchem | MCC Primer 80/20 | |
| NFR photoresist | JSR | NFR016D2 | |
| Photomask | Photoplotstore | N/A | 4×4 Direct write mask |
| MF-319 Developer | Shipley (Rohm and Haas) | Microposit MF-319 | |
| 1165 Photoresist Remover | Dow Chemical, Co. | DEM-10018073 | 1-methyl-2-pyrrolidinone based |
| S1813 photoresist | Shipley (Rohm and Haas) | S1813 | |
| PLL-g-PEG | SuSoS | PLL(20)-g[3.5]- PEG(2) | |
| HEPES | ThermoFisher Scientific | 15630080 | |
| Paraffin film | HACH | 251764 | |
| SU-2025 photoresist | Microchem | SU-2025 | |
| PDMS | Dow Corning | 184 SIL ELAST KIT 0.5KG | |
| Microbore Tubing | Saint-Gobain PPL Corp. | S-54-HL | |
| Metal pins | New England Small Tube | NE-1300-01 | Cut Tube (straight), 0.025” OD x 0.017” ID x 0.50” Long |
| HeLa cells | Duke Cell Culture Facility | (307-CCL-2) HeLa, p.148 | |
| DPBS(1X) buffer | ThermoFisher Scientific | 14190144 | |
| DMEM culture medium | ThermoFisher Scientific | 11995065 | |
| Fibronectin Bovine Protein, Plasma | ThermoFisher Scientific | 33010018 | |
| 0.25% Trypsin-EDTA (1X) | ThermoFisher Scientific | 25200056 | |
| Propidium Iodide | ThermoFisher Scientific | P21493 | |
| Carboxylate Microspheres 1.00μm | Polysciences, Inc | 08226-15 | |
| Carboxylate Microspheres 2.00μm | Polysciences, Inc | 18327-10 | |
| EDC (1-ethyl-3-(3-dimethylaminopropyl)carbodiimide hydrochloride) | ThermoFisher Scientific | 22980 | |
| Sulfo-NHS | Sulfo-NHS (N-hydroxysulfosuccinimide) | 24510 | |
| Peptite-2000 | Advanced BioMatrix | 5020-5MG | |
| FITC Annexin V | ThermoFisher Scientific | A13199 | |
| Fura-2, AM | ThermoFisher Scientific | F1221 | |
| DMSO | Sigma Aldrich, Co. | D2650 | |
| F-127 | invitrogen | P6866 | 0.2 µm filtered (10% Solution in Water) |
| Reduced serum media | ThermoFisher Scientific | 11058021 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Plasma asher | Emitech | K-1050X | O2 / Ar plasma ashing of photoresist and other organic materials |
| Mask aligner | SUSS MicroTec | Karl Suss MA6/BA6 | |
| E-beam evaporator | CHA Industries | CHA Industries Solution E-Beam | |
| RIE | Trion Technology | Trion Technology Phantom II | (oxide/ nitride/ polymer) etching |
| Stereoscope | AmScope | American Scope SM-4TZ-FRL | Stereo Microscope |
| Syringe pump | Chemyx Inc | NanoJet | |
| Cell culture incubator | NuAire | AutoFlow NU-8500 Water Jacket CO2 Incubator | |
| Biological Safety Cabinets | NuAire | NU-425-400 | |
| Water bath | VWR | 1122s | |
| Centrifuge | IEC | Centra CL2 | |
| Microscope | Zeiss | Axio Observer Z1 | |
| Nd:YAG laser (laser 1) | New Wave Research | Tempest | |
| Nd:YAG laser (laser 2) | New Wave Research | Orion | |
| Delay generator | Berkeley Nucleonics | BNC 565-8c | |
| Flash lamp | Dyna-Lite | ML1000 fiber-coupled flashtube | |
| high speed camera | DRS Hadland | Imacon 200 | |
| high speed camera | Shimadzu | HPV-X | |
| high speed camera | Vision Research | Phantom V7.3 | |
| PIV software | LaVision | DaVis 7.2 | |
| camera | Zeiss | AxioCam MRc 5 | |
| software | Zeiss | AxioVision | |
| PTI system | Horiba | S/N: 1705 RAM-X | |
| EasyRatio software | Horiba | Easy Ratio Pro 2 | version 2.3.125.86 |
| 63× objective | Zeiss | LD Plan Neofluar |
References
- Wang, D., Bodovitz, S. Single cell analysis: the new frontier in ‘omics. Trends Biotechnol. 28 (6), 281-290 (2010).
- Weaver, W. M., et al. Advances in high-throughput single-cell microtechnologies. Curr Opin Biotechnol. 25, 114-123 (2014).
- Gossett, D. R., et al. Hydrodynamic stretching of single cells for large population mechanical phenotyping. Proc Natl Acad Sci USA. 109 (20), 7630-7635 (2012).
- Spiller, D. G., Wood, C. D., Rand, D. A., White, M. R. H. Measurement of single-cell dynamics. Nature. 465 (7299), 736-745 (2010).
- Lecault, V., White, A. K., Singhal, A., Hansen, C. L. Microfluidic single cell analysis: from promise to practice. Curr Opin Chem Biol. 16 (3-4), 381-390 (2012).
- Kennedy, J. E. High-intensity focused ultrasound in the treatment of solid tumours. Nat Rev Cancer. 5 (4), 321-327 (2005).
- Zhu, S., Cocks, F. H., Preminger, G. M., Zhong, P. The role of stress waves and cavitation in stone comminution in shock wave lithotripsy. Ultrasound Med Biol. 28 (5), 661-671 (2002).
- Fan, Z., Liu, H., Mayer, M., Deng, C. X. Spatiotemporally controlled single cell sonoporation. Proc Natl Acad Sci U S A. 109 (41), 16486-16491 (2012).
- Itah, Z., et al. Hydrodynamic cavitation kills prostate cells and ablates benign prostatic hyperplasia tissue. Exp Biol Med. 238 (11), 1242-1250 (2013).
- Kosar, A., Sesen, M., Oral, O., Itah, Z., Gozuacik, D. Bubbly cavitating flow generation and investigation of its erosional nature for biomedical applications. IEEE Trans Biomed Eng. 58 (5), 1337-1346 (2011).
- Li, Z. G., Liu, A. Q., Klaseboer, E., Zhang, J. B., Ohl, C. D. Single cell membrane poration by bubble-induced microjets in a microfluidic chip. Lab Chip. 13 (6), 1144-1150 (2013).
- Li, F. F., Chan, C. U., Ohl, C. D. Yield Strength of Human Erythrocyte Membranes to Impulsive Stretching. Biophys J. 105 (4), 872-879 (2013).
- Li, F., M, M., Ohl, C. .. D. .. Shear stress induced stretching of red blood cells by oscillating bubbles within a narrow gap. Bull Am Phys Soc. 58, (2013).
- Sankin, G. N., Yuan, F., Zhong, P. Pulsating tandem microbubble for localized and directional single-cell membrane poration. Phys. Rev. Lett. 105 (7), 078101 (2010).
- Fan, Q., Hu, W., Ohta, A. T. Laser-induced microbubble poration of localized single cells. Lab Chip. 14 (9), 1572-1578 (2014).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Yuan, F., Sankin, G., Zhong, P. Dynamics of tandem bubble interaction in a microfluidic channel. J Acoust Soc Am. 130 (5), 3339-3346 (2011).
- Yang, C. . Analysis of Tandem Bubble Interaction and Jet Formation in a Microfluidic Channel. , (2013).
- Simon, S. I., Schmid-Schonbein, G. W. Cytoplasmic strains and strain rates in motile polymorphonuclear leukocytes. Biophys J. 58 (2), 319-332 (1990).
- Barbee, K. A., Macarak, E. J., Thibault, L. E. Strain measurements in cultured vascular smooth muscle cells subjected to mechanical deformation. Ann Biomed Eng. 22 (1), 14-22 (1994).
- Yuan, F., Yang, C., Zhong, P. Cell membrane deformation and bioeffects produced by tandem bubble-induced jetting flow. Proc. Natl. Acad. Sci. U.S.A. 112 (51), E7039-E7047 (2015).
- Yin, H., Marshall, D. Microfluidics for single cell analysis. Curr Opin Biotechnol. 23 (1), 110-119 (2012).
- Tay, S., et al. Single-cell NF-kappa B dynamics reveal digital activation and analogue information processing. Nature. 466 (7303), 267-271 (2010).
- Rand, R. P., Burton, A. C. Mechanical Properties of the Red Cell Membrane: I. Membrane Stiffness and Intracellular Pressure. Biophys J. 4 (2), 115-135 (1964).
- Lim, C. T., Dao, M., Suresh, S., Sow, C. H., Chew, K. T. Large deformation of living cells using laser traps. Acta Mater. 52 (7), 1837-1845 (2004).
- Puig-de-Morales-Marinkovic, M., Turner, K. T., Butler, J. P., Fredberg, J. J., Suresh, S. Viscoelasticity of the human red blood cell. Am J Physiol Cell Physiol. 293 (2), C597-C605 (2007).
- Kudo, N., Okada, K., Yamamoto, K. Sonoporation by single-shot pulsed ultrasound with microbubbles adjacent to cells. Biophys J. 96 (12), 4866-4876 (2009).
- van Wamel, A., et al. Vibrating microbubbles poking individual cells: Drug transfer into cells via sonoporation. J Control Release. 112 (2), 149-155 (2006).
- Hu, Y., Wan, J. M., Yu, A. C. Membrane perforation and recovery dynamics in microbubble-mediated sonoporation. Ultrasound Med Biol. 39 (12), 2393-2405 (2013).
- Dijkink, R., et al. Controlled cavitation-cell interaction: trans-membrane transport and viability studies. Phys Med Biol. 53 (2), 375-390 (2008).
- Rau, K. R., Quinto-Su, P. A., Hellman, A. N., Venugopalan, V. Pulsed laser microbeam-induced cell lysis: Time-resolved imaging and analysis of hydrodynamic effects. Biophys J. 91 (1), 317-329 (2006).

