Mammalcellekapsling i alginatperler ved hjelp av et enkelt omrørt fartøy
Summary
Denne videoen og manuskriptet beskriver en emulsjonsbasert metode for innkapsling av pattedyrceller i 0,5% til 10% alginatperler som kan fremstilles i store batcher ved bruk av en enkel omrørt beholder. De innkapslede celler kan dyrkes in vitro eller transplanteres for cellulære terapiapplikasjoner.
Abstract
Celleinnkapsling i alginatperler har vært brukt for immobilisert cellekultur in vitro, så vel som for immunoisolering in vivo . Innkapsling av bukspyttkjertelen er studert omfattende som et middel for å øke isletes overlevelse i allogene eller xenogene transplantasjoner. Algininkapsling oppnås vanligvis ved dyseekstrudering og ekstern gelering. Ved hjelp av denne metoden faller celleholdige alginatdråper dannet ved spissen av dyser inn i en løsning som inneholder divalente kationer som forårsaker ionotrop alginat gelering som de diffunderer i dråpene. Kravet på dråpeformasjon ved dysespissen begrenser volumetrisk gjennomstrømning og alginatkonsentrasjon som kan oppnås. Denne video beskriver en skalerbar emulgeringsmetode for å inkapslere pattedyrceller i 0,5% til 10% alginat med 70% til 90% celleoverlevelse. Ved denne alternative metode emulgeres alginatdråper inneholdende celler og kalsiumkarbonat i mineralolje, folSenket av en reduksjon i pH som fører til intern kalsiumfrigivelse og ionotrop alginat gelering. Den nåværende metoden tillater fremstilling av alginatperler innen 20 minutter av emulgering. Utstyret som kreves for innkapslingstrinnet, består i enkle omrørte kar som er tilgjengelige for de fleste laboratorier.
Introduction
Mammalcelleinnkapsling har blitt bredt studert som et middel for å beskytte transplanterte celler fra immunavstøtning 1 eller for å gi en tredimensjonal støtte for immobilisert cellekultur 2 , 3 , 4 . Bukspyttkjertelinnkapsling i alginatperler har blitt brukt til å reversere diabetes i allogene 5 , 6 eller xenogene 7 , 8 , 9 , 10 , 11 , 12 gnagere. Prækliniske og kliniske studier av innkapslet pankreas-øktransplantasjon for å behandle type 1-diabetes pågår 13 , 14 , 15 . For transplantasjonsapplikasjoner eller større skalEn in vitro immobilisert celleproduksjon, dysebaserte perlegeneratorer, blir generelt brukt. Vanligvis pumpes en blanding av alginat og celler gjennom en dyse for å danne dråper som faller i en omrørt oppløsning inneholdende divalente kationer, noe som resulterer i den eksterne gelering av dråpene. Koaksialgasstrømmen 16 , 17 , dysevibrering 18 , elektrostatisk avstøtning 19 eller roterende ledninger 20 letter dråpedannelse ved dysespissen.
De viktigste ulempene ved konvensjonelle vulstgeneratorer er deres begrensede gjennomstrømning og det begrensede området av løsningsviskositeter som vil resultere i tilstrekkelig perleformasjon 21 . Ved høye strømningshastigheter bryter væsken som kommer ut av dysen opp i dråper som er mindre enn dysediameteren, og reduserer størrelsesreguleringen. Multi-nozzle bead generatorer kan brukes til å øke gjennomstrømningen, menDen ensartede fordeling av strømmen mellom dysene og bruken av løsninger> 0.2 Pas er problematisk 22 . Til slutt forventes alle dysebaserte enheter å forårsake noen skade på øyer, siden diameteren av dysene som brukes er mellom 100 μm og 500 μm, mens ~ 15% av menneskelige øyer kan være større enn 200 μm 23 .
I denne videoen beskriver vi en alternativ metode for innkapsling av pattedyrceller ved å danne dråper i et enkelt emulgeringstrinn i stedet for drop-by-drop. Siden beadproduksjonen utføres i et enkelt omrørt kar, er metoden egnet for liten (~ 1 ml) til storskala (10 3 L-serie) perleproduksjon med lave utstyrskostnader 24 . Denne metoden tillater fremstilling av perler med høy sfærisk form ved bruk av et bredt spekter av alginatviskositeter med korte ( f.eks. 20 min) perlegenereringstider. Denne metoden ble opprinnelig utviklet av Poncelet et al. 25 , 26 og pleide å immobilisere DNA 27 , proteiner 28 innbefattende insulin 29 og bakterier 30 . Vi har nylig tilpasset disse metodene til innkapslingen av pattedyrceller ved bruk av pankreas-betacellelinjer 31 , 32 og primær pankreasvev 32 .
Prinsippet med metoden er å danne en vann-i-olje emulsjon bestående av alginatdråper i mineralolje, etterfulgt av intern gelering av alginatdråper ( figur 1 ). Først blir inkapslingsmiddelet ( f.eks. Celler) dispergert i en alginatoppløsning inneholdende et fint kornkalsiumsalt med lav oppløselighet ved den første prosess-pH. Alginatblandingen blir så tilsatt til en omrørt organisk fase for å danne en emulsjon, vanligvis i nærvær av aoverflateaktivt middel. I tilfelle av pattedyrcellekapsling kan komponenter som er tilstede i serum virke som overflateaktive midler. Deretter reduseres pH for å oppløseliggjøre kalsiumsaltet ved å tilsette en oljeoppløselig syre som skiller seg i vannfasen. Eddiksyre, med en mineralolje / vann-partisjonskoeffisient <0,005 33 , bør foroppløses i olje, deretter tilsatt emulsjonen hvor den blandes i oljefasen og skiller seg raskt i vannfasen 34 . Figur 2 illustrerer de kjemiske reaksjonene og diffusjonen som finner sted under forsurende og indre geleringstrinn. Til slutt utvinnes de innkapslede celler ved faseinversjon, faseseparasjon akselerert ved sentrifugering, gjentatte vaske-trinn og filtrering. Disse trinnene kan deretter følges av perle- og celleprøvetaking for kvalitetskontrollanalyser, in vitro- cellekultur og / eller transplantasjon av de innkapslede celler.
<p clasS = "jove_content" fo: keep-together.within-page = "1">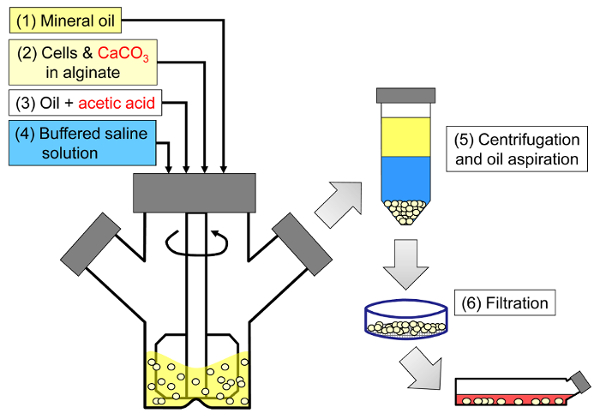
Figur 1: Skjematisk av emulgeringsbasert prosess for innkapsling av pattedyrceller. Perler fremstilles først ved å emulgere en alginat, celle og CaCO3-blanding i mineralolje (trinn 1 og 2 i skjematisk), utløsende intern gelering ved å tilsette eddiksyre (trinn 3). De gelerte perler separeres deretter fra oljen ved å tilsette en vandig buffer for å utløse faseinversjon (trinn 4), etterfulgt av sentrifugering og olje-aspirering (trinn 5) og deretter filtrering (trinn 6). Til slutt overføres perlene oppsamlet på filteret til cellekulturmedium for in vitro- kultur eller transplantasjon. Vennligst klikk her for å se en større versjon av denne figuren.
<imgAlt = "Figur 2" class = "xfigimg" src = "/ files / ftp_upload / 55280 / 55280fig2.jpg" />
Figur 2: Reaksjoner og diffusjonstrinn som oppstår under intern gelering. (1) Eddiksyre tilsettes til den organiske fasen og transporteres til alginatdråpene ved konveksjon. (2) Eddiksyre fordeler seg i vannfasen. (3) I nærvær av vann dissocierer og diffuserer syren for å nå CaCO 3- kornene som er avbildet i mørk blå. (4) H + -jonene utveksles med Ca2 + -ioner i CaCO3, frigjør Ca2 + -ioner. (5) Kalsiumioner diffunderer til de møter uomsatt alginat, som fører til ionotrop kryssbinding av alginatkjedene. Vennligst klikk her for å se en større versjon av denne figuren.
I motsetning til konvensjonelle dysebaserte celleinnkapslere er en bred perlestørrelsesfordeling eksponertCted fra denne prosessen på grunn av mekanismen for dråpedannelse i omrørt emulgering. For en delmengde av applikasjoner, kan denne perlestørrelsesfordelingen være problematisk. For eksempel kan en større brøkdel av celler bli eksponert ved vulstoverflaten i mindre perler. Hvis næringsstoffer ( f.eks. Oksygen) begrensninger er en bekymring, kan disse begrensningene forverres i større perler. En fordel ved den omrørte emulgeringsmetode er at gjennomsnittlig vulststørrelse lett kan justeres ved å endre omrøringshastigheten under emulgeringstrinnet. Breddistribusjonsfordelingen kan også utnyttes for å studere effekten av perlestørrelse på innkapslet celleytelse.
Mammalisk celleinnkapsling ved emulgering og intern gelering er et interessant alternativ for laboratorier som ikke er utstyrt med en vulstgenerator. Videre gir denne metoden brukere muligheten til å redusere behandlingstiden eller generere perler ved svært lav eller meget høy alginatkoncentreringasjon.
Protokollen beskrevet nedenfor beskriver hvordan man skal innkapslere celler i 10,5 ml 5% alginatløsning fremstilt i 10 mM 4- (2-hydroksyetyl) -1-piperazinetansulfonsyre (HEPES) buffer. Alginatet består av en 50:50 blanding av transplantasjonskvalitet LVM (lav viskositet høy mannuronsyreinnhold) og MVG (medium viskositet høy guluronsyreinnhold) alginat. Kalsiumkarbonat i en sluttkonsentrasjon på 24 mM brukes som det fysiske tverrbindingsmiddel. Lett mineralolje utgjør den organiske fasen, mens eddiksyre brukes til å syre emulsjonen og utløse intern gelering. Imidlertid er alginatypen og -blandingen, så vel som den valgte prosessbuffer, avhengig av den ønskede anvendelse 32 . En rekke alginattyper (se tabell over materialer) har blitt brukt til å produsere perler med denne protokollen.
Protocol
Representative Results
Discussion
Ulike trinn (vist i figur 2 ) under den interne geleringsreaksjonen kan begrense den totale kinetikken. For kalsiumkarbonatkorn større enn ~ 2,5 μm, har karbonatoppløsningen vist seg å være begrensningsbegrensende 26 , 44 . Syringstrinnet som fører til intern kalsiumfrigivelse har også vist seg å være den kritiske prosessvariabel som påvirker celleoverlevelse 32 . Betingelsene som fører til intern gelering er d…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Vi takker Jill Osborne for sitt grunnleggingsarbeid på emulgeringsprosessen og Lauren Wilkinson for teknisk støtte. Vi takker Dr. Igor Laçik, Dr. Timothy J. Kieffer og Dr. James D. Johnson for deres innspill og samarbeid. Vi takker Diabète Québec, JDRF, ThéCell, Centre québécois sur les matériaux fonctionnels (CQMF), Forskningsrådet for naturvitenskap og ingeniørvitenskap (NSERC), Senter for human isletransplantasjon og betacelleregenerering, det kanadiske stamcelleverket, den Michael Smith Foundation for helseforskning, le Fonds québécois de la recherche sur la nature et les teknologier og COST 865 for økonomisk støtte.
Materials
| Reagents and consumables | |||
| LVM alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #1" in the results. |
| MVG alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #2" in the results. |
| Alginate (cell culture-grade) | Sigma | A0682 (low viscosity) or A2033 (medium viscosity) | A2033 is referred to as "alginate #3" in the results. |
| DMEM | Life Technologies | 11995-065 | |
| Fetal bovine serum, characterized, Canadian origin | Thermo Fisher Scientific | SH3039603 | |
| Glutamine | Life Technologies | 25030 | |
| Penicillin and streptomycin | Sigma | P4333-100ML | |
| HEPES, cell culture tested | Sigma | H4034-100G | |
| NaCl | Thermo Fisher Scientific | S271-1 | |
| Fine-grain CaCO3 | Avantor Materials | 1301-01 | After preparing the CaCO3 suspension, sonicate and use within one month. |
| Light mineral oil | Thermo Fisher Scientific | O121-4 | Sterile filter through a 0.22 μm pore size membrane prior to use. |
| Glacial acetic acid | Thermo Fisher Scientific | A38-500 | Handle with caution: refer to MSDS. |
| Sterile spatulas | Sigma | CLS3004-100EA | |
| Sterile nylon cell strainers, 40 µm | Thermo Fisher Scientific | 08-771-1 | |
| Serological pipettes (2 mL, 5 mL, 10 mL, 25 mL) | Sarstedt | 86.1252.001, 86.1253.001, 86.1254.001 and 86.1685.001 | |
| Pasteur pipettes | VWR | 14673-043 | |
| Toluidine Blue-O | Sigma | T3260 | |
| Equipment | |||
| 100 mL microcarrier spinner flasks | Bellco | 1965-00100 | The impeller configuration with recent models may not be suitable for adequate emulsification. A blade able to sweep the oil down to 0.5 cm from the bottom of the flask can be custom-made from a Teflon sheet. |
| Magnetic stir plate with adjustable speed | Bellco | 7760-06005 | The rotation speed should be calibrated (e.g. using a tachometer) prior to use. |
| Cell counter | Innovatis | Cedex AS20 | This system is now sold by Roche. This automated cell counter can also be replaced by manual cell enumeration after Trypan blue staining using a hemocytometer. |
| LED light box | Artograph | LightPad® PRO | This item can be replaced by other types of illuminators. |
| Handheld camera | Canon | PowerShot A590 IS | A variety of handheld cameras can be used to capture toluidine blue-o stained bead images. A ruler should be placed next to the Petri dish containing the beads prior to acquiring images. |
| Fluorescence microscope with phase contrast and adequate fluorescence filters | Olympus | IX81 | Several microscopy systems were used to image the beads. The results shown here were obtained with an IX81 microscope equipped with GFP and TRITC fluorescence filters. To capture entire beads, 4X to 20X objectives were used depending on the agitation rate. Live/dead staining images were typically captured with 20X to 40X objectives. |
| Image aquisition software | Molecular Devices | Metamorph | A variety of image acquisition software can be used to acquire phase contrast and fluorescence images. |
| Image analysis freeware | CellProfiler | Non-applicable | A variety of image analysis software can be used to identify beads as objects and analyze bead size (e.g. ImageJ). |
References
- Scharp, D. W., Marchetti, P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 67-68, 35-73 (2014).
- Chayosumrit, M., Tuch, B., Sidhu, K. Alginate microcapsule for propagation and directed differentiation of hESCs to definitive endoderm. Biomaterials. 31 (3), 505-514 (2010).
- Sidhu, K., Kim, J., Chayosumrit, M., Dean, S., Sachdev, P. Alginate microcapsule as a 3D platform for propagation and differentiation of human embryonic stem cells (hESC) to different lineages. J Vis Exp. (61), (2012).
- Tostoes, R. M., et al. Perfusion of 3D encapsulated hepatocytes–a synergistic effect enhancing long-term functionality in bioreactors. Biotechnol Bioeng. 108 (1), 41-49 (2011).
- Duvivier-Kali, V. F., Omer, A., Parent, R. J., O’Neil, J. J., Weir, G. C. Complete protection of islets against allorejection and autoimmunity by a simple barium-alginate membrane. Diabetes. 50 (8), 1698-1705 (2001).
- Omer, A., et al. Long-term normoglycemia in rats receiving transplants with encapsulated islets. Transplantation. 79 (1), 52-58 (2005).
- Rayat, G. R., Rajotte, R. V., Ao, Z., Korbutt, G. S. Microencapsulation of neonatal porcine islets: protection from human antibody/complement-mediated cytolysis in vitro and long-term reversal of diabetes in nude mice. Transplantation. 69 (6), 1084-1090 (2000).
- Korbutt, G. S., Mallett, A. G., Ao, Z., Flashner, M., Rajotte, R. V. Improved survival of microencapsulated islets during in vitro culture and enhanced metabolic function following transplantation. Diabetologia. 47 (10), 1810-1818 (2004).
- Luca, G., et al. Improved function of rat islets upon co-microencapsulation with Sertoli’s cells in alginate/poly-L-ornithine. AAPS PharmSciTech. 2 (3), E15 (2001).
- Omer, A., et al. Survival and maturation of microencapsulated porcine neonatal pancreatic cell clusters transplanted into immunocompetent diabetic mice. Diabetes. 52 (1), 69-75 (2003).
- Schneider, S., et al. Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice. Diabetes. 54 (3), 687-693 (2005).
- Cui, H., et al. Long-term metabolic control of autoimmune diabetes in spontaneously diabetic nonobese diabetic mice by nonvascularized microencapsulated adult porcine islets. Transplantation. 88 (2), 160-169 (2009).
- Krishnan, R., Alexander, M., Robles, L., Foster, C. E., Lakey, J. R. Islet and stem cell encapsulation for clinical transplantation. Rev Diabet Stud. 11 (1), 84-101 (2014).
- Robles, L., Storrs, R., Lamb, M., Alexander, M., Lakey, J. R. Current status of islet encapsulation. Cell Transplant. 23 (11), 1321-1348 (2014).
- Desai, T., Shea, L. D. Advances in islet encapsulation technologies. Nat Rev Drug Discov. , (2016).
- Anilkumar, A. V., Lacik, I., Wang, T. G. A novel reactor for making uniform capsules. Biotechnol Bioeng. 75 (5), 581-589 (2001).
- Wolters, G. H., Fritschy, W. M., Gerrits, D., van Schilfgaarde, R. A versatile alginate droplet generator applicable for microencapsulation of pancreatic islets. J Appl Biomater. 3 (4), 281-286 (1991).
- Heinzen, C., Marison, I., Berger, A., von Stockar, U. Use of vibration technology for jet break-up for encapsulation of cells, microbes and liquids in monodisperse microcapsules. Practical Aspects of Encapsulation Technologies. , 19-25 (2002).
- Poncelet, D., et al. A Parallel plate electrostatic droplet generator: Parameters affecting microbead size. Applied Microbiology and Biotechnology. 42 (2-3), 251-255 (1994).
- Prüße, U., Dalluhn, J., Breford, J., Vorlop, K. D. Production of Spherical Beads by JetCutting. Chemical Engineering & Technology. 23 (12), 1105-1110 (2000).
- Hoesli, C. A. . Bioprocess development for the cell-based treatment of diabetes (PhD thesis). , (2010).
- Brandenberger, H., Widmer, F. A new multinozzle encapsulation/immobilisation system to produce uniform beads of alginate. J Biotechnol. 63 (1), 73-80 (1998).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95 (12), 1449-1461 (2008).
- Reis, C. P., Neufeld, R. J., Vilela, S., Ribeiro, A. J., Veiga, F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J Microencapsul. 23 (3), 245-257 (2006).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. I. Methodology. Appl Microbiol Biotechnol. 38 (1), 39-45 (1992).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. II. Physicochemistry. Applied Microbiology and Biotechnology. 43 (4), 644-650 (1995).
- Alexakis, T., et al. Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for in vivo application. Appl Biochem Biotechnol. 50 (1), 93-106 (1995).
- Vandenberg, G. W., De La Noue, J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. J Microencapsul. 18 (4), 433-441 (2001).
- Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Goncalves, A. R., Veiga, F. Alginate microspheres prepared by internal gelation: development and effect on insulin stability. Int J Pharm. 311 (1-2), 1-10 (2006).
- Larisch, B. C., Poncelet, D., Champagne, C. P., Neufeld, R. J. Microencapsulation of Lactococcus lactis subsp. cremoris. J Microencapsul. 11 (2), 189-195 (1994).
- Hoesli, C. A., et al. Reversal of diabetes by betaTC3 cells encapsulated in alginate beads generated by emulsion and internal gelation. J Biomed Mater Res B Appl Biomater. 100 (4), 1017-1028 (2012).
- Hoesli, C. A., et al. Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation. Biotechnol Bioeng. 108 (2), 424-434 (2011).
- Reinsel, M. A., Borkowski, J. J., Sears, J. T. Partition Coefficients for Acetic, Propionic, and Butyric Acids in a Crude Oil/Water System. Journal of Chemical & Engineering Data. 39 (3), 513-516 (1994).
- Xiu-Dong, L., Wei-Ting, Y., Jun-Zhang, L., Xiao-Jun, M., Quan, Y. Diffusion of acetic acid across oil/water interface in emulsification-internal gelation process for preparation of alginate gel beads. Chemical Research in Chinese Universities. 23 (5), 579-584 (2007).
- Fernandez, S. A., et al. Emulsion-based islet encapsulation: predicting and overcoming islet hypoxia. Bioencapsulation Innovations. (220), 14-15 (2014).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Hinze, J. O. Fundamentals of the hydrodynamic mechanism of splitting in dispersion processes. AIChE Journal. 1 (3), 289-295 (1955).
- Kolmogorov, A. N. On the breakage of drops in a turbulent flow (translated from Russian). Doklady Akademii Nauk. 66, 825-828 (1949).
- Davies, J. T. Drop Sizes of Emulsions Related to Turbulent Energy-Dissipation Rates. Chemical Engineering Science. 40 (5), 839-842 (1985).
- Pacek, A. W., Chamsart, S., Nienow, A. W., Bakker, A. The influence of impeller type on mean drop size and drop size distribution in an agitated vessel. Chemical Engineering Science. 54 (19), 4211-4222 (1999).
- Steiner, H., et al. Numerical simulation and experimental study of emulsification in a narrow-gap homogenizer. Chemical Engineering Science. 61 (17), 5841-5855 (2006).
- Tcholakova, S., Denkov, N. D., Lips, A. Comparison of solid particles, globular proteins and surfactants as emulsifiers. Phys Chem Chem Phys. 10 (12), 1608-1627 (2008).
- Lagisetty, J. S., Das, P. K., Kumar, R., Gandhi, K. S. Breakage of viscous and non-Newtonian drops in stirred dispersions. Chemical Engineering Science. 41 (1), 65-72 (1986).
- Draget, K. I., Ostgaard, K., Smidsrod, O. Homogeneous Alginate Gels – a Technical Approach. Carbohydrate Polymers. 14 (2), 159-178 (1990).
- Poncelet, D., Dulieu, C., Jacquot, M., Wijffels, R. H. . Immobilized Cells. , 15-30 (2001).
- Islam, A. W., Zavvadi, A., Kabadi, V. N. Analysis of Partition Coefficients of Ternary Liquid-Liquid Equilibrium Systems and Finding Consistency Using Uniquac Model. Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa. 33 (2), 243-253 (2012).
- Quong, D., Neufeld, R. J., Skjak-Braek, G., Poncelet, D. External versus internal source of calcium during the gelation of alginate beads for DNA encapsulation. Biotechnol Bioeng. 57 (4), 438-446 (1998).
- De Vos, P., De Haan, B. J., Van Schilfgaarde, R. Upscaling the production of microencapsulated pancreatic islets. Biomaterials. 18 (16), 1085-1090 (1997).
- Gross, J. D., Constantinidis, I., Sambanis, A. Modeling of encapsulated cell systems. J Theor Biol. 244 (3), 500-510 (2007).

