Zoogdiercelcapsulatie in Alginaatkralen Met Een Eenvoudig Verrijkt Vaartuig
Summary
Deze video en manuscript beschrijven een emulsie gebaseerde methode om zoogdiercellen in 0,5% tot 10% alginaatkralen te inkapselen die in grote batches kunnen worden geproduceerd onder gebruikmaking van een eenvoudig geroerd vat. De ingekapselde cellen kunnen in vitro worden gekweekt of getransplanteerd voor toepassingen op het gebied van cellotherapie.
Abstract
Cellincapsulatie in alginaatkralen is gebruikt voor geïmmobiliseerde celcultuur in vitro , alsmede voor immunoisolatie in vivo . Inbeslagneming van de alvleesklier is uitgebreid bestudeerd als middel om het overleving van het eiland te verhogen bij allogene of xenogene transplantaties. Alginale inkapseling wordt vaak bereikt door spuit extrusie en externe gelering. Met behulp van deze werkwijze vallen celhoudende alginaatdruppels die gevormd worden aan de punt van mondstukken in een oplossing die tweewaardige kationen bevat die ionotrope alginaatgelering veroorzaken als ze in de druppels diffunderen. De vereiste druppelvorming bij de mondstukpunt beperkt de volumetrische doorvoer en alginaatconcentratie die bereikt kan worden. Deze video beschrijft een schaalbare emulgeringswerkwijze om zoogdiercellen in 0,5% tot 10% alginaat te inkapselen met 70% tot 90% celoverleving. Door deze alternatieve werkwijze worden alginaatdruppeltjes die cellen en calciumcarbonaat bevatten geëmulgeerd in minerale olie, folVerminderd door een afname in de pH die leidt tot interne calciumvrijstelling en ionotrope alginaatgelering. De huidige methode laat de productie van alginaatkralen binnen 20 minuten emulgeren toe. De benodigde apparatuur voor de inkapselingstap bestaat uit eenvoudige geroerde vaten die beschikbaar zijn voor de meeste laboratoria.
Introduction
Mammale celincapsulatie is breedweg bestudeerd als een middel om getransplanteerde cellen te beschermen tegen immuunafwijzing 1 of om een driedimensionale ondersteuning voor geïmmobiliseerde celcultuur 2 , 3 , 4 te verschaffen . Pancreatische holle capsule in alginaatkralen is gebruikt om diabetes in allogene 5 , 6 of xenogene 7 , 8 , 9 , 10 , 11 , 12 knaagdieren om te keren. Preklinische en klinische studies van ingekapselde transplantatie van het alvleesklier om typ 1 diabetes te behandelen zijn aan de gang 13 , 14 , 15 . Voor transplantatie toepassingen of grotere schaalIn vitro geïmmobiliseerde celproductie worden in de buisgeneratoren op mondstuk gebaseerde spuitgeneratoren algemeen gebruikt. Typisch wordt een mengsel van alginaat en cellen gepompt door een mondstuk om druppels te vormen die in een geroerde oplossing bevattende divalente kationen, resulterend in de externe gelering van de druppels, vallen. Coaxiale gasstroom 16 , 17 , spuitvibratie 18 , elektrostatische afstoting 19 of roterende draden 20 vergemakkelijken druppelvorming bij de mondstukpunt.
De belangrijkste nadelen van conventionele kraalgeneratoren zijn hun beperkte doorvoer en het beperkte bereik van oplossingsviscositeiten die resulteren in voldoende kraalvorming 21 . Bij hoge stromingssnelheden breekt de vloeistof uit het mondstuk op in druppels kleiner dan de diameter van de mondstuk, afnemende maatregeling. Multi-nozzle kraalgeneratoren kunnen worden gebruikt om de doorvoer te verhogen, maarDe uniforme verdeling van de stroming tussen de mondstukken en het gebruik van oplossingen> 0.2 Pas is problematisch 22 . Ten slotte wordt verwacht dat alle mondstukken gebaseerd zijn op schade aan eilandjes, aangezien de diameter van de gebruikte spuitpunten tussen 100 μm en 500 μm bedraagt, terwijl ~ 15% van de menselijke holtes groter dan 200 μm 23 kan zijn .
In deze video beschrijven we een alternatieve methode om zoogdiercellen te inkapselen door druppels te vormen in een enkele emulgeringsstap in plaats van drop-by-drop. Aangezien de kraalproductie in een eenvoudig geroerd vat wordt uitgevoerd, is de methode geschikt voor kleine (~ 1 ml) tot grootschalige (10 3 L-range) kraalproductie met lage apparatuurskosten 24 . Met deze methode kan de productie van kralen met hoge sfericiteit worden toegepast met behulp van een breed scala van alginaatviscositeiten met korte ( bijv. 20 min) kraal generatie tijden. Deze methode werd oorspronkelijk ontwikkeld door Poncelet et al. 25 , 26 en gebruikt om DNA 27 , eiwitten 28 te isoleren die insuline 29 en bacteriën 30 omvatten. Wij hebben deze methodes onlangs aangepast aan de inkapseling van zoogdiercellen met behulp van pancreas-bèta-cellijnen 31 , 32 en primaire pancreasweefsel 32 .
Het principe van de werkwijze is het opwekken van een water-in-olie emulsie die bestaat uit alginaatdruppels in minerale olie, gevolgd door inwendige gelering van de alginaatdruppels ( Figuur 1 ). Eerst wordt de inkapselende stof ( bijvoorbeeld cellen) gedispergeerd in een alginaatoplossing die een fijne korrelkalsiumzout bevat met een lage oplosbaarheid bij de initiële proces pH. Het alginaatmengsel wordt vervolgens toegevoegd aan een geroerde organische fase om een emulsie te creëren, gewoonlijk in aanwezigheid van asurfactant. In het geval van zoogdiercelcapsulatie kunnen componenten aanwezig in serum fungeren als oppervlakteactieve stoffen. Vervolgens wordt de pH verminderd om het calciumzout te solubiliseren door een olieoplosbaar zuur dat in de waterfase verdeelt, toe te voegen. Azijnzuur, met een deeltjescoëfficiënt <0,005 33 van minerale olie / water, moet vooraf opgelost worden in olie, daarna aan de emulsie toegevoegd worden, waar het in de oliefase gemengd wordt en snel in de waterfase 34 verdeelt. Figuur 2 illustreert de chemische reacties en diffusie die plaatsvinden tijdens de verzuring en de inwendige gelatingsstap. Tenslotte worden de ingekapselde cellen hersteld door fase-inversie, fasescheiding versneld door centrifugeren, herhaalde wasstappen en filtratie. Deze stappen kunnen vervolgens worden gevolgd door kraal- en celmonstering voor kwaliteitscontroleanalyses, in vitro celkweek en / of transplantatie van de ingekapselde cellen.
<p clasS = "jove_content" voor: keep-together.within-page = "1">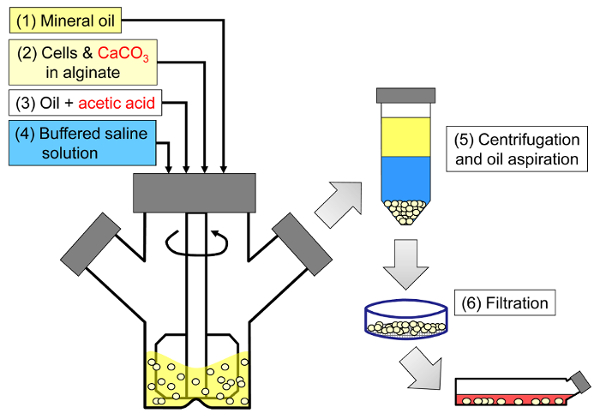
Figuur 1: Schematisch van het emulgeringsgebaseerde proces om zoogdiercellen te inkapselen. Kralen worden eerst geproduceerd door emulgeren van een alginaat-, cel- en CaCO3-mengsel in minerale olie (stappen 1 en 2 in het schema), waardoor inwendige gelering wordt geactiveerd door azijnzuur toe te voegen (stap 3). De geleerde kralen worden vervolgens gescheiden van de olie door een waterige buffer aan te brengen om fase-inversie aan te trekken (stap 4), gevolgd door centrifugeren en olie-aspiratie (stap 5) en vervolgens filtratie (stap 6). Tenslotte worden de kralen verzameld op het filter overgebracht in celkweekmedium voor in vitro kweek of voor transplantatie. Klik hier om een grotere versie van deze figuur te bekijken.
<imgAlt = "Afbeelding 2" class = "xfigimg" src = "/ files / ftp_upload / 55280 / 55280fig2.jpg" />
Figuur 2: Reacties en diffusiestappen die zich voordoen tijdens interne gelatie. (1) azijnzuur wordt toegevoegd aan de organische fase en wordt door convectie naar de alginaatdruppels vervoerd. (2) Het azijnzuur verdeelt in de waterfase. (3) In aanwezigheid van water dissocieert en verspreidt het zuur de CaCO 3- korrels die in donkerblauw worden afgebeeld. (4) De H + -ionen worden uitgewisseld met de Ca2 + -ionen in CaC03, waardoor Ca2 + -ionen vrijkomen. (5) De calciumionen diffunderen tot ze ongereagd alginaat tegenkomen, wat leidt tot de ionotrope verknoping van de alginaatkettingen. Klik hier om een grotere versie van deze figuur te bekijken.
In tegenstelling tot conventionele nozzle-based cell encapsulators, is een brede kralengrootte verdeling expeCted uit dit proces door het mechanisme van druppelvorming in geroerde emulgatie. Voor een subset van applicaties kan deze kralengrootteverdeling problematisch zijn. Bijvoorbeeld, een grotere fractie van cellen kan worden blootgesteld aan het kralenoppervlak in kleinere kralen. Als beperkingen van voedingsstoffen ( bijv. Zuurstof) een zorg zijn, kunnen deze beperkingen in grotere kralen worden verergerd. Een voordeel van de geroerde emulgeringswerkwijze is dat de gemiddelde korrelgrootte gemakkelijk kan worden aangepast door de roering gedurende de emulgeringsstap te veranderen. De breedteverdeling kan ook worden uitgebuit om het effect van kraalgrootte op ingekapselde celprestaties te bestuderen.
Zoogdiercelcapsulatie door emulsificatie en inwendige gelering is een interessant alternatief voor laboratoria die niet zijn uitgerust met een kraalgenerator. Bovendien biedt deze methode gebruikers de mogelijkheid om de verwerkingstijd te verminderen of kralen te genereren bij zeer lage of zeer hoge alginaatconcentratenaties.
Het hieronder beschreven protocol beschrijft hoe cellen in 10,5 ml 5% alginaatoplossing bereid in 10 mM 4- (2-hydroxyethyl) -1-piperazineethaansulfonzuur (HEPES) buffer worden ingekapseld. Het alginaat bestaat uit een 50:50 mengsel van transplantatiegraad LVM (laag viscositeit hoog mannnuronzuurgehalte) en MVG (medium viscositeit hoog guluronzuurgehalte) alginaat. Calciumcarbonaat bij een uiteindelijke concentratie van 24 mM wordt gebruikt als het fysieke verknopingsmiddel. Lichte minerale olie vormt de organische fase, terwijl azijnzuur wordt gebruikt om de emulsie te verzuren en interne gelering te activeren. Echter, het alginaat type en samenstelling, evenals de geselecteerde procesbuffer, hangt af van de gewenste toepassing 32 . Een verscheidenheid van alginaat types (zie tabel van materialen) zijn gebruikt om kralen te produceren met dit protocol.
Protocol
Representative Results
Discussion
Verschillende stappen (afgebeeld in figuur 2 ) tijdens de interne gelatingsreactie kunnen de algemene kinetiek beperken. Voor calciumcarbonaatkorrels groter dan ~ 2,5 μm, is de snelheid van carbonaatoplossing aangetoond dat de snelheidsbeperkende 26 , 44 is . De verzuringstap die leidt tot interne calciumvrijstelling is ook aangetoond dat deze de kritische procesvariabele is die de overleving van cellen 32 beïnvloedt. D…
Disclosures
The authors have nothing to disclose.
Acknowledgements
We bedanken Jill Osborne voor haar grondlegging op het emulgeringsproces en Lauren Wilkinson voor technische ondersteuning. Wij bedanken Dr. Igor Laçik, dr. Timothy J. Kieffer en dr. James D. Johnson voor hun inzet en samenwerking. Wij danken Diabète Québec, JDRF, ThéCell, het Centre québécois sur les matériaux fonctionnels (CQMF), de Natuurwetenschappen en Technische Onderzoeksraad (NSERC), het Centrum voor Human Islet Transplantatie en Beta-Cell Regeneration, het Canadese stamcelnetwerk, de Michael Smith Foundation for Health Research, de Fonds québécois de la recherche sur la nature et les technologies en COST 865 voor financiële steun.
Materials
| Reagents and consumables | |||
| LVM alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #1" in the results. |
| MVG alginate (transplantation-grade) | Novamatrix | Non-applicable | Referred to as "alginate #2" in the results. |
| Alginate (cell culture-grade) | Sigma | A0682 (low viscosity) or A2033 (medium viscosity) | A2033 is referred to as "alginate #3" in the results. |
| DMEM | Life Technologies | 11995-065 | |
| Fetal bovine serum, characterized, Canadian origin | Thermo Fisher Scientific | SH3039603 | |
| Glutamine | Life Technologies | 25030 | |
| Penicillin and streptomycin | Sigma | P4333-100ML | |
| HEPES, cell culture tested | Sigma | H4034-100G | |
| NaCl | Thermo Fisher Scientific | S271-1 | |
| Fine-grain CaCO3 | Avantor Materials | 1301-01 | After preparing the CaCO3 suspension, sonicate and use within one month. |
| Light mineral oil | Thermo Fisher Scientific | O121-4 | Sterile filter through a 0.22 μm pore size membrane prior to use. |
| Glacial acetic acid | Thermo Fisher Scientific | A38-500 | Handle with caution: refer to MSDS. |
| Sterile spatulas | Sigma | CLS3004-100EA | |
| Sterile nylon cell strainers, 40 µm | Thermo Fisher Scientific | 08-771-1 | |
| Serological pipettes (2 mL, 5 mL, 10 mL, 25 mL) | Sarstedt | 86.1252.001, 86.1253.001, 86.1254.001 and 86.1685.001 | |
| Pasteur pipettes | VWR | 14673-043 | |
| Toluidine Blue-O | Sigma | T3260 | |
| Equipment | |||
| 100 mL microcarrier spinner flasks | Bellco | 1965-00100 | The impeller configuration with recent models may not be suitable for adequate emulsification. A blade able to sweep the oil down to 0.5 cm from the bottom of the flask can be custom-made from a Teflon sheet. |
| Magnetic stir plate with adjustable speed | Bellco | 7760-06005 | The rotation speed should be calibrated (e.g. using a tachometer) prior to use. |
| Cell counter | Innovatis | Cedex AS20 | This system is now sold by Roche. This automated cell counter can also be replaced by manual cell enumeration after Trypan blue staining using a hemocytometer. |
| LED light box | Artograph | LightPad® PRO | This item can be replaced by other types of illuminators. |
| Handheld camera | Canon | PowerShot A590 IS | A variety of handheld cameras can be used to capture toluidine blue-o stained bead images. A ruler should be placed next to the Petri dish containing the beads prior to acquiring images. |
| Fluorescence microscope with phase contrast and adequate fluorescence filters | Olympus | IX81 | Several microscopy systems were used to image the beads. The results shown here were obtained with an IX81 microscope equipped with GFP and TRITC fluorescence filters. To capture entire beads, 4X to 20X objectives were used depending on the agitation rate. Live/dead staining images were typically captured with 20X to 40X objectives. |
| Image aquisition software | Molecular Devices | Metamorph | A variety of image acquisition software can be used to acquire phase contrast and fluorescence images. |
| Image analysis freeware | CellProfiler | Non-applicable | A variety of image analysis software can be used to identify beads as objects and analyze bead size (e.g. ImageJ). |
References
- Scharp, D. W., Marchetti, P. Encapsulated islets for diabetes therapy: history, current progress, and critical issues requiring solution. Adv Drug Deliv Rev. 67-68, 35-73 (2014).
- Chayosumrit, M., Tuch, B., Sidhu, K. Alginate microcapsule for propagation and directed differentiation of hESCs to definitive endoderm. Biomaterials. 31 (3), 505-514 (2010).
- Sidhu, K., Kim, J., Chayosumrit, M., Dean, S., Sachdev, P. Alginate microcapsule as a 3D platform for propagation and differentiation of human embryonic stem cells (hESC) to different lineages. J Vis Exp. (61), (2012).
- Tostoes, R. M., et al. Perfusion of 3D encapsulated hepatocytes–a synergistic effect enhancing long-term functionality in bioreactors. Biotechnol Bioeng. 108 (1), 41-49 (2011).
- Duvivier-Kali, V. F., Omer, A., Parent, R. J., O’Neil, J. J., Weir, G. C. Complete protection of islets against allorejection and autoimmunity by a simple barium-alginate membrane. Diabetes. 50 (8), 1698-1705 (2001).
- Omer, A., et al. Long-term normoglycemia in rats receiving transplants with encapsulated islets. Transplantation. 79 (1), 52-58 (2005).
- Rayat, G. R., Rajotte, R. V., Ao, Z., Korbutt, G. S. Microencapsulation of neonatal porcine islets: protection from human antibody/complement-mediated cytolysis in vitro and long-term reversal of diabetes in nude mice. Transplantation. 69 (6), 1084-1090 (2000).
- Korbutt, G. S., Mallett, A. G., Ao, Z., Flashner, M., Rajotte, R. V. Improved survival of microencapsulated islets during in vitro culture and enhanced metabolic function following transplantation. Diabetologia. 47 (10), 1810-1818 (2004).
- Luca, G., et al. Improved function of rat islets upon co-microencapsulation with Sertoli’s cells in alginate/poly-L-ornithine. AAPS PharmSciTech. 2 (3), E15 (2001).
- Omer, A., et al. Survival and maturation of microencapsulated porcine neonatal pancreatic cell clusters transplanted into immunocompetent diabetic mice. Diabetes. 52 (1), 69-75 (2003).
- Schneider, S., et al. Long-term graft function of adult rat and human islets encapsulated in novel alginate-based microcapsules after transplantation in immunocompetent diabetic mice. Diabetes. 54 (3), 687-693 (2005).
- Cui, H., et al. Long-term metabolic control of autoimmune diabetes in spontaneously diabetic nonobese diabetic mice by nonvascularized microencapsulated adult porcine islets. Transplantation. 88 (2), 160-169 (2009).
- Krishnan, R., Alexander, M., Robles, L., Foster, C. E., Lakey, J. R. Islet and stem cell encapsulation for clinical transplantation. Rev Diabet Stud. 11 (1), 84-101 (2014).
- Robles, L., Storrs, R., Lamb, M., Alexander, M., Lakey, J. R. Current status of islet encapsulation. Cell Transplant. 23 (11), 1321-1348 (2014).
- Desai, T., Shea, L. D. Advances in islet encapsulation technologies. Nat Rev Drug Discov. , (2016).
- Anilkumar, A. V., Lacik, I., Wang, T. G. A novel reactor for making uniform capsules. Biotechnol Bioeng. 75 (5), 581-589 (2001).
- Wolters, G. H., Fritschy, W. M., Gerrits, D., van Schilfgaarde, R. A versatile alginate droplet generator applicable for microencapsulation of pancreatic islets. J Appl Biomater. 3 (4), 281-286 (1991).
- Heinzen, C., Marison, I., Berger, A., von Stockar, U. Use of vibration technology for jet break-up for encapsulation of cells, microbes and liquids in monodisperse microcapsules. Practical Aspects of Encapsulation Technologies. , 19-25 (2002).
- Poncelet, D., et al. A Parallel plate electrostatic droplet generator: Parameters affecting microbead size. Applied Microbiology and Biotechnology. 42 (2-3), 251-255 (1994).
- Prüße, U., Dalluhn, J., Breford, J., Vorlop, K. D. Production of Spherical Beads by JetCutting. Chemical Engineering & Technology. 23 (12), 1105-1110 (2000).
- Hoesli, C. A. . Bioprocess development for the cell-based treatment of diabetes (PhD thesis). , (2010).
- Brandenberger, H., Widmer, F. A new multinozzle encapsulation/immobilisation system to produce uniform beads of alginate. J Biotechnol. 63 (1), 73-80 (1998).
- Merani, S., Toso, C., Emamaullee, J., Shapiro, A. M. Optimal implantation site for pancreatic islet transplantation. Br J Surg. 95 (12), 1449-1461 (2008).
- Reis, C. P., Neufeld, R. J., Vilela, S., Ribeiro, A. J., Veiga, F. Review and current status of emulsion/dispersion technology using an internal gelation process for the design of alginate particles. J Microencapsul. 23 (3), 245-257 (2006).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. I. Methodology. Appl Microbiol Biotechnol. 38 (1), 39-45 (1992).
- Poncelet, D., et al. Production of alginate beads by emulsification/internal gelation. II. Physicochemistry. Applied Microbiology and Biotechnology. 43 (4), 644-650 (1995).
- Alexakis, T., et al. Microencapsulation of DNA within alginate microspheres and crosslinked chitosan membranes for in vivo application. Appl Biochem Biotechnol. 50 (1), 93-106 (1995).
- Vandenberg, G. W., De La Noue, J. Evaluation of protein release from chitosan-alginate microcapsules produced using external or internal gelation. J Microencapsul. 18 (4), 433-441 (2001).
- Silva, C. M., Ribeiro, A. J., Figueiredo, I. V., Goncalves, A. R., Veiga, F. Alginate microspheres prepared by internal gelation: development and effect on insulin stability. Int J Pharm. 311 (1-2), 1-10 (2006).
- Larisch, B. C., Poncelet, D., Champagne, C. P., Neufeld, R. J. Microencapsulation of Lactococcus lactis subsp. cremoris. J Microencapsul. 11 (2), 189-195 (1994).
- Hoesli, C. A., et al. Reversal of diabetes by betaTC3 cells encapsulated in alginate beads generated by emulsion and internal gelation. J Biomed Mater Res B Appl Biomater. 100 (4), 1017-1028 (2012).
- Hoesli, C. A., et al. Pancreatic cell immobilization in alginate beads produced by emulsion and internal gelation. Biotechnol Bioeng. 108 (2), 424-434 (2011).
- Reinsel, M. A., Borkowski, J. J., Sears, J. T. Partition Coefficients for Acetic, Propionic, and Butyric Acids in a Crude Oil/Water System. Journal of Chemical & Engineering Data. 39 (3), 513-516 (1994).
- Xiu-Dong, L., Wei-Ting, Y., Jun-Zhang, L., Xiao-Jun, M., Quan, Y. Diffusion of acetic acid across oil/water interface in emulsification-internal gelation process for preparation of alginate gel beads. Chemical Research in Chinese Universities. 23 (5), 579-584 (2007).
- Fernandez, S. A., et al. Emulsion-based islet encapsulation: predicting and overcoming islet hypoxia. Bioencapsulation Innovations. (220), 14-15 (2014).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Hinze, J. O. Fundamentals of the hydrodynamic mechanism of splitting in dispersion processes. AIChE Journal. 1 (3), 289-295 (1955).
- Kolmogorov, A. N. On the breakage of drops in a turbulent flow (translated from Russian). Doklady Akademii Nauk. 66, 825-828 (1949).
- Davies, J. T. Drop Sizes of Emulsions Related to Turbulent Energy-Dissipation Rates. Chemical Engineering Science. 40 (5), 839-842 (1985).
- Pacek, A. W., Chamsart, S., Nienow, A. W., Bakker, A. The influence of impeller type on mean drop size and drop size distribution in an agitated vessel. Chemical Engineering Science. 54 (19), 4211-4222 (1999).
- Steiner, H., et al. Numerical simulation and experimental study of emulsification in a narrow-gap homogenizer. Chemical Engineering Science. 61 (17), 5841-5855 (2006).
- Tcholakova, S., Denkov, N. D., Lips, A. Comparison of solid particles, globular proteins and surfactants as emulsifiers. Phys Chem Chem Phys. 10 (12), 1608-1627 (2008).
- Lagisetty, J. S., Das, P. K., Kumar, R., Gandhi, K. S. Breakage of viscous and non-Newtonian drops in stirred dispersions. Chemical Engineering Science. 41 (1), 65-72 (1986).
- Draget, K. I., Ostgaard, K., Smidsrod, O. Homogeneous Alginate Gels – a Technical Approach. Carbohydrate Polymers. 14 (2), 159-178 (1990).
- Poncelet, D., Dulieu, C., Jacquot, M., Wijffels, R. H. . Immobilized Cells. , 15-30 (2001).
- Islam, A. W., Zavvadi, A., Kabadi, V. N. Analysis of Partition Coefficients of Ternary Liquid-Liquid Equilibrium Systems and Finding Consistency Using Uniquac Model. Chemical and Process Engineering-Inzynieria Chemiczna I Procesowa. 33 (2), 243-253 (2012).
- Quong, D., Neufeld, R. J., Skjak-Braek, G., Poncelet, D. External versus internal source of calcium during the gelation of alginate beads for DNA encapsulation. Biotechnol Bioeng. 57 (4), 438-446 (1998).
- De Vos, P., De Haan, B. J., Van Schilfgaarde, R. Upscaling the production of microencapsulated pancreatic islets. Biomaterials. 18 (16), 1085-1090 (1997).
- Gross, J. D., Constantinidis, I., Sambanis, A. Modeling of encapsulated cell systems. J Theor Biol. 244 (3), 500-510 (2007).

