Hydrolyse av en Ni-Schiff-basekompleks ved hjelp av betingelser som er egnet for oppbevaring av syre-labil beskyttelsesgrupper
Summary
Her presenterer vi en effektiv hydrolyse og påfølgende Fmoc-beskyttelse av en aminosyre isolert fra en Ni-Schiff-base-kompleks. Hydrolysebetingelser som er presentert her er egnet for bruk ved oppbevaring av syrelabile sidekjedebeskyttelsesgrupper er nødvendig. Denne teknikk kan tilpasses til en rekke forskjellige unaturlige aminosyre-substrater.
Abstract
Unaturlige aminosyrer, aminosyrer inneholdende sidekjede-funksjonaliteter ikke er vanlig ved natur, blir i økende grad funnet i syntetiske peptidsekvenser. Syntesen av noen ikke-naturlige aminosyrer inkluderer ofte bruk av en forløper bestående av en Schiff-base-stabilisert av en nikkel-kation. Unaturlige sidekjeder kan være installert på en aminosyre hovedkjede som finnes i denne Schiff-base-kompleks. Den resulterende unaturlig aminosyre kan deretter isoleres fra dette komplekset ved hjelp av hydrolyse av Schiff-basen, for eksempel ved anvendelse av tilbakeløpskjøling i sterkt sur løsning. Disse sterkt sure betingelser kan fjerne syrelabile sidekjedebeskyttende grupper som er nødvendig for de ikke-naturlige aminosyrer som skal anvendes i mikrobølgeassistert fast-fase peptidsyntese. I dette arbeidet presenterer vi en effektiv hydrolyse og påfølgende Fmoc-beskyttelse av en aminosyre isolert fra en Ni-Schiff-base-kompleks. Hydrolysebetingelser som er presentert i dette arbeidet er egnet for oppbevaring av syrelabile side-kjedebeskyttende grupper, og kan være tilpasningsdyktig til forskjellige unaturlige aminosyre-substrater.
Introduction
Unaturlige aminosyrer (UAA s) bærende sidekjeder som varierer fra de av de tyve naturlig forekommende aminosyrer som finnes i naturen, har funnet anvendelse i et bredt spekter av anvendelser. Syntese av disse UAA s, men kan være vanskelig avhengig av strukturen av sidekjedene og stereokjemien av aminosyren ryggrad. CH bond aktivering av glycin i forbindelse med en nikkel Schiff-basen komplekset har blitt anvendt for å fremstille en rekke av amino- syrederivater inkludert α, p-diamino-syrer 1 og UAA peiling fluorert 2 eller heterocykliske sidekjeder. 3
Etter tilsetning av unaturlige sidekjeder, funksjonaliserte UAA-er er typisk fjernet fra Schiff-base-kompleks ved tilbakeløp i saltsyre og 4 blir deretter isolert ved hjelp av ionebyttekromatografi. Mens vanligvis effektiv, genererer denne protokollen enMino syrer som kan være uegnet for bruk i fastfase-peptidsyntese (SPPS). Naturen av SPPS krever tilstedeværelse av syrelabile sidekjedebeskyttende grupper, og den sterkt sure natur av typiske Ni-Schiff-basen dekomponeringsbetingelser forhindrer isolering av UAA s med disse beskyttelsesgruppene intakt. Så vidt vi vet, har bare ett alternativ dekomponeringsmetoden blitt rapportert: anvendelse av etylendiamintetraeddiksyre (EDTA) og hydrazin ved forhøyede temperaturer, 5 betingelser som i seg selv ikke kan være egnet for noen sidekjedebeskyttende grupper slik som ftalimider.
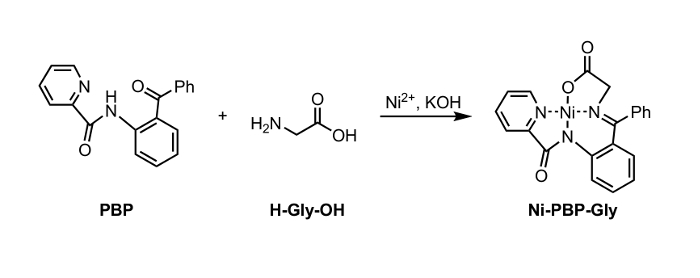
Figur 1: Syntese av Ni-PBP-Gly fra Ni2 +, PBP, og glysin (Gly). Klikk her for å se en større versjon av dette tallet. </a>
Heri, rapporterer en metode for hydrolyse av en Ni-Schiff-base-kompleks, Ni-PBP-Gly (figur 1). Dette komplekset, avledet fra Ni2 +, glycin, og pyridin-2-karboksylsyre (2-benzoyl-fenyl) -amid (PBP), 6 har vist seg å være en nyttig plattform for syntese av en rekke UAA og er lett tilgjengelige ved hjelp av en to-trinns synteseveien. 7 Syntese av dette komplekset er litteratur-precedented i høyt utbytte. 6 Våre resultater som er beskrevet nedenfor demonstrerer anvendeligheten av hydrolyse-betingelser under anvendelse av EDTA ved svakt sur til nøytral pH-betingelser som er passende for bruk sammen med UAA peiling syrelabile sidekjedebeskyttende grupper. Etter hydrolyse, kan den resulterende vandige oppløsning bli isolert og umiddelbart underkastet standard Fmoc beskyttelsesbetingelser for å gi et Fmoc-beskyttet aminosyre (figur 2).
<p class="jove_content" fo: keep-together.within-page = "1">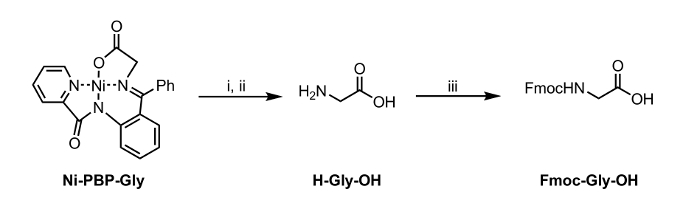
Figur 2: Hydrolyse og Fmoc-beskyttelse av en aminosyre Isolert fra Ni-PBP-Gly. Reaksjonsbetingelser: i. EDTA (12 ekv), pH 4,5; ii. Etylacetat-vaskematerialet og justering til pH 7; iii. Fmoc-OSu (1 ekv), NaHCO3 (2 ekv). Klikk her for å se en større versjon av dette tallet.
Protocol
Representative Results
Discussion
Den protokoll som er beskrevet ovenfor er hensiktsmessig ved sin evne til å lette isoleringen av en aminosyre hovedkjede fra en Ni-Schiff-base-kompleks under milde pH-betingelser og påfølgende Fmoc-beskyttelses av dette isolerte aminosyre gjennom to kritiske trinn. Det første trinn medfører røring av en DMF / vann-oppløsning inneholdende EDTA for å lette frigivelse av aminosyren fra komplekset. Gjenværende komplekse eller organiske biprodukter kan lett fjernes med ekstraksjon. Det andre trinnet av denne protoko…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Finansiering fra Slippery Rock-universitetet. Vi ønsker å takke T. Boron III (Slippery Rock-universitetet) og C. Haney (University of Pennsylvania) for sin innsikt.
Materials
| Ni-PBP-Gly | Synthesized from published protocol | ||
| DMF | Fisher | D119-4 | |
| EDTA | Fisher | S311-100 | |
| Dichloromethane | Acros | AC610050040 | |
| Sodium Bicarbonate | Fisher | S233-500 | |
| Fmoc-OSu | Chem-Impex | "00147" | |
| Dioxane | Fisher | D111-500 | |
| Hydrochloric Acid | Fisher | A144-500 | |
| Ethyl Acetate | Acros | AC610060040 | |
| Magnesium Sulfate | Fisher | M65-500 | |
| ZEOPrep 60ECO Silica Gel | ZEOChem | ||
| Hexanes | Fisher | 3200250.650.443 | |
| Chromatography Column | |||
| pH Test Strips | |||
| Rotary Evaporator | |||
| 250 mL Separatory Funnel | |||
| 250 mL Round Bottom Flask | |||
| Stir Bar | |||
| Stir Plate |
References
- Wang, J., Shi, T., Deng, G., Jiang, H., Liu, H. Highly Enantio- and Diastereoselective Mannich Reactions of Chiral Ni(II) Glycinates with amino sulfones. Efficient asymmetric synthesis of aromatic α,β-diamino acids. J. Org. Chem. 73 (21), 8563-8570 (2011).
- Wang, J., Lin, D., Zhou, S., Ding, X., Soloshonok, V. A., Liu, H. Asymmetric synthesis of sterically and electronically demanding linear ω,-trifluoromethyl containing amino acids via alkylation of chiral equivalents of nucleophilic glycine and alanine. J. Org. Chem. 76 (2), 684-687 (2011).
- Wang, J., Zhou, S., Lin, D., Ding, X., Jiang, H., Liu, H. Highly diastereo- and enantioselective synthesis of syn-β,-substituted tryptophans via asymmetric Michael addition of a chiral equivalent of nucleophilic glycine and sulfonylindoles. Chem. Commun. 47 (29), 8355-8357 (2011).
- Belokon, Y. N. Highly efficient catalytic synthesis of α,-amino acids under phase-transfer conditions with a novel catalyst/substrate pair. Angew. Chem. Int. Ed. 40 (10), 1948-1951 (2001).
- Zhou, S., Wang, J., Lin, D., Zhao, F., Liu, H. Enantioselective synthesis of 2-substituted-tetrahydroisoquinolin-1-yl glycine derivatives via oxidative cross-dehydrogenative coupling of tertiary amines and chiral nickel(II) glycinate. J. Org. Chem. 78 (22), 11204-11212 (2013).
- Belokon, Y. N. Synthesis of α,-amino acids via asymmetric phase transfer-catalyzed alkylation of achiral nickel(II) complexes of glycine-derived Schiff bases. J. Am. Chem. Soc. 125 (42), 12860-12871 (2003).
- Ueki, H., Ellis, T. K., Martin, C. H., Soloshonok, V. A. Efficient large-scale synthesis of picolinic acid-derived nickel(II) complexes of glycine. Eur. J. Org. Chem. 2003 (10), 1954-1957 (2003).
- Dener, J. M., Fantauzzi, P. P., Kshirsagar, T. A., Kelly, D. E., Wolfe, A. B. Large-scale syntheses of Fmoc-protected non-proteogenic amino acids: useful building blocks for combinatorial libraries. Org. Process Res. Dev. 5 (4), 445-449 (2001).
- Cruz, L. J., Beteta, N. G., Ewenson, A., Albericio, F. "One-pot", preparation of N-carbamate protected amino acids via the azide. Org Process Res. Dev. 8 (6), 920-924 (2004).
- Hart, J. R. . Ullmann’s Encyclopedia of Industrial Chemistry. , (2000).
- Adamson, J. G., Blaskovich, M. A., Groenevelt, H., Lajoie, G. A. Simple and convenient synthesis of tert-butyl ethers of Fmoc-serine, Fmoc-threonine, and Fmoc-tyrosine. J. Org. Chem. 56 (10), 3447-3449 (1991).
- Seyfried, M. S., Lauber, B. S., Luedtke, N. W. Multiple-turnover isotopic labeling of Fmoc- and Boc-protected amino acids with oxygen isotopes. Org. Lett. 12 (1), 104-106 (2010).
- Bonke, G., Vedel, L., Witt, M., Jaroszewski, J. W., Olsen, C. A., Franzyk, H. Dimeric building blocks for solid-phase synthesis of α,-peptide-β,-peptoid chimeras. Synthesis. 2008 (15), 2381-2390 (2008).

