En Vivo EPR evaluación de pH, pO2, estado Redox y concentraciones de fosfato y glutatión en el microambiente tumoral
Summary
Resonancia paramagnética electrónica de bajo campo (banda L, 1.2 GHz) usando puntas de prueba nitroxyl y trityl soluble se demuestra para la evaluación de parámetros fisiológicamente importantes en el microambiente tumoral en modelos de ratón de cáncer de mama.
Abstract
Este protocolo demuestra la capacidad de resonancia paramagnética electrónica de bajo campo (EPR)-basado en técnicas en combinación con sondas paramagnéticas funcionales para proporcionar información cuantitativa sobre el microambiente tumoral química (TME), incluyendo p O2, pH, estado redox, concentraciones de fosfato inorgánico intersticial (Pi) e intracelulares del glutatión (GSH). En particular, una aplicación de una sonda de trityl multifuncional soluble recientemente desarrollado proporciona oportunidad sin igual para en vivo mediciones simultáneas de pH, pO2 y Pen E xtracellular espacio (sonda de esperanza). Las mediciones de tres parámetros con una sola sonda permiten sus análisis de la correlación independientes de distribución de la sonda y el tiempo de las mediciones.
Introduction
Un papel clave de lo TME en la progresión del cáncer y terapia es cada vez más apreciado1. Entre los parámetros fisiológicos importantes de TME en tumores sólidos tejidos hipoxia2, acidosis3,4, reducción alta capacidad5, concentraciones elevadas de GSH intracelular6,7, e intersticial Pi8 están bien documentados. No invasiva in vivo pO2, pH, Pi, GSH y redox evaluaciones proporcionan perspectivas únicas en los procesos biológicos en TME y ayudar a avance de herramientas para la detección preclínica de fármacos contra el cáncer y estrategias terapéuticas dirigidas de TME. Una profundidad de penetración razonable por radiofrecuencia en los tejidos por la proyección de imagen de resonancia magnética (MRI) y las técnicas basadas en la EPR bajo campo hace que los enfoques más apropiados para la evaluación no invasiva de estos parámetros TME. MRI se basa en gran medida en la proyección de imagen de los protones de agua y es ampliamente utilizado en contextos clínicos para proporcionar resolución anatómica pero carece de resolución funcional. Las mediciones de resonancia magnética fósforo-31 (31P-NMR) de extracelular concentración de Pi y de pH basado en una señal de fosfato endógeno son potencialmente atractivas para la caracterización de TME, pero normalmente son enmascaradas por varias veces mayor intracelular Pi concentraciones9,10. En contraste con esto, las medidas del EPR dependen de espectroscopia y proyección de imagen especialmente diseñado sondas paramagnéticas para proporcionar resolución funcional. Nota que exógeno EPR sondas tienen una ventaja sobre exógeno NMR sondas debido a la mucha mayor sensibilidad intrínseca de EPR y la ausencia de señales EPR fondo endógeno. El reciente desarrollo de una función dual pH y redox nitroxyl sonda11 y multifuncional trityl sonda12 ofrece oportunidades sin igual para en vivo mediciones simultáneas de varios parámetros TME y sus Análisis de correlación independientes en la distribución de la sonda y el tiempo de medición. A nuestro conocimiento, no existen otros métodos disponibles para evaluar simultáneamente en vivo parámetros TME químicos fisiológico importantes en temas de la vida, como pO2, pHe, Pi, redox y GSH.
Sondas para En Vivo Funcionales medidas:
La figura 1 muestra las estructuras químicas de las sondas paramagnéticas utilizadas para acceder a los parámetros TME, que incluyen sondas solubles y particuladas. Alta sensibilidad funcional, estabilidad en tejido vivo y mínima toxicidad son algunos de los beneficios que hacen sondeos partículas preferidos sobre sondas soluble para oximetría de EPR en vivo . Por ejemplo, sondas de partículas aumentaron tiempos de retención en el sitio de implante de tejido comparado con sondas soluble, lo que permite la medición longitudinal de tejido pO2 durante varias semanas. Por el contrario, solubles sondas superan sondas partículas proporcionando mediciones espacial resuelto mediante EPR-técnicas de imagen así como permitiendo análisis concomitantes de múltiples funcionalidades (pO2, pH, Pi, redox, y GSH).
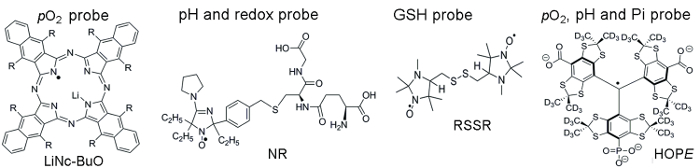
Figura 1. Estructuras químicas de las sondas paramagnéticas que ensayo de evaluación de TME. Esto incluye la punta de prueba de partículas pO2 , LiNc-BuO (R = – O (CH2)3CH3) y solubles sondas: sonda de pH y redox de doble función, NR; GSH-sensible a la sonda, RSSR; y múltiples funciones pO2, pH y sonda de Pi del microambiente extracelular, la sonda de esperanza. La síntesis de estas sondas se ha descrito en las referencias proporcionado 11,12. Haga clic aquí para ver una versión más grande de esta figura.
Protocol
Representative Results
Discussion
Los métodos presentados permiten para la evaluación no invasiva en vivo de los parámetros críticos de la TME química, es decir pO2, pH, estado redox y concentraciones de GSH intracelular y Pi intersticial. Técnicas de resonancia magnética, MRI como EPR bajo campo, son los métodos de elección para no invasiva en vivo perfiles de estos parámetros TME. MRI visualiza estructuras anatómicas pero carece de sensibilidad funcional. En contraste con RMN, EPR técnicas proporcionan …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Este trabajo fue parcialmente financiado por los NIH concede CA194013, CA192064 y U54GM104942. El WVCTSI es reconocido para la puesta en marcha para VVK, AB y TDE. Los autores agradecen la ayuda con los experimentos ilustrativos Dr. M. Gencheva y K. Steinberger. El contenido es responsabilidad exclusiva de los autores y no representan necesariamente la opinión oficial de los NIH.
Materials
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
References
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).

