In Vivo EPR bedömning av pH, pO2, Redox Status, och koncentrationer av fosfat och glutation i den tumör mikromiljö
Summary
Låg-fältet (L-band, 1,2 GHz) elektron paramagnetiska resonans med lösliga nitroxyl och trityl sonder demonstreras för bedömning av fysiologiskt viktiga parametrar i den tumör närmiljön i musmodeller av bröstcancer.
Abstract
Detta protokoll visar kapaciteten hos låg-fältet elektron paramagnetiska resonans (EPR)-baserade tekniker i kombination med funktionell paramagnetiska sonder för att ge kvantitativa uppgifter om de kemiska tumör närmiljön (TME), inklusive p O2, pH, redox status, koncentrationer av interstitiell oorganiskt fosfat (Pi) och intracellulära glutation (GSH). I synnerhet en ansökan av en nyligen utvecklad lösliga multifunktionella trityl sond ger oöverträffad möjlighet för in vivo samtidiga mätningar av pH, pO2 och Pi E xtracellular utrymme (hopp probe). Mätningar av tre parametrar med hjälp av en enda sond möjliggör deras korrelation analyser som är oberoende av sonden distribution och tiden för mätningarna.
Introduction
En nyckelroll i TME i cancer progression och terapi är alltmer uppskattad1. Bland viktiga fysiologiska parametrar av TME i vävnad hypoxi2, hög reducerande kapacitet5, acidos3,4, solida tumörer, förhöjda halter av intracellulära GSH6,7, och interstitiell Pi8 är väl dokumenterade. Noninvasiv invivo pO2, pH, Pi, GSH och redox bedömningar ger unika insikter i biologiska processer i TME och hjälpa förskott verktyg för pre-klinisk screening av läkemedel mot cancer och TME-riktade behandlingsstrategier. En rimlig radiofrekvent genomträngningsdjupet i vävnader av magnetisk resonanstomografi (MRT) och låg-fältet EPR-baserade tekniker gör dem de mest lämpliga metoderna för icke-invasiv bedömning av dessa TME-parametrar. MRI bygger till stor del på imaging vatten protoner och används ofta i kliniska inställningar för att tillhandahålla anatomisk upplösning men saknar funktionell upplösning. Fosfor-31 kärnmagnetisk resonans (31P-NMR) mätningarna extracellulära Pi koncentration och pH baserat på en signal från endogena fosfat är potentiellt attraktiva för TME karakterisering, men är vanligtvis maskerade av flera gånger högre intracellulära Pi koncentrationer9,10. I kontrast till detta, EPR mätningar lita på spektroskopi och avbildning av speciellt utformade paramagnetiska sonder att tillhandahålla funktionell upplösning. Observera att exogena EPR sonder har en fördel över exogena NMR sonder på grund av mycket högre inneboende känslighet EPR och avsaknad av endogena bakgrund EPR signaler. Den senaste utvecklingen av en dubbel funktion pH och redox nitroxyl probe11 och multifunktionella trityl sond12 ger oöverträffade möjligheter för i vivo samtidiga mätningar av flera TME parametrar och deras korrelation analyser oberoende på sonden distribution och tid för mätningen. Såvitt vi vet finns det inga andra metoder som är tillgängliga för att samtidigt bedöma i vivo fysiologiskt viktiga kemiska TME parametrar i levande ämnen, såsom pO2, pHe, Pi, redox och GSH.
Sonder för In Vivo Funktionella mått:
Figur 1 visar kemiska strukturer av de paramagnetiska sonder används för åtkomst till TME faktorer, som inbegriper partiklar och lösliga sonder. Hög funktionell känslighet, stabilitet i levande vävnad och minimal toxicitet är några fördelar som gör partiklar sonder föredrog över lösligt sonder för i vivo EPR pulsoximetri. Till exempel ökat partiklar sonder retentionstider på platsen för vävnad implantat jämfört med lösligt sonder möjliggör längsgående mätning av vävnad pO2 över flera veckor. Däremot, lösliga sonder överträffa partiklar sonder genom att ge rumsliga-löst mätningar med EPR-baserat imaging tekniker samt möjliggör samtidig analyser från flera funktioner (pO2, pH, Pi, redox, och GSH).
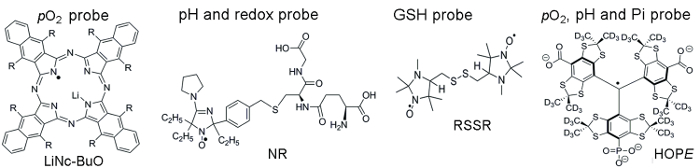
Figur 1. Kemiska strukturer i de paramagnetiska sonder som montera TME bedömning assay. Detta inkluderar partiklar pO2 sonden, LiNc-BuO (R = – O (CH2)3CH3), och lösliga sonder: dubbel funktion pH och redox probe, NR; GSH-känsliga probe, GFDFJH; och multifunktionell pO2, pH och Pi sonden av den extracellulära mikromiljö, hopp sonden. Syntesen av dessa sonder har beskrivits i den medföljande referenser 11,12. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
De presenterade metoderna möjliggör noninvasiv i vivo bedömning av kritiska parametrarna för den kemiska TME, nämligen pO2, pH, redox status och koncentrationer av interstitiell Pi och intracellulära GSH. Magnetisk resonans tekniker, såsom MRI och låg-fältet EPR, är metoderna för val av noninvasiv i vivo profilering av dessa TME-parametrar. MRT visualiserar anatomiska strukturer men saknar funktionell känslighet. I motsats till MRI ger EPR tekniker funktionella känslighe…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Detta arbete var delvis stöds av NIH grants CA194013, CA192064 och U54GM104942. WVCTSI är erkänt för uppstart till VVK, AB, och TDE. Författarna tackar Dr. M. Gencheva och K. Steinberger för hjälpen med de belysande experiment. Innehållet ansvarar enbart för författarna och representerar inte nödvändigtvis officiella ståndpunkter av NIH.
Materials
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
References
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).

