Enzymatische Cascade reacties voor de synthese van chirale Amino alcoholen van L-lysine
Summary
Chirale amino alcoholen zijn veelzijdige moleculen voor gebruik als steigers in de organische synthese. Vanaf L-lysine, synthetiseren we amino alcoholen door een reactie van de enzymatische trapsgewijs combineren diastereoselective C-H oxidatie gekatalyseerd door dioxygenase gevolgd door splitsing van het carbonzuur deel van het overeenkomstige aminozuur van de hydroxyl door een decarboxylase.
Abstract
Amino alcoholen zijn veelzijdige verbindingen met een breed scala van toepassingen. Bijvoorbeeld, zijn zij als chirale steigers in de organische synthese gebruikt. Hun synthese door conventionele organische chemie vereist vaak vervelend scriptingregel syntheseprocessen, met moeilijk controle van de stereochemische uitkomst. We presenteren een protocol bij enzymatisch synthetize amino alcoholen vanaf de beschikbaar L-lysine in 48u. Dit protocol combineert twee chemische reacties die zeer moeilijk uit te voeren door conventionele organische synthese. In de eerste stap, de regio- en diastereoselective oxidatie van een unactivated obligatie van de C-H voor de lysine wordt zijketen gekatalyseerd door een dioxygenase; een tweede regio- en diastereoselective oxidatie gekatalyseerd door een regiodivergent dioxygenase kan leiden tot de vorming van de 1,2-diolen. In de laatste stap, de carboxylic groep van het Alfa-aminozuur is gekloofd door een decarboxylase pyridoxal-fosfaat (PLP) (DC). Deze decarboxylative stap is alleen van invloed op de alpha koolstof van het aminozuur, behoud van de hydroxy-gesubstitueerde stereogenic center in een beta/gamma positie. De resulterende amino alcoholen zijn daarom optisch verrijkt. Het protocol werd met succes toegepast op de semipreparative-schaal synthese van vier amino alcoholen. Monitoring van de reacties werd uitgevoerd door hoge prestatie vloeibare chromatografie (HPLC) na bewerking door 1-fluoro-2,4-dinitrobenzeen. Eenvoudige zuivering door solid-phase extraction (SPE) geboden de amino alcoholen met uitstekende rendementen (93% tot > 95%).
Introduction
Ondanks de voordelen aangeboden door biokatalyse, blijft de integratie van biokatalytische stappen in synthetische trajecten of totale Biokatalytische routes meestal beperkt tot enzymatische kinetische resoluties. Deze routes hebben op grote schaal gebruikt als een eerste stap in asymmetrische chemo-enzymatische reacties, maar biokatalyse biedt veel meer mogelijkheden in functionele groep interconversies met hoge stereoselectiviteit1,2,3 . Bovendien, zoals Biokatalytische reacties zijn uitgevoerd in vergelijkbare omstandigheden, daarom is het haalbaar is voor het uitvoeren van trapsgewijze reacties in een één-pot mode4,5.
Chirale amino alcoholen zijn veelzijdige moleculen voor gebruik als assistenten of steigers in organische synthese6. De amino alcohol deel daarvan wordt vaak gevonden in secundaire metabolieten en in actieve farmaceutische ingrediënten (API). Primaire β-amino alcoholen zijn gemakkelijk beschikbaar van de bijbehorende α-aminozuren door conventionele chemische synthese, maar toegang tot chirale γ-amino alcoholen of secundaire amino alcoholen vereist vaak vervelend synthetische trajecten samen met gevoelige controle van de stereochemie7,8,9,10. Als gevolg van de hoge stereoselectiviteit, kan biokatalyse bieden een superieure synthetische route naar deze chirale bouwstenen11,12,13,14.
We eerder gemeld de synthese van mono – en di-hydroxy-L-lysines door enzymatische hydroxylatie diastereoselective gekatalyseerd door dioxygenases van het ijzer (II) / α-ketoacid-afhankelijke oxygenase familie (αKAO) (Figuur 1)15. In het bijzonder vanaf L-lysine, de KDO1 dioxygenase katalyseert de vorming van de (3S) – hydroxy derivaat (1), terwijl de (4R) – derivaat (2) wordt gevormd door de reactie met KDO2 dioxygenase. Opeenvolgende regiodivergent hydroxyleringen door KDO1 en KDO2 leiden tot de vorming van de (3R, 4R) – dihydroxy – L-lysine (3) in optisch zuivere vorm. Het bereik van de beperkte substraat van deze enzymen belemmert echter hun grote gebruik in de chemische synthese, met name in de hydroxylatie van eenvoudige amines, zoals een carbonzuur deel daarvan in de α-positie van de aminogroep essentieel voor de activiteit16 is.
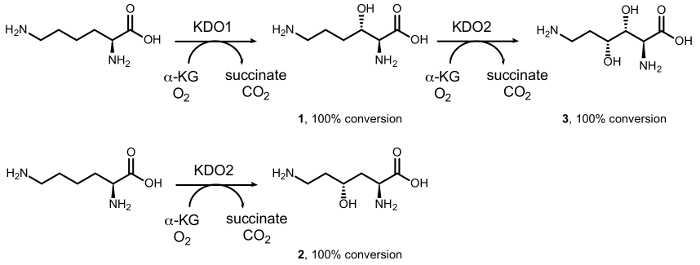
Figuur 1: Biokatalytische conversies van L-lysine. Omzetting in (3S) – hydroxy – L-lysine (1) gekatalyseerd door KDO1 de dioxygenase; (4R) – hydroxy – L-lysine (2) gekatalyseerd door KDO2 de dioxygenase; en 3R, 4R– dihydroxy – L-lysine (3) door cascade-reactie achtereenvolgens gekatalyseerd door KDO1 en KDO2 dioxygenases. Klik hier voor een grotere versie van dit cijfer.
Decarboxylering is een gemeenschappelijke reactie in metabolisme17. In het bijzonder, aminozuur DCs (EG 4.1.1) cofactor-vrij (pyruvoyl-afhankelijk) of PLP-afhankelijke enzymen en katalyseren de decarboxylering van aminozuren in de overeenkomstige polyaminen in bacteriën en hogere organismen18,19 , 20 , 21 , 22. het mono- en dihydroxy verbindingen (Figuur 3) 4–7, 10–11 correspondeert gehydroxyleerde cadaverine, de diamine verkregen door decarboxylering van L-lysine. Cadaverine is een belangrijke bouwsteen voor de chemische industrie, specifiek zijn een onderdeel van polyamide en polyurethaan polymeren. Daarom, bio-gebaseerde productie deze orthofenyleendiamine uit hernieuwbare bronnen heeft de aandacht getrokken als alternatief voor de aardolie gebaseerde route en verschillende micro-organismen hebben ontworpen voor dit doel. In deze stofwisselingsroutes is lysine DC (LDC) het belangrijkste enzym. LDC is een PLP-afhankelijke enzym die behoren tot de alanine racemase (AR) structurele familie23. De PLP-afhankelijke DCs (PLP-DCs) staan bekend als zeer substraat-specifieke. Echter, een paar enzymen eigen het vermogen van lichte promiscuïteit, het actief naar de aminozuren L-ornithine zowel L-lysine, als bijvoorbeeld de LDC van Selenomonas rumirantium (LDCSrum), die heeft soortgelijke kinetische constanten voor lysine en ornithine decarboxylering24,25. Dit uitgebreide substraat specificiteit maakt dit enzym een goede kandidaat voor de decarboxylering van mono – en di-hydroxy-L-lysine. Daarnaast vind je DCs actief naar de hydroxyl-afgeleiden van lysine, onderzochten we de genomic context van de genen coderend voor de αKAO enzymen. Inderdaad, in prokaryotische genomen de genen coderend voor enzymen die betrokken zijn bij de dezelfde biosynthetic traject zijn over het algemeen mede gelokaliseerd in gen clusters. Het gen KDO2 (vanaf Chitinophaga pinensis) werd gevonden samen met een codering van vermeende PLP-DC (Figuur 2) gen gelokaliseerd. Daarentegen is geen gene codering voor DC gebleken bij het analyseren van de genomic context van de KDO1 dioxygenase. Het eiwit PLP-DC van C. pinensis (DCCpin) werd daarom gekozen een veelbelovende kandidaat te katalyseren de decarboxylering stap van de cascade-reactie.
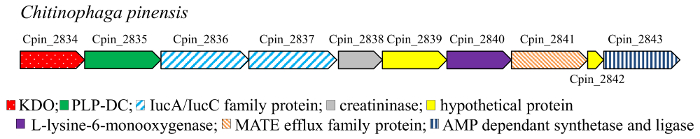
Figuur 2: Genomic context van KDO2 gen in C. pinensis. Klik hier voor een grotere versie van dit cijfer.
Dus ontworpen we trapsgewijs enzymatische reacties met dioxygenases en DCs te bereiken van de synthese van alifatische chirale β – en γ-amino alcoholen van aminozuren (Figuur 3). Zoals eerder gemeld introduceert de oxidatie van de C-H gekatalyseerd door de αKAO de hydroxy-gesubstitueerde stereogenic center met totale diastereoselectivity; de Cβ/γ chiraliteit zal worden bewaard in de decarboxylative stap, die alleen van invloed op de koolstof van de Cα van het aminozuur groep16.
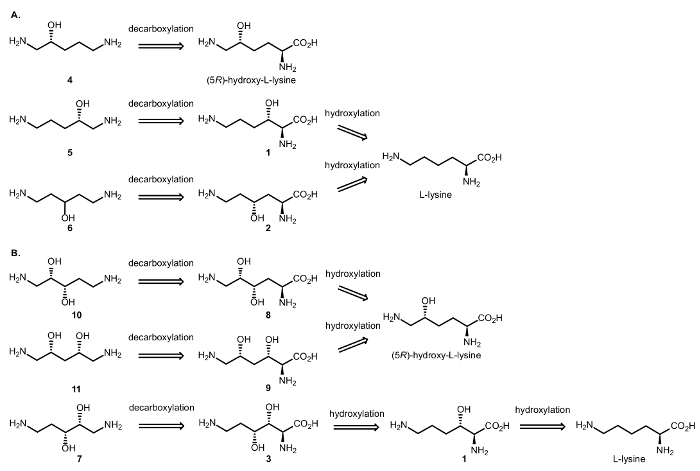
Figuur 3: analyse van Retrosynthetic. (A) Retrosynthese analyse van β – en γ-amino alcoholen (R) – 1,5 – diaminopentan-2-ol (4) (5R) – hydroxy – L-Lysine, en (S) – 1,5 – diaminopentan-2-ol (5) en 1,5-diaminopentan-3-ol (6) uit L-lysine. (B) Retrosynthese analyse van β, γ- en δ-amino diolen (2S, 3S), β – 1,5 – diaminopentane-2,3-diol (10) en (2R, 4S) – 1,5 – diaminopentane-2,4-diol (11) vanaf (5R)- Hydroxy-L-lysine, en 2R, 3R– 1,5 – diaminopentane-2,3-diol (7) vanaf L-lysine. Klik hier voor een grotere versie van dit cijfer.
Vanaf L-lysine en haar 5R-hydroxy derivaat, rapporteren we hierin een twee/drie stap één pot, enzymatische procedure combineren dioxygenases en PLP-DCs te verkrijgen het doel amino alcoholen. Voorafgaande de synthese duurzaame laboratorium van de moleculen van het doel, de methode is ontwikkeld op de analytische schaal aan te passen de voorwaarden van de reactie, bijvoorbeeld, de concentraties van het enzym, nodig om volledige conversie van de grondstoffen; presenteren wij deze procedure zo goed.
Protocol
Representative Results
Discussion
Chirale amino alcoholen en derivaten hebben een breed scala van toepassingen, gaande van chirale assistenten voor organische synthese op farmaceutische therapie. Meerstaps synthese voor de productie van amino alcoholen door conventionele organische synthese zijn talrijk, maar kan niet altijd efficiënt vanwege vervelende bescherming/deprotection stappen samen met een gevoelige controle van de stereochemie16. Een Biokatalytische aanpak die met de bescherming/deprotection stappen uitdeelt en is mees…
Disclosures
The authors have nothing to disclose.
Acknowledgements
De auteurs bedanken Véronique de Berardinis voor vruchtbare discussie en Alain Perret, Christine Pellé en Peggy Sirvain voor technische ondersteuning.
Materials
| HEPES | Sigma Aldrich | H3375 | |
| L-lysine hydrochloride | Sigma Aldrich | L5626 | |
| (5S)-hydroxy-L-lysine | Sigma Aldrich | GPS NONH | Out sourcing |
| α-ketoglutaric acid | Sigma Aldrich | 75892 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Ammonium Iron(II) sulfate hexahydrate | Acros | 201370250 | |
| Pyridoxal phosphate (PLP) | Sigma Aldrich | 82870 | |
| 3,4-dimercaptobutane-1,2-diol (DTT) | Sigma Aldrich | D0632 | |
| 1-fluoro-2,4-dinitrobenzene (DNFB) | Sigma Aldrich | D1529 | |
| Ethanol | VWR | 20825.290 | |
| Sodium hydrogen carbonate | Sigma Aldrich | 71631 | |
| HCl 37% | Sigma Aldrich | 435570 | |
| HCl 0.1M | Fluka | 35335 | |
| Acetonitrile HiPerSolv CHROMANORM for LC-MS | VWR | 83640.320 | |
| 2,2,2-trifluoroacetic acid | VWR | 153112E | |
| Ammonia 28% | VWR | 21182.294 | |
| Methanol HiPerSolv CHROMANORM for LC-MS | VWR | 83638.32 | |
| Formic acid | Acros | 270480010 | |
| Phosphoric acid 85% | Acros | 201145000 | |
| Deuterium oxide | Acros | 320,710,075 | |
| NaOH | Sigma Aldrich | S5881 | |
| C18 HPLC column | Phenomenex | 00F-4601-Y0 | |
| Accela UHPLC System | ThermoFisher Scientific | ||
| Accela PDA detector | ThermoFisher Scientific | ||
| 4mm syringe filters – 0,22µm – PVDF | Merck | SLGVR04NL | |
| Single-use tuberculin syringe with ml graduation, Luer tip | VWR | HSWA5010.200V0 | |
| Cation exchange resin 100-200 mesh | Sigma Aldrich | 217506 | |
| Mixed mode cation-exchange solid-phase extraction cartridge 6 mL | Waters | 186000776 | |
| Extraction manifold | Waters | WAT200609 | |
| Rotary evaporator | Büchi | 531-0103 | |
| Lyophilizer alpha 1-2 LDplus | Christ | L083302 | |
| Micropipette 20 µL | Eppendorf | 3121000031 | |
| Micropipette 100 µL | Eppendorf | 3121000074 | |
| Micropipette 500 µL | Eppendorf | 3121000112 | |
| Micropipette 1000 µL | Eppendorf | 3121000120 | |
| 300 MHz spectrometer | Bruker | ||
| 2 mL microtube | CLEARLine | CL20.002.0500 | |
| 50 mL conical-bottom centrifuge tube | Fischer Scientific | 05-539-8 | |
| 25 mL round-bottom flask 14/23 | Fischer Scientific | 10353331 | |
| 100 mL round-bottom flask 29/32 | Fischer Scientific | 11786183 | |
| 250 mL round-bottom flask 29/32 | Fischer Scientific | 11786183 | |
| 250 mL erlenmeyer flask | Fischerbrand | 15496143 |
References
- Nestl, B. M., Hammer, S. C., Nebel, B. A., Hauer, B. New Generation of Biocatalysts for Organic Synthesis. Ang. Chem. Int. Ed. 53 (12), 3070-3095 (2014).
- Reetz, M. T. Biocatalysis in Organic Chemistry and Biotechnology: Past, Present, and Future. J. Am. Chem. Soc. 135 (34), 12480-12496 (2013).
- Turner, N. J., O’Reilly, E. Biocatalytic retrosynthesis. Nat. Chem. Biol. 9 (5), 285-288 (2013).
- Oroz-Guinea, I., Garcia-Junceda, E. Enzyme catalysed tandem reactions. Curr. Opin. Chem. Biol. 17 (2), 236-249 (2013).
- Ricca, E., Brucher, B., Schrittwieser, J. H. Multi-Enzymatic Cascade Reactions: Overview and Perspectives. Adv. Syn. Catal. 353 (13), 2239-2262 (2011).
- Ager, D. J., Prakash, I., Schaad, D. R. 1,2-Amino Alcohols and Their Heterocyclic Derivatives as Chiral Auxiliaries in Asymmetric Synthesis. Chem. Rev. 96 (2), 835-876 (1996).
- Abiko, A., Masamune, S. An improved, convenient procedure for reduction of amino acids to aminoalcohols: Use of NaBH4-H2SO4. Tet. Lett. 33 (38), 5517-5518 (1992).
- McKennon, M. J., Meyers, A. I., Drauz, K., Schwarm, M. A convenient reduction of amino acids and their derivatives. J. Org. Chem. 58 (13), 3568-3571 (1993).
- Singh, P., Samanta, K., Das, S. K., Panda, G. Amino acid chirons: a tool for asymmetric synthesis of heterocycles. Org. Biomol. Chem. 12 (33), 6297-6339 (2014).
- Colomer, I., et al. Aminomethylhydroxylation of alkenes: Exploitation in the synthesis of scaffolds for small molecule libraries. Bioorg. Med. Chem. 23 (11), 2736-2740 (2015).
- Steinreiber, J., et al. Synthesis of Aromatic 1,2-Amino Alcohols Utilizing a Bienzymatic Dynamic Kinetic Asymmetric Transformation. Adv. Syn. Catal. 349 (8-9), 1379-1386 (2007).
- Steinreiber, J., et al. Overcoming Thermodynamic and Kinetic Limitations of Aldolase-Catalyzed Reactions by Applying Multienzymatic Dynamic Kinetic Asymmetric Transformations. Ang. Chem. Int. Ed. 46 (10), 1624-1626 (2007).
- Kohls, H., et al. Selective Access to All Four Diastereomers of a 1,3-Amino Alcohol by Combination of a Keto Reductase- and an Amine Transaminase-Catalysed Reaction. Adv. Syn. Catal. 357 (8), 1808-1814 (2015).
- Sehl, T., Maugeri, Z., Rother, D. Multi-step synthesis strategies towards 1,2-amino alcohols with special emphasis on phenylpropanolamines. J. Mol. Cat. B: Enzymatic. 114, 65-71 (2015).
- Martinez, S., Hausinger, R. P. Catalytic Mechanisms of Fe(II)- and 2-Oxoglutarate-dependent Oxygenases. J. Biol. Chem. 290 (34), 20702-20711 (2015).
- Baud, D., et al. Synthesis of Mono‐and Dihydroxylated Amino Acids with New α‐Ketoglutarate‐Dependent Dioxygenases: Biocatalytic Oxidation of C-H Bonds. ChemCatChem. , (2014).
- Suzuki, H., Kurihara, S., Kusano, T., Suzuki, H. Ch. 4. Polyamines. 4, 47-59 (2015).
- Kind, S., Wittmann, C. Bio-based production of the platform chemical 1,5-diaminopentane. Appl. Microbiol. Biotechnol. 91 (5), 1287-1296 (2011).
- Schneider, J., Wendisch, V. F. Biotechnological production of polyamines by bacteria: recent achievements and future perspectives. Appl. Microbiol. Biotechnol. 91 (1), 17-30 (2011).
- Qian, Z. -. G., Xia, X. -. X., Lee, S. Y. Metabolic engineering of Escherichia coli for the production of cadaverine: A five carbon diamine. Biotechnol. Bioeng. 108 (1), 93-103 (2011).
- Shin, J. H., Lee, S. Y. Metabolic engineering of microorganisms for the production of L-arginine and its derivatives. Microb. Cell. Fact. 13, (2014).
- Nguyen, A., Schneider, J., Reddy, G., Wendisch, V. Fermentative Production of the Diamine Putrescine: System Metabolic Engineering of Corynebacterium Glutamicum. Metabolites. 5 (2), 211 (2015).
- Kidron, H., Repo, S., Johnson, M. S., Salminen, T. A. Functional Classification of Amino Acid Decarboxylases from the Alanine Racemase Structural Family by Phylogenetic Studies. Mol. Biol. Evol. 24 (1), 79-89 (2007).
- Takatsuka, Y., Onoda, M., Sugiyama, T., Muramoto, K., Tomita, T., Kamio, Y. Novel Characteristics of Selenomonas ruminantium Lysine Decarboxylase Capable of Decarboxylating Both L-Lysine and L-Ornithine. Biosci. Biotechnol. Biochem. 63 (6), 1063-1069 (1999).
- Takatsuka, Y., Tomita, T., Kamio, Y. Identification of the Amino Acid Residues Conferring Substrate Specificity upon Selenomonas ruminantium Lysine Decarboxylase. Biosci. Biotechnol. Biochem. 63 (10), 1843-1846 (1999).
- Baud, D., et al. Biocatalytic Approaches towards the Synthesis of Chiral Amino Alcohols from Lysine: Cascade Reactions Combining alpha-Keto Acid Oxygenase Hydroxylation with Pyridoxal Phosphate- Dependent Decarboxylation. Adv. Syn. Catal. 359 (9), 1563-1569 (2017).
- Ilisz, I., Berkecz, R., Peter, A. Application of chiral derivatizing agents in the high-performance liquid chromatographic separation of amino acid enantiomers: a review. J. Pharm. Biomed. Anal. 47 (1), 1-15 (2008).
- . Organic Chemistry. Nuclear Magnetic Resonance (NMR) Spectroscopy Available from: https://www.jove.com/science-education/5680/nuclear-magnetic-resonance-nmr-spectroscopy (2017)
- Hibi, M., Ogawa, J. Characteristics and biotechnology applications of aliphatic amino acid hydroxylases belonging to the Fe(II)/alpha-ketoglutarate-dependent dioxygenase superfamily. Appl. Microbiol. Biotechnol. 98 (9), 3869-3876 (2014).
- Hüttel, W. Biocatalytic Production of Chemical Building Blocks in Technical Scale with α-Ketoglutarate-Dependent Dioxygenases. Chem. Ing. Tec. 85 (6), 809-817 (2013).
- Kourist, R., Guterl, J. -. K., Miyamoto, K., Sieber, V. Enzymatic Decarboxylation-An Emerging Reaction for Chemicals Production from Renewable Resources. ChemCatChem. 6 (3), 689-701 (2014).
- Lee, J., Michael, A. J., Martynowski, D., Goldsmith, E. J., Phillips, M. A. Phylogenetic diversity and the structural basis of substrate specificity in the beta/alpha-barrel fold basic amino acid decarboxylases. J. Biol. Chem. 282 (37), 27115-27125 (2007).
- Porter, J. L., Rusli, R. A., Ollis, D. L. Directed Evolution of Enzymes for Industrial Biocatalysis. ChemBiochem. 17 (3), 197-203 (2016).

