Enzymatisk Cascade reaktioner för syntesen av kirala Amino alkoholer från L-lysin
Summary
Kirala amino alkoholer är mångsidig molekyler för användning som ställningar i organisk syntes. Start från L-lysin, vi syntetisera amino alkoholer av en enzymatisk cascade reaktion att kombinera diastereoselective C-H oxidation katalyseras av dioxygenas följt av klyvning av den karboxylsyra biexponentiellt av motsvarande hydroxyl aminosyran av en dekarboxylas.
Abstract
Amino alkoholer är mångsidig föreningar med ett brett spektrum av applikationer. Exempelvis har de använts som kiral ställningar i organisk syntes. Sin syntes av konventionella organisk kemi kräver ofta tråkiga flerstegs syntes processer, med svårt kontroll av stereokemiska utfallet. Vi presenterar ett protokoll till enzymatiskt syntetisera amino alkoholer start från den lättillgängliga L-lysin i 48 h. Detta protokoll kombinerar två kemiska reaktioner som är mycket svåra att genomföra av konventionella organisk syntes. I första steget, regio- och diastereoselective oxidation av en oaktiverade C-H bond lysin katalyseras sidokedjan av en dioxygenas; en andra regio- och diastereoselective oxidation katalyseras av en regiodivergent-dioxygenas kan leda till bildandet av de 1,2-dioler. I det sista steget, är karboxylsyror gruppen av alfa aminosyran klyvs av en pyridoxal-fosfat (PLP) dekarboxylas (DC). Detta decarboxylative steg påverkar bara alfa kolet av aminosyran, behålla hydroxi-substituerade stereogenic centrum i beta, gamma ställning. De resulterande amino alkoholerna är därför optiskt berikad. Protokollet tillämpades till semipreparative-skala syntesen av fyra amino alkoholer. Övervakning av reaktionerna genomfördes av högtrycksvätskekromatografi (HPLC) efter derivatisering av 1-fluoro-2,4-dinitrobensen. Okomplicerad rening genom fasta fasen extraktion (SPE) ges de amino alkoholerna med utmärkt avkastning (93% till > 95%).
Introduction
Trots de fördelar som erbjuds av biocatalysis, fortfarande integrationen av biokatalytiska stegen i syntetiska vägar eller totala biokatalytiska vägar mestadels begränsade enzymatisk kinetiska resolutioner. Dessa linjer har använts som ett första steg i asymmetrisk chemo-enzymatisk syntes, men biocatalysis erbjuder många fler möjligheter i funktionell grupp omvandlingar med hög stereoselectivity1,2,3 . Dessutom som biokatalytiska reaktioner genomförs under liknande förhållanden, är det därför möjligt att utföra cascade reaktioner i en one-pot mode4,5.
Kirala amino alkoholer är mångsidig molekyler för användning som assistenter eller ställningar i organisk syntes6. Den amino alkohol biexponentiellt hittas ofta i sekundära metaboliter och aktiva farmaceutiska substanser (API). Primära β-amino alkoholer är lätt tillgängliga från de motsvarande α-amino syrorna av konventionell kemisk syntes, men tillgång till kirala γ-amino alkoholer eller sekundära amino alkoholer kräver ofta tråkiga syntetiska vägar tillsammans med känsliga kontroll av stereokemi7,8,9,10. På grund av dess höga stereoselectivity föreskriva biocatalysis en överlägsen syntetiska rutt till dessa kirala byggstenar11,12,13,14.
Vi har tidigare rapporterat syntesen av mono – och di-hydroxy-L-lysines genom diastereoselective enzymatisk hydroxylering katalyseras av dioxygenases av järn (II) / α-ketoacid-beroende cyklooxygenas familj (αKAO) (figur 1)15. I synnerhet start från L-lysin, den KDO1-dioxygenas katalyserar bildandet av (3S) – hydroxi derivat (1), medan de (4R) – derivat (2) som bildas genom reaktion med KDO2 dioxygenas. Successiva regiodivergent hydroxylations av KDO1 och KDO2 leda till bildandet av (3R, 4R) – dihydroxi – L-lysin (3) i optiskt ren form. Dock hindrar intervallet begränsad substrat för dessa enzymer sin stora användning inom kemisk syntes, särskilt i hydroxylering av enkla aminer, eftersom en karboxylsyra biexponentiellt i α-placera av den amino gruppen är grundläggande för aktivitet16.
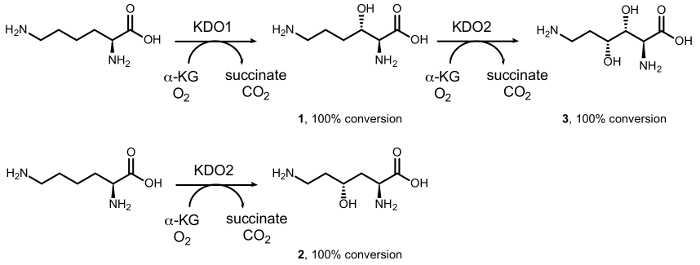
Figur 1: biokatalytiska konverteringar av L-lysin. Omvandling till (S3) – hydroxy – L-lysin (1) katalyseras av KDO1 dioxygenas; (4R) – hydroxy – L-lysin (2) katalyseras av KDO2 dioxygenas; och (3R, 4R) – dihydroxi – L-lysin (3) av cascade reaktion katalyseras successivt av KDO1 och KDO2 dioxygenases. Klicka här för att se en större version av denna siffra.
Decarboxylation är en vanlig reaktion i metabolism17. I synnerhet aminosyra DCs (EG 4.1.1) är fritt från kofaktor (pyruvoyl-beroende) eller PLP-beroende enzymer, och katalyserar omvandlingen av aminosyror till de motsvarande polyaminer i bakterier och högre organismer18,19 , 20 , 21 , 22. den mono – dihydroxi föreningar (figur 3) 4–7, 10–11 motsvarar hydroxylerade cadaverine, den diamine erhålls genom decarboxylation av L-lysin. Cadaverine är en viktig byggsten för den kemiska industrin, särskilt det är en komponent av polyamid och polyuretan polymerer. Därför biobaserade produktionen av denna diamine från förnybara resurser har uppmärksammats som ett alternativ till oljebaserade rutten och olika mikroorganismer har konstruerats för detta ändamål. I dessa metaboliska vägar är lysin DC (LDC) det nyckel-enzymet. LDC är en PLP-beroende enzymet tillhör den alanin racemas (AR) strukturella familjära23. PLP-beroende DCs (PLP-DCs) är kända för att vara mycket substrat-specifika. Dock några enzymer äger förmåga att lätt promiskuitet, att vara aktiv mot både L-ornitin och L-lysin aminosyror, som exempelvis LDC från Selenomonas rumirantium (LDCSrum), som har liknande kinetiska konstanter för lysin och ornitin decarboxylation24,25. Detta utökade substrat specificitet gör detta enzym en bra kandidat för decarboxylation av mono – och di-hydroxy-L-lysin. Dessutom, för att hitta DCs aktiva mot hydroxyl derivat av lysin, granskat vi genomisk samband med de gener som kodar αKAO enzymer. Faktiskt i prokaryota genom är de gener som kodar enzymer involverade i samma biosyntetisk väg generellt Co lokaliserade i gen kluster. KDO2 (från Chitinophaga pinensis) genen hittades Co lokaliserade med en gen som kodar för förmodad PLP-DC (figur 2). Däremot har ingen gen kodning för DC hittats vid analys av genomisk ramen för den KDO1-dioxygenas. PLP-DC proteinet från C. pinensis (DCCpin) valdes därför som en lovande kandidat att katalysera steget decarboxylation av cascade reaktionen.
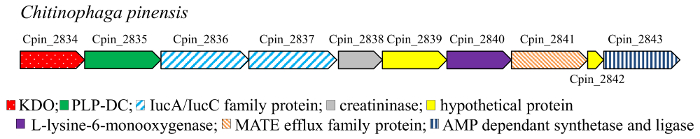
Figur 2: genomisk sammanhang av KDO2 gen i C. pinensis. Klicka här för att se en större version av denna siffra.
Därför har vi utformat enzymatisk cascade reaktioner som involverar dioxygenases och DCs att uppnå syntesen av alifatiska kirala β – och γ-amino alkoholer från aminosyror (figur 3). Som tidigare rapporterats introducerar C-H oxidation katalyseras av αKAO hydroxi-substituerade stereogenic centrum med total diastereoselectivity; den Cβ/γ kiralitet bevaras i decarboxylative steg, som bara påverkar Cα kolet av aminosyra biexponentiellt16.
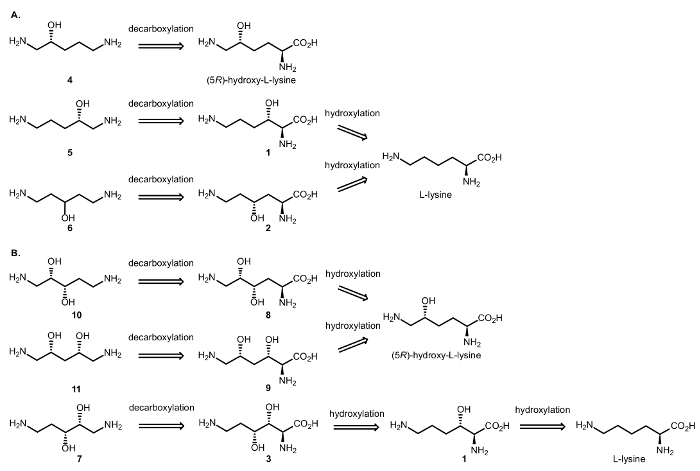
Figur 3: retrosyntetisk analys. (A) retrosyntes av β – och γ-amino alkoholer (R) – 1,5 – diaminopentan-2-ol (4) från (5R) – hydroxy – L-lysin, och (S) – 1,5 – diaminopentan-2-ol (5) och 1,5-diaminopentan-3-ol (6) från L-lysin. (B) retrosyntes av β, γ- och β, δ-amino dioler (2S, 3S) – 1,5 – diaminopentane-2,3-diol (10) och (R, 4S2) – 1,5 – diaminopentane-2,4-diol (11) start från (5R)- hydroxy-L-lysin, och (2R, 3R) – 1,5 – diaminopentane-2,3-diol (7) start från L-lysin. Klicka här för att se en större version av denna siffra.
Start från L-lysin och dess (5R)-hydroxi derivat, rapporterar vi häri en två/tre steg, en kruka, enzymatisk förfarande att kombinera dioxygenases och PLP-DCs att få målet amino alkoholer. Tidigare syntes på laboratorieskala av målet molekylerna, metoden utvecklades vid den analytiska skalan att justera de reaktion villkor, t.ex., enzym halterna, krävs för att tillåta full konvertering av utgångsmaterial; Vi presenterar detta förfarande också.
Protocol
Representative Results
Discussion
Kirala amino alkoholer och derivat har ett brett utbud av applikationer, från kirala extraanställda för organisk syntes till farmaceutisk behandling. Flerstegssyntes för att producera amino alkoholer av konventionella organisk syntes är många, men kanske inte alltid är effektiv på grund av tråkiga skydd/deprotection steg tillsammans med en känslig kontroll av stereokemi16. En biokatalytiska tillvägagångssätt som doserar med skydd/deprotection steg och är oftast mycket stereoselektiv …
Disclosures
The authors have nothing to disclose.
Acknowledgements
Författarna vill tacka Véronique de Berardinis för fruktbar diskussion och Alain Perret, Christine Pellé och Peggy Sirvain för teknisk support.
Materials
| HEPES | Sigma Aldrich | H3375 | |
| L-lysine hydrochloride | Sigma Aldrich | L5626 | |
| (5S)-hydroxy-L-lysine | Sigma Aldrich | GPS NONH | Out sourcing |
| α-ketoglutaric acid | Sigma Aldrich | 75892 | |
| Sodium ascorbate | Sigma Aldrich | A7631 | |
| Ammonium Iron(II) sulfate hexahydrate | Acros | 201370250 | |
| Pyridoxal phosphate (PLP) | Sigma Aldrich | 82870 | |
| 3,4-dimercaptobutane-1,2-diol (DTT) | Sigma Aldrich | D0632 | |
| 1-fluoro-2,4-dinitrobenzene (DNFB) | Sigma Aldrich | D1529 | |
| Ethanol | VWR | 20825.290 | |
| Sodium hydrogen carbonate | Sigma Aldrich | 71631 | |
| HCl 37% | Sigma Aldrich | 435570 | |
| HCl 0.1M | Fluka | 35335 | |
| Acetonitrile HiPerSolv CHROMANORM for LC-MS | VWR | 83640.320 | |
| 2,2,2-trifluoroacetic acid | VWR | 153112E | |
| Ammonia 28% | VWR | 21182.294 | |
| Methanol HiPerSolv CHROMANORM for LC-MS | VWR | 83638.32 | |
| Formic acid | Acros | 270480010 | |
| Phosphoric acid 85% | Acros | 201145000 | |
| Deuterium oxide | Acros | 320,710,075 | |
| NaOH | Sigma Aldrich | S5881 | |
| C18 HPLC column | Phenomenex | 00F-4601-Y0 | |
| Accela UHPLC System | ThermoFisher Scientific | ||
| Accela PDA detector | ThermoFisher Scientific | ||
| 4mm syringe filters – 0,22µm – PVDF | Merck | SLGVR04NL | |
| Single-use tuberculin syringe with ml graduation, Luer tip | VWR | HSWA5010.200V0 | |
| Cation exchange resin 100-200 mesh | Sigma Aldrich | 217506 | |
| Mixed mode cation-exchange solid-phase extraction cartridge 6 mL | Waters | 186000776 | |
| Extraction manifold | Waters | WAT200609 | |
| Rotary evaporator | Büchi | 531-0103 | |
| Lyophilizer alpha 1-2 LDplus | Christ | L083302 | |
| Micropipette 20 µL | Eppendorf | 3121000031 | |
| Micropipette 100 µL | Eppendorf | 3121000074 | |
| Micropipette 500 µL | Eppendorf | 3121000112 | |
| Micropipette 1000 µL | Eppendorf | 3121000120 | |
| 300 MHz spectrometer | Bruker | ||
| 2 mL microtube | CLEARLine | CL20.002.0500 | |
| 50 mL conical-bottom centrifuge tube | Fischer Scientific | 05-539-8 | |
| 25 mL round-bottom flask 14/23 | Fischer Scientific | 10353331 | |
| 100 mL round-bottom flask 29/32 | Fischer Scientific | 11786183 | |
| 250 mL round-bottom flask 29/32 | Fischer Scientific | 11786183 | |
| 250 mL erlenmeyer flask | Fischerbrand | 15496143 |
References
- Nestl, B. M., Hammer, S. C., Nebel, B. A., Hauer, B. New Generation of Biocatalysts for Organic Synthesis. Ang. Chem. Int. Ed. 53 (12), 3070-3095 (2014).
- Reetz, M. T. Biocatalysis in Organic Chemistry and Biotechnology: Past, Present, and Future. J. Am. Chem. Soc. 135 (34), 12480-12496 (2013).
- Turner, N. J., O’Reilly, E. Biocatalytic retrosynthesis. Nat. Chem. Biol. 9 (5), 285-288 (2013).
- Oroz-Guinea, I., Garcia-Junceda, E. Enzyme catalysed tandem reactions. Curr. Opin. Chem. Biol. 17 (2), 236-249 (2013).
- Ricca, E., Brucher, B., Schrittwieser, J. H. Multi-Enzymatic Cascade Reactions: Overview and Perspectives. Adv. Syn. Catal. 353 (13), 2239-2262 (2011).
- Ager, D. J., Prakash, I., Schaad, D. R. 1,2-Amino Alcohols and Their Heterocyclic Derivatives as Chiral Auxiliaries in Asymmetric Synthesis. Chem. Rev. 96 (2), 835-876 (1996).
- Abiko, A., Masamune, S. An improved, convenient procedure for reduction of amino acids to aminoalcohols: Use of NaBH4-H2SO4. Tet. Lett. 33 (38), 5517-5518 (1992).
- McKennon, M. J., Meyers, A. I., Drauz, K., Schwarm, M. A convenient reduction of amino acids and their derivatives. J. Org. Chem. 58 (13), 3568-3571 (1993).
- Singh, P., Samanta, K., Das, S. K., Panda, G. Amino acid chirons: a tool for asymmetric synthesis of heterocycles. Org. Biomol. Chem. 12 (33), 6297-6339 (2014).
- Colomer, I., et al. Aminomethylhydroxylation of alkenes: Exploitation in the synthesis of scaffolds for small molecule libraries. Bioorg. Med. Chem. 23 (11), 2736-2740 (2015).
- Steinreiber, J., et al. Synthesis of Aromatic 1,2-Amino Alcohols Utilizing a Bienzymatic Dynamic Kinetic Asymmetric Transformation. Adv. Syn. Catal. 349 (8-9), 1379-1386 (2007).
- Steinreiber, J., et al. Overcoming Thermodynamic and Kinetic Limitations of Aldolase-Catalyzed Reactions by Applying Multienzymatic Dynamic Kinetic Asymmetric Transformations. Ang. Chem. Int. Ed. 46 (10), 1624-1626 (2007).
- Kohls, H., et al. Selective Access to All Four Diastereomers of a 1,3-Amino Alcohol by Combination of a Keto Reductase- and an Amine Transaminase-Catalysed Reaction. Adv. Syn. Catal. 357 (8), 1808-1814 (2015).
- Sehl, T., Maugeri, Z., Rother, D. Multi-step synthesis strategies towards 1,2-amino alcohols with special emphasis on phenylpropanolamines. J. Mol. Cat. B: Enzymatic. 114, 65-71 (2015).
- Martinez, S., Hausinger, R. P. Catalytic Mechanisms of Fe(II)- and 2-Oxoglutarate-dependent Oxygenases. J. Biol. Chem. 290 (34), 20702-20711 (2015).
- Baud, D., et al. Synthesis of Mono‐and Dihydroxylated Amino Acids with New α‐Ketoglutarate‐Dependent Dioxygenases: Biocatalytic Oxidation of C-H Bonds. ChemCatChem. , (2014).
- Suzuki, H., Kurihara, S., Kusano, T., Suzuki, H. Ch. 4. Polyamines. 4, 47-59 (2015).
- Kind, S., Wittmann, C. Bio-based production of the platform chemical 1,5-diaminopentane. Appl. Microbiol. Biotechnol. 91 (5), 1287-1296 (2011).
- Schneider, J., Wendisch, V. F. Biotechnological production of polyamines by bacteria: recent achievements and future perspectives. Appl. Microbiol. Biotechnol. 91 (1), 17-30 (2011).
- Qian, Z. -. G., Xia, X. -. X., Lee, S. Y. Metabolic engineering of Escherichia coli for the production of cadaverine: A five carbon diamine. Biotechnol. Bioeng. 108 (1), 93-103 (2011).
- Shin, J. H., Lee, S. Y. Metabolic engineering of microorganisms for the production of L-arginine and its derivatives. Microb. Cell. Fact. 13, (2014).
- Nguyen, A., Schneider, J., Reddy, G., Wendisch, V. Fermentative Production of the Diamine Putrescine: System Metabolic Engineering of Corynebacterium Glutamicum. Metabolites. 5 (2), 211 (2015).
- Kidron, H., Repo, S., Johnson, M. S., Salminen, T. A. Functional Classification of Amino Acid Decarboxylases from the Alanine Racemase Structural Family by Phylogenetic Studies. Mol. Biol. Evol. 24 (1), 79-89 (2007).
- Takatsuka, Y., Onoda, M., Sugiyama, T., Muramoto, K., Tomita, T., Kamio, Y. Novel Characteristics of Selenomonas ruminantium Lysine Decarboxylase Capable of Decarboxylating Both L-Lysine and L-Ornithine. Biosci. Biotechnol. Biochem. 63 (6), 1063-1069 (1999).
- Takatsuka, Y., Tomita, T., Kamio, Y. Identification of the Amino Acid Residues Conferring Substrate Specificity upon Selenomonas ruminantium Lysine Decarboxylase. Biosci. Biotechnol. Biochem. 63 (10), 1843-1846 (1999).
- Baud, D., et al. Biocatalytic Approaches towards the Synthesis of Chiral Amino Alcohols from Lysine: Cascade Reactions Combining alpha-Keto Acid Oxygenase Hydroxylation with Pyridoxal Phosphate- Dependent Decarboxylation. Adv. Syn. Catal. 359 (9), 1563-1569 (2017).
- Ilisz, I., Berkecz, R., Peter, A. Application of chiral derivatizing agents in the high-performance liquid chromatographic separation of amino acid enantiomers: a review. J. Pharm. Biomed. Anal. 47 (1), 1-15 (2008).
- . Organic Chemistry. Nuclear Magnetic Resonance (NMR) Spectroscopy Available from: https://www.jove.com/science-education/5680/nuclear-magnetic-resonance-nmr-spectroscopy (2017)
- Hibi, M., Ogawa, J. Characteristics and biotechnology applications of aliphatic amino acid hydroxylases belonging to the Fe(II)/alpha-ketoglutarate-dependent dioxygenase superfamily. Appl. Microbiol. Biotechnol. 98 (9), 3869-3876 (2014).
- Hüttel, W. Biocatalytic Production of Chemical Building Blocks in Technical Scale with α-Ketoglutarate-Dependent Dioxygenases. Chem. Ing. Tec. 85 (6), 809-817 (2013).
- Kourist, R., Guterl, J. -. K., Miyamoto, K., Sieber, V. Enzymatic Decarboxylation-An Emerging Reaction for Chemicals Production from Renewable Resources. ChemCatChem. 6 (3), 689-701 (2014).
- Lee, J., Michael, A. J., Martynowski, D., Goldsmith, E. J., Phillips, M. A. Phylogenetic diversity and the structural basis of substrate specificity in the beta/alpha-barrel fold basic amino acid decarboxylases. J. Biol. Chem. 282 (37), 27115-27125 (2007).
- Porter, J. L., Rusli, R. A., Ollis, D. L. Directed Evolution of Enzymes for Industrial Biocatalysis. ChemBiochem. 17 (3), 197-203 (2016).

