Gestandaardiseerde meting van nasale membraan Transepithelial potentieel verschil (NPD)
Summary
Hier presenteren we een gestandaardiseerd protocol voor het meten van de nasale potentiaalverschil (NPD). Cystic fibrosis transmembrane huidgeleiding regelgever (CFTR) en epitheliale natrium kanaal (ENaC) functie worden geëvalueerd door de verandering in de spanning over de nasale epitheel na superfusion van oplossingen die ion kanaal activiteit, wijzigen mits een resultaat maatregel.
Abstract
We beschrijven een gestandaardiseerde meting van nasale potentiaalverschil (NPD). Bij deze techniek, worden cystic fibrosis transmembrane huidgeleiding regelgever (CFTR) en de epitheliale natrium kanaal (ENaC) functie gecontroleerd door de verandering in spanning over de nasale epitheel na de superfusion van oplossingen die ionkanaal wijzigen activiteit. Deze optie is ingeschakeld door de meting van het potentiaalverschil tussen de subcutane compartiment en het epitheel van de luchtwegen in het neusgat, met behulp van een katheter in contact met de inferieure nasale turbinate.
De test kan de meting van de spanning stabiel basislijn en de opeenvolgende netto spanning veranderingen na perfusie van 100 µM amiloride, een inhibitor van de omwenteling van nb+ reabsorptie in Ringer’s oplossing; een chloride-vrije oplossing met amiloride naar station chloride secretie en 10 µM isoproterenol in een oplossing chloride-gratis met amiloride de cyclisch adenosinemonofosfaat (cAMP) stimuleren-afhankelijke chloride huidgeleiding aan CFTR gerelateerde.
Deze techniek heeft het voordeel van demonstreren van de elektrofysiologische eigenschappen van twee belangrijke componenten tot oprichting van de hydratatie van de luchtweg oppervlakte vloeistof van het respiratoire epitheel, ENaC en CFTR. Daarom is het een nuttig onderzoekhulpmiddel voor fase 2 en een bewijs van concept proeven van agenten die gericht zijn op CFTR en ENaC activiteit voor de behandeling van cystic fibrosis (CF) longziekte. Het is ook een belangrijke follow-up procedure om CFTR dysfunctie als genetische testen en zweet dubbelzinnig zijn. In tegenstelling tot zweet chloride is de test relatief meer tijdrovend en duur. Het vereist ook operator opleiding en deskundigheid om de test effectief. De variabiliteit van de inter – en intra – subject is gemeld in deze techniek vooral in jong of niet-coöperatieve onderwerpen. Om te helpen met deze bezorgdheid, is interpretatie door een onlangs gevalideerde algoritme verbeterd.
Introduction
Het algemene doel van deze methode is voor het meten van de nasale potentiaalverschil (NPD) dat tot doel heeft te onderzoeken trans-epitheliale ion vervoer in vivo1. Deze techniek maakt het mogelijk de meting van natrium (Na+) en chloor (Cl–) vervoer. NPD is gebruikt als een hulpmiddel van het onderzoek sinds de late jaren 1980 en werd in 1998 als een diagnostische procedure aanvaard door de Cystic Fibrosis Stichting (CFF) consensus verklaring2 en in 2017 in de Consensus van de diagnostische richtlijnen van Cystic Fibrosis Stichting (CFF) 3. inderdaad, biologische CFTR disfunctie, die de oorzaak van CF, wordt bewezen door een verhoogde absorptie van de nb+ in de apicale membraan en een defect in Cl– -secretie. Deze functionele test biedt het voordeel van een aanvullende diagnose tool als genetica niet doorslaggevend zijn bij patiënten met onbepaalde tussenliggende zweet test resultaten3. Hoewel deze informatie kan ook worden verkregen door intestinale huidige meting biopten (ICM) ICM is echter alleen beschikbaar in enkele centra wereldwijd en moet verdere standaardisatie. NPD meer beschikbaar is in ongeveer 60 globale centra en, bovendien, richt zich op het respiratoire epitheel thats de hoofdlocatie van de ziekte.
Gezien de informatie die het bevat over CFTR-activiteit, wordt het ook gebruikt in proof-of-concept studies ter beoordeling van de functionele herstel van CFTR-eiwit door modulator therapieën4,5,6,7, 8. Inderdaad, gegevens van studies met CFTR mRNA/gen bewerken, CFTR-potentiator en corrector therapieën, Markeer ingrijpende veranderingen in de Cl– en Na+ vervoer met therapie6,9 en bevestigt dat de NPD kunnen een responsieve eindpunt in klinische proeven. Als we geen gevoelige klinische eindpunten kundig voor speurder een subtiele verandering in klinische toestand van de patiënt op korte termijn, is er mogelijk deze preklinische biomerker zeer informatief. Het gebied van CFTR modulator therapieën verruimt snel en dringend proeven in vivo die kunnen snel ontcijferen actieve verbindingen voordat u naar grote fase 3 proeven10.
De fysiologische logica van de techniek is gebaseerd op de meting van het potentiaalverschil tussen het epitheel van de luchtwegen in het neusgat en het onderhuids compartiment. Ion kanaal activiteiten worden onderzocht door het meten van het potentiaalverschil stabiele maximale basislijn (PD), zijn gewijzigd nadat u het blokkeren van de ENaC gerelateerde nb+ absorptie en rijden Cl– -secretie via verschillende apicale Cl– transporteurs inclusief CFTR. CFTR-dysfunctie wordt weergegeven door een minimale verandering in potentiaalverschil bij stimulatie van de secretie van Cl– via een kamp-afhankelijke weg en een verhoogde ENaC gemedieerde nb+ absorptie zoals gedetecteerd door een negatiever basislijn potentiaalverschil en een verbeterde respons op amiloride. De mechanistische basis voor CF versus normale PD is samengevat in Figuur 1.
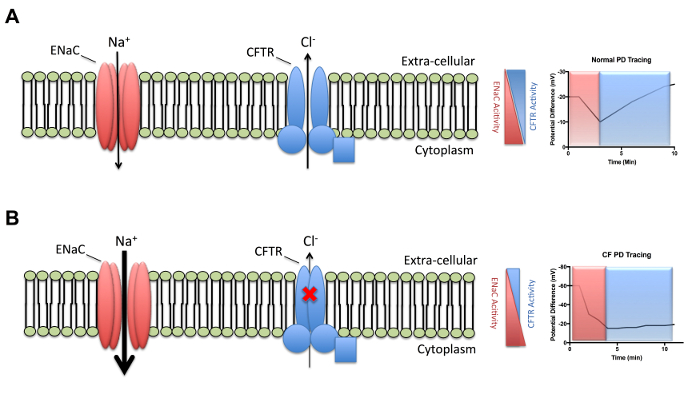
Figuur 1: samenvatting figuur van ionkanaal activiteit. (A) Ion activiteit in het respiratoire epitheel demonstreren evenwichtige activiteit van ENaC en CFTR in normale onderwerpen en (B) verlies van CFTR activiteit, wat resulteert in ENaC gemedieerde natrium vervoer verhoogd en verlaagd CFTR afhankelijke chloride vervoer. ENaC: epitheliale natrium kanaal, nb+: natrium, CFTR: cystic fibrosis transmembrane regulator, CL–: chloride, mV: millivolts, PD: potentiaalverschil, min: minuut/s Klik hier voor een grotere versie van dit cijfer.
Deze test toont echter aan dat een zekere mate van variabiliteit zowel bij herhaalde metingen binnen de dezelfde patiënt en bij patiënten met de dezelfde genotype. Dit is van het grootste belang om de interpretatie van de wijzigingen na de modulator behandeling. Bovendien, we nog steeds geen gevalideerde drempels discrimineren tussen CF en gezonde proefpersonen. Dit kan gedeeltelijk worden veroorzaakt door verschillen tussen de beschikbaarheid van klinische faciliteiten en de gebruikte technieken. Daarom loopt een aanzienlijke internationale inspanningen gericht op standaardisering van de test. Zowel de ons CFF-TDN (Cystic Fibrosis Stichting-Therapeutics Development Network) en de ECFS-CTN (European Cystic Fibrosis samenleving-klinische proeven Network) gemaakt een NPD Standard Operating Procedure (SOP) voor het gebruik in de multicentrische en onderzoek proeven. Deze recente collaboratieve werk door de CTN en TDN heeft geresulteerd in een gezamenlijke, internationale SOP, het samenbrengen van de deskundigheid van de CTN en TDN (2014)11. Deze paper presenteert de technieken van het protocol en test NPD gebruiken voor diagnose CF of onderzoeker-geïnitieerd proof-of-concept proeven. Elke triade uitvoering van de techniek is verantwoordelijk voor de toepassing op haar institutionele menselijke ethiek onderzoekscommissie voor goedkeuring.
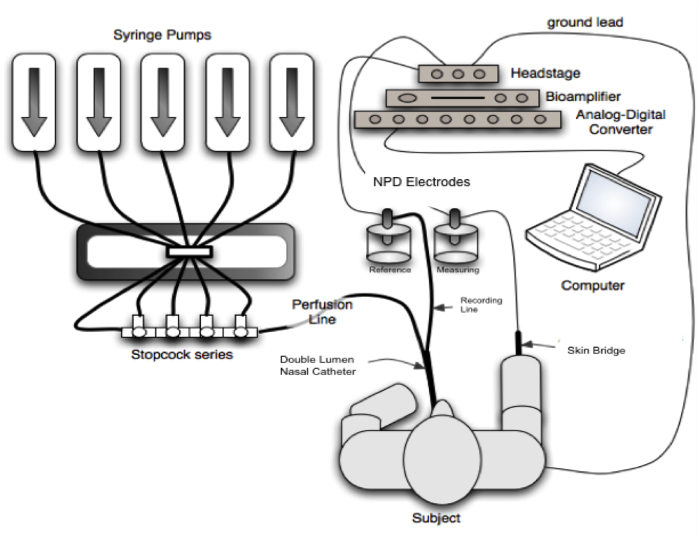
Figuur 2: schematische voorstelling van de volledige aanbevolen NPD setup. Merk op dat de aanbevolen setup wordt weergegeven, met inbegrip van sequentiële perfusie pompen, en de serie 4-stop-haan setup. Specifieke verbindingen en voorbeelden van onderdelen worden weergegeven in het SOP. (Diagram bewerkt met toestemming van Solomon, G.M. borst, 201013) Klik hier voor een grotere versie van dit cijfer.
De experimentele doorstroming is geschetst in Figuur 2, waarbij de NPD wordt gemeten tussen de verkennen brug geplaatst op de epitheel oppervlak en verwijzing brug geplaatst in de subcutane ruimte, beide verbonden aan de elektroden en een hoog-impedantie voltmeter.
Dit wordt gewaarborgd door 2 verschillende systemen: er zijn 2 aanvaardbaar referentie elektrode opstellingen: (i) Ag/AgCl elektrodes evenwichtig en een elektrocardiogram (ECG) room gevulde brug verbonden met de subcutane ruimte door lichte slijtage of (ii) verzadigd kalomel half-Cells en een agar gevuld 22 – tot 24-gauge naald subcutaan geïntroduceerd. De contactpersoon naar de nasale mucosa is ingeschakeld door een dubbele lumen-katheter. Een lumen is gevuld met agar of ECG crème en verbonden met de meetapparatuur elektrode, anderzijds laat perfusie op de nasale mucosa van de verschillende oplossingen.
Het uiteinde van de buis verkennen is op de respiratoire mucosa onder de inferieure nasale turbinate (Figuur 3) geplaatst.
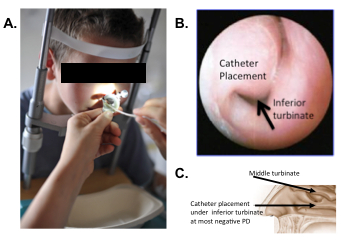
Figuur 3: plaatsing van het verkennen van de buis op de respiratoire mucosa. (A) externe weergave weergegeven: plaatsing. (B) Rhinoscopic weergave tonen van plaatsing. (C) Diagram aangeeft van de anatomische locatie voor plaatsing van de katheter. PD: potentiaalverschil
De reactie van PD op verschillende medicijnen studeren, worden de superfusion oplossingen toegepast via de tweede lumen van de katheter. Er zijn verschillende belangrijke stappen met betrekking tot de voorbereiding en het verloop van de NPD metingen, die hieronder zijn beschreven in het protocol, van de eerste voorbereiding door tot data-analyse.
Na een voorbereiding van oplossingen en elektroden voorziet voldoende kwaliteit testen van de elektroden en katheters het fundamentele gedrag van de test. Basale metingen zijn langs het inferieur turbinate, die het mogelijk maakt de selectie van de beste plaats voor meting, meestal die met de meest negatieve meting. Vervolgens bepalen de sequentiële perfusions nb+ (ENaC) en Cl– (CFTR-afhankelijk) ion flux via een wijziging in de spanning over de nasale epitheel.
Protocol
Representative Results
Discussion
In vivo, NPD biedt een unieke meting die herhaaldelijk kan worden uitgevoerd op basis van longitudinale en toont aan dat met herhaalde metingen, vergelijkbare longitudinale resultaten zijn waargenomen op een group-wise en individuele basis14, 15. Er zijn sterke aanwijzingen dat NPD uitstekende discriminatie geldigheid heeft voor CF onderscheiden van niet-CF. 25 studies aangetoond consequent een statistisch significant verschil in Cl– en Na+ huidgeleiding tussen patiënten met CF en gezonde controles10. Terwijl verschillende eerder ontwikkelde indicatoren deze capaciteit tonen, verwachten we dat nieuwe updates nodig gezien de recente standardizations van methodologie7,8 zijn.
Wijzigingen en probleemoplossing
Deze test vereist verschillende belangrijke stappen voor het verzekeren van nauwkeurige metingen. Het gaat hierbij om de elektroden en katheters kringloop offset om ervoor te zorgen dat het systeem aanbevolen normen functioneert. Patiënten moeten nog blijven en zich onthouden van praten zoals dit artefacten en dislodgement van de katheter minimaliseert. Dit bemoeilijkt de test in niet-coöperatieve patiënten en de techniek is alleen gemeld in een studie bij kinderen onder de 6 jaar leeftijd7.
Pre inspectie van de nasale epitheel is nodig om ervoor te zorgen dat er geen korsten of slijm op de epitheel, die kan invloed hebben op metingen zijn.
Zeer belangrijk is, moet worden opgemerkt dat de locatie van de plaatsing van de katheter het onderwerp van debat is. De hier gepresenteerde SOP maakt gebruik van meting onder de turbinate inferior (IT). De plaatsing van de katheter onder de IT is gestandaardiseerd en uitgevoerd in multicenter proeven en, dus, dit is de aanbevolen techniek. Meting onder de IT helpt u met de katheter kant-gat, die moeilijk te handhaven stevig contact met de nasale mucosa, wellicht terwijl u in contact met de oplossingen. Andere groepen kunnen meten de PD op de nasale verdieping, die technisch makkelijker is. Bovenal Vermeulen (2011) toonde aan dat de 2 methoden vergelijkbare16.
De opwarming van de aarde van de oplossingen blijft een kwestie van debat tussen Europese en Amerikaanse-centers17,18. Het heeft gepleit dat het gebruik van oplossingen bij 37 ° C in plaats van 22 ° C de waargenomen totale chloride reactie verhoogt door ongeveer 25% en de reactie van de isoproterenol-afhankelijke chloride bij ongeveer 95%18. Echter, opwarming van de aarde verhoogt variabiliteit, zoals beoordeeld door een grotere standaarddeviatie van de totale chloride reactie17. Daarom, zoals de opwarming van de oplossingen is een bijkomende factor van variabiliteit, het wordt geadviseerd niet te warm de oplossingen tenzij vereist op basis van de studie.
We hebben eerder ten opzichte van zowel van de elektrode technieken en vond dat de zowel de kalomel de AgCl-elektrode systemen ook basale en gestimuleerd stromingen in normale onderwerpen13geëxploiteerd.
Beperkingen van de techniek
Deze test is onderworpen aan aanzienlijke variabiliteit van de binnen-onderwerp. De variabiliteit van het scoren heerst vooral bij patiënten met onbepaalde schetsen en dit dient te worden verwerkt in diagnostische toepassing19. Factoren van variabiliteit omvatten acute bovenste luchtwegen infecties, uitgebreide neuspoliepen, voorafgaande sinus chirurgie en CF-gerelateerde ontstekingen, die de specificiteit en de gevoeligheid20,10afnemen. Bovendien, interpretatie van overtrekkingen kunnen verschillen tussen de lezers, hoewel deskundige lezers uitstekende Akkoordvan kwantitatieve scoren en interpretability in CF en niet-CF schetsen tonen, contrasteren met een aanzienlijke variabiliteit in de vertrouwen van de tracering-19.
Intrinsieke variabiliteit ten opzichte van belangrijke drempels
De fysiologische variabiliteit van de meting is zeer belangrijk, groot, zoals geïllustreerd in verschillende studies10, zoals het CFTR-gen therapie proeven die blijk gegeven van aanzienlijke variabiliteit in veranderingen in de totale vervoer chloride en amiloride variëren21,22. Transversale evaluatie suggereert dat nul Cl– plus isoproterenol reactie boven de drempel van -5 tot -7 mV is de licht-donkerscheiding tussen CF en niet-CF onderwerpen10.
Toch ontbreekt het aan duidelijke kennis over de omvang van de verandering van deze parameter vertegenwoordigt een effectieve CFTR-correctie in de fase-II proeven met ziekte therapieën te wijzigen. Om te beoordelen van individuele reactie, herhaalde tests controle van de reactie op een interventie mogelijk moet onderscheiden van belangrijke veranderingen van intrinsieke variabiliteit. Zeer belangrijk, moeten toekomstige langetermijnstudies met ziekte wijzigen van drugs aantonen dat de verbetering in CFTR functie met verbetering in klinisch relevante uitkomsten of surrogaat resultaten (zoals verbetering in FEV1) voor CF correleert ziekte. Immers, om een recente fase II Ivacaftor studie aangetoond gemarkeerd klinische profijt hebben ondanks een kleine verbetering in de chloride secretie23.
Dergelijke studies zullen helpen om vast te stellen als een cut-off waarde van verbetering in trans-epitheliale Cl–huidgeleiding mogelijk een surrogaat parameter voor klinische voordeel. Dit zou een belangrijke parameter voor het begeleiden van de ontwikkeling van CFTR therapieën te wijzigen.
Betekenis ten opzichte van bestaande methoden: zweet Test en intestinale huidige metingen (ICM)
Bij patiënten met ” twijfelachtige ” cystic fibrosis, beoordeeld door een intermediaire zweet Cl– concentratie tussen 30 en 60 mM, NPD samengestelde scores verstrekt een zeer gevoelig instrument om te diagnosticeren van patiënten zoveel ” CF-kans ” en ” CF-onwaarschijnlijk ”10 . Intestinale Stroommeting (ICM), waarin een ex vivo -meting van de netto Cl– stromen over de rectale epitheel, kunt ook bepaling van residuele CFTR-functie met een hoge gevoeligheid omdat CFTR is sterk uitgedrukt in dit epitheel.
Wijziging van het CFTR-functie door CFTR modulatoren, de relatie tussen deze verschillende CFTR biomerker veranderingen overweegt is op dit moment onduidelijk. Hoewel recente werk op basis van bepaald Ivacaftor dat NPD en zweet test zijn gecorreleerde4, het is nog niet opgericht als een meting in de luchtwegen is een betere voorspeller van respiratoire resultaat dan, bijvoorbeeld, het zweet testen24 , 25 of wijziging in de ICM. Bovendien, modifier drugs kunnen ook verschillen in hun specifieke efficacies van orgel. Met betrekking tot de NPD is het belangrijk op te merken dat veranderingen in basale PD en amiloride reactie expresvervoer nb+ , terwijl wijzigingen in 0 Cl– en de isoproterenol reactie expresvervoer Cl– . Het is nog te worden vastgesteld welke van deze is belangrijker voor de verbetering van de ziekte.
Toekomstige toepassing van deze techniek
Het gebruik van deze techniek wordt verwacht buiten het CF-veld. Omdat deze techniek uniek geschikt is om aan te tonen van de nb+ en Cl– ionkanaal, kan het worden toegepast om aan te tonen van de dysfunctie in ziekten van de luchtwegen met inbegrip van astma26, chronische bronchitis27, niet-CF Bronchiëctasie28 en terugkerende pancreatitis29. Daarnaast hebben aanpassingen van deze techniek is gebruikt in de lagere luchtwegen klem zitten (LAPD) om aan te tonen van de lagere luchtwegen gerichte CFTR disfunctie bij chronische obstructieve longziekte (COPD) patiënten met chronische bronchitis30.
NPD biedt een gevoelige in vivo biomarker van CFTR-functie, die kan worden gebruikt voor zowel de diagnose en, ook, voor proof-of-concept studies willen corrigeren CFTR en ENaC kanaal activiteit in translationeel onderzoek. Dit maakt van de longitudinale beoordelingvan trans-epitheliale functie en houdt belofte als een strategie voor gepersonaliseerde geneeskunde op maat van de meest efficiënte corrector voor elke patiënt met CF.
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dit onderzoek werd gesteund door de werkgroep voor CFTR-functie van de normalisatie Commissie (klinische Trials-netwerk, Europese Cystic Fibrosis samenleving) en de nationale middelen Center Working Group (Therapeutics Development Network, Cystic Fibrosis Stichting). Extra ondersteuning werd verstrekt door de Stichting CF (Clancy FY09 aan GMS) en NIH (DK072482 GMS te SMR).
Materials
| KD Scientific infusion pump (or equivalent – such as programmable infusion pumps provided by the institution/hospital) | Fisher Scientific | ||
| Powerlab 4/30 | AD Instruments | ||
| BMA-200 AC/DC portable bioamplifier | AD Instruments | ||
| IS0-Z isolation headstage for BMA-200 | AD Instruments | ||
| Windows compatible PC – Minimum requirements of Windows XP or higher | Various | ||
| AD Instruments software: GLP Client V6 (Windows) or higher | AD Instruments | ||
| ECG electrode (ground for study subject) | Hospital standard | ||
| 2 mini calomel reference electrodes | Fisher Scientific | 13-620-79 | |
| Potassium Chloride KCl, Granular – USP, formula weight 76, qty: 500 gm | Spectrum | ||
| Sterile container (such as specimen collection container , or similar) to be used for KCl calomel bath, with holes cut in lid to hold electrodes in place. (If not provided by electrode manufacturer.) | Hospital standard | ||
| 2 electrodes: Ag/AgCl 8 mm TP electrode | BIOPAC Systems | UNSHLD-EL258 | |
| 2 Ag/AgCl electrodes, B0194, plug 4 mm | SLE Instruments | ||
| Signacreme® Conductive Electrode Cream | Fisher Scientific | Parker Labs ref # 17-05 | |
| Skin abrasion device | PROMED Feeling | Ref 374901 | |
| Hi Di 541 M, Diamond tipped dental burrs | Ash Instruments | ||
| Becton Dickinson PE 50 tubing | Fisher Scientific | 427411 | |
| Becton Dickinson PE 90 tubing | Fisher Scientific | 427421 | |
| Silastic tubing, 0.062” ID, 0.095” OD | Fisher Scientific | 508-007 | |
| Micropore Surgical Tape Paper (25 mm x 9.1 m) | 3M | 1530-1 | |
| Marquat double lumen catheter Length: 80 cm; Outer diameter: 2.5 mm; Internal diameter of the channels: 0.8 mm; Distance of the side-holes to the tip: 2 mm. EU label Agreement for NPD: I0202US | Marquat | I0202US | |
| 1" X 10 yards silk tape | 3M Durapore | 1538-1 | |
| IV extension tubing (30", 50/box) | International Limited | IMN30 | |
| Three-way stopcock (50/box) | Medex | MX5311L | |
| Sterile syringe filters (ANOTOP 25 sterile 50pk; 0.22-micron or smaller filters; or equivalent) | Fisher Scientific | 09-926-7 | |
| Becton Dickinson Intramedic Luer stub adapter (20G, for connection to PE90 if using nasal catheter produced at study site) | Fisher Scientific | 427564 | |
| Becton Dickinson 23G, 0.75” Vacutainer (“butterfly”) needles (0.6 x 19 mm; 50U/box) (for connection to PE50) if using nasal catheter produced at study site) | Fisher Scientific | 367283 | |
| Becton Dickinson Syringe 60 ml without needle Luer-Lok tip (40/Box) | Fisher Scientific | 309653 | |
| Becton Dickinson Syringe 10 ml without needle Luer-Lok tip (100/Box | Fisher Scientific | 309604 | |
| Single use sterile wipes (per institutional availability) | Hospital standard | ||
| 70% EtOH (1 pint), Aaper Alcohol and Chemical Co. catalog number NC9274019 (or equivalent) | Fisher Scientific | ||
| Corning single use sterile bottle-top filters, 0.22 μm pore size (0.15 – 1.0 litre volumes acceptable) | Fisher Scientific | 430624 | |
| Buffer Cert Ph 10.00 (1L Sn04332) – for pH meter calibration | Fisher Scientific | ||
| Buffer Cert Ph 4.00 (1L Sn04327) – for pH meter calibration | Fisher Scientific | ||
| Buffer Cert Ph 7.00 (500 ml Sn04328) – for pH meter calibration | Fisher Scientific | ||
| Disposable underpads (Blue Pads; 23"X36" 150/Box; or equivalent per hospital standard) | SureCare | ||
| 23G, 0.75” Vacutainer “butterfly” needles (0.6×19 mm; 50U/box) | Becton Dickinson | 367283 | |
| Difco Laboratories Agar (Noble 100g 0142-15-2; or equivalent) | Fisher Scientific | ||
| Welch Allyn Rhinoscope 71000-C (or equivalent) | Fisher Scientific | ||
| Welch Allyn Convertible Handle Battery 72300 (or equivalent) OR Otoscope with battery | Fisher Scientific | ||
| Head and chin rest (or equivalent; optional) | Richmond Products, Inc | 629R | |
| Static Dissipative Anti-Fatigue Matting (or equivalent) | Fisher Scientific | No. 791 | |
| REAGENTS FOR SOLUTIONS MIXED ON SITE | |||
| Sodium Chloride, Granular – USP NaCl | Spectrum | Formula Weight: 58; Size: 500 gm | |
| Calcium Chloride CaCl2•2H2O – USP | Spectrum | Formula Weight: 147; Size: 500 gm | |
| Magnesium Chloride Hexahydrate Crystal, MgCl2•6H2O – USP | Spectrum | Formula Weight: 203; Size: 500 gm | |
| Potassium Phosphate Dibasic, Anhydrous, Granular, K2HPO4 – USP | Spectrum | Formula Weight: 174; Size: 500 gm | |
| Potassium Phosphate Monobasic Crystals – NF (KH2PO4) | Spectrum | Formula Weight: 136; Size: 500 gm | |
| Sodium Gluconate- USP (monosodium salt) | Spectrum | Formula Weight: 218; Size: 500 gm | |
| Calcium Gluconate – USP (Anhydrous Powder) | Spectrum | Formula Weight: 430; Size: 500 gm | |
| Potassium Gluconate- USP (Anhydrous) | Spectrum | Formula Weight: 234; Size: 500 gm | |
| Magnesium Sulfate Heptahydrate – USP MgSO4•7H2O | Spectrum | Formula Weight: 246; Size: 500 gm | |
| Amiloride HCl – USP | Spectrum | Formula Weight: 302; Size: 5gm | |
| Adenosine 5’-Triphosphate (ATP) (Disodium salt) | Spectrum | Formula Weight: 551; Size: 5gm | |
| Magnesium Chloride, Hexahydrate, Crystal – USP MgCl2•6H2O | Spectrum | Formula Weight: 203; Size: 500 gm | |
| Double-distilled water (ddH2O) | Hospital Pharmacy | Formula Weight: NA; Size: 1 L | |
| Isoproterenol HCL Injection – USP 1 mg/5 ml ampule | Hospital Pharmacy | Formula Weight: 248; Size: single use | |
| Ringers Injection, USP or Ringers Irrigation | Hospital Pharmacy | Formula Weight: NA; Size: 5 L |
References
- Rosenstein, B. What is a Cystic Fibrosis Diagnosis?. Clinics in Chest Medicine. 19, 423-441 (1998).
- Rosenstein, B., Cutting, G. R. The Diagnosis of Cystic Fibrosis: A Consensus Statement: Cystic Fibrosis Foundation Consensus Panel. The Journal of Pediatrics. 132, 589-595 (1998).
- Farrell, P. M., et al. Diagnosis of Cystic Fibrosis: Consensus Guidelines from the Cystic Fibrosis Foundation. The Journal of Pediatrics. 181, S4-S15 (2017).
- Mesbahi, M., et al. Changes of CFTR functional measurements and clinical improvements in cystic fibrosis patients with non-p.Gly551Asp gating mutations treated with ivacaftor. Journal of Cystic Fibrosis. 16, 45-48 (2017).
- Accurso, F., et al. Sweat chloride as a biomarker of CFTR activity: proof of concept and ivacaftor clinical trial data. Journal of Cystic Fibrosis. 13 (2), 139-147 (2014).
- Accurso, F., et al. Effect of VX-770 in Persons with Cystic Fibrosis and the G551D-CFTR Mutation. New England Journal of Medicine. 363, 1991-2003 (2010).
- Sermet, I., et al. Measurement of nasal potential difference in young children with an equivocal sweat test following newborn screening for cystic fibrosis. Thorax. 65 (6), 539-544 (2010).
- Wilschanski, M., et al. Mutations in the Cystic Fibrosis Transmembrane Regulator Gene and In vivo Transepithelial Potentials. American Journal of Respiratory and Critical Care Medicine. 174 (7), 787794 (2006).
- Sermet-Gaudelus, I., et al. Clinical Phenotype and Genotype of Children with Borderline Sweat Test and Abnormal Nasal Epithelial Chloride Transport. American Journal of Respiratory and Critical Care Medicine. 182 (7), 929-936 (2010).
- De Boeck, K., et al. CFTR biomarkers: time for promotion to surrogate endpoint?. European Respiratory Journal. 14, 38 (2013).
- US CFF-TDN (Cystic Fibrosis Foundation-Therapeutics Development Network) and the ECFS-CTN (European Cystic Fibrosis Society- Clinical Trials Network). Standard Operating Procedure 528.01. Standardized Measurement of Nasal Membrane Transepithelial Potential Difference (NPD). , (2014).
- Knowles, M., et al. Increased bioelectric potential difference across respiratory epithelia in CF. New England Journal of Medicine. 305 (25), 1489-1493 (1981).
- Solomon, G. M., et al. An international Randomised Multicentre Comparison of NPD Techniques. Chest. 138, 919-928 (2010).
- Sermet, I., et al. Chloride Transport in Nasal Ciliated Cells of Cystic Fibrosis Heterozygotes. American Journal of Respiratory and Critical Care Medicine. 171, 1026-1031 (2005).
- Naehrlich, L., et al. Nasal potential difference measurements in diagnosis of cystic fibrosis: an international survey. Journal of Cystic Fibrosis. 13 (1), 24-28 (2014).
- Vermeulen, F., et al. Nasal potential measurements on the nasal floor and under the inferior turbinate: Does it matter?. Pediatric Pulmonology. 46 (2), 145-152 (2011).
- Bronsveld, I., et al. Influence of perfusate temperature on nasal potential difference. European Respiratory Journal. 42, 389-393 (2013).
- Boyle, M., et al. A multi-center study on the effect of solution temperature on nasal potential difference measurements. Chest. 124 (2), 482-489 (2003).
- Solomon, G. M., et al. A Multiple Reader Scoring System for Nasal Potential Difference Parameters. Journal of Cystic Fibrosis. 16 (5), 573-578 (2017).
- Beekman, J. M., et al. CFTR functional measurements in human models for diagnosis, prognosis and personalized therapy: Report on the pre-conference meeting to the 11th ECFS Basic Science Conference, Malta, 26-29 March 2014. Journal of Cystic Fibrosis. 13, 363-372 (2014).
- Accurso, F., et al. Effect of VX-770 in persons with cystic fibrosis and the G551D-CFTR mutation. New England Journal of Medicine. 363, 1991-2003 (2010).
- Wilschanski, M., et al. Chronic ataluren (PTC124) treatment of nonsense mutation cystic fibrosis. European Respiratory Journal. 38, 59-69 (2011).
- Accurso, F., et al. Sweat Chloride as a biomarker of CFTR activity: proof of concept and Ivacaftor clinical trial data. Journal of Cystic Fibrosis. 13 (2), 139-147 (2014).
- Rowe, S., et al. Clinical Mechanism of the Cystic Fibrosis Transmembrane Conductance Regulator Potentiator Ivacaftor in G551D-mediated Cystic Fibrosis. American Journal of Respiratory and Critical Care Medicine. 190 (2), 175-184 (2014).
- Boyle, M., et al. A CFTR corrector lumacaftor and a CFTR potentiator (ivacaftor) for treatment of patients with cystic fibrosis who have a phe508del CFTR mutation: a phase 2 randomised controlled trial. The Lancet Respiratory Medicine. 2 (7), 527-538 (2014).
- Schulz, A., Tummler, B. Non-allergic asthma as a CFTR-related disorder. Journal of Cystic Fibrosis. 15 (5), 641-644 (2016).
- Sloane, P. A., et al. A pharmacologic approach to acquired cystic fibrosis transmembrane conductance regulator dysfunction in smoking related lung disease. PLoS One. 7 (6), e39809 (2012).
- Bienvenu, T., et al. Cystic Fibrosis Transmembrane Conductance Regulator Channel Dysfunction in Non-Cystic Fibrosis Bronchiectasis. American Journal of Respiratory and Critical Care Medicine. 181 (10), 1078-1083 (2010).
- Werlin, S., et al. Genetic and electrophysiological characteristics of recurrent acute pancreatitis. Journal of Pediatric Gastroenterology and Nutrition. 60 (5), 675-679 (2015).
- Dransfield, M. T., et al. Acquired Cystic Fibrosis Transmembrane Conductance Regulator Dysfunction in the Lower Airways in COPD. Chest. 144 (2), 498-506 (2013).

