Sensorer til at registrere Protease aktivitet In Vivo for invasiv diagnostik
Summary
Proteaser er stramt regulerede enzymer involveret i grundlæggende biologiske processer og dysregulated protease aktivitet drev progression af komplekse sygdomme som kræft. Denne metode mål er at skabe sensorer, der måler protease aktivitet i vivo ved at producere en spaltning signal, der kan spores fra værten urin og diskriminerer sygdom.
Abstract
Proteaser er multi-funktionelle enzymer, der specialiserer sig i hydrolyse af peptidbindinger og styre bred biologiske processer herunder homøostase og allostasis. Desuden dysregulated protease aktivitet drev patogenese og er en funktionel biomarkør af sygdomme såsom kræft; Derfor kan evnen til at opdage protease aktivitet i vivo give klinisk relevante oplysninger for biomedicinsk diagnostik. Målet med denne protokol er at skabe sensorer, der sonden for protease aktivitet i vivo ved at producere en kvantificerbar signal i urinen. Disse protease sensorer består af to komponenter: en nanopartikel og substrat. Nanopartikel funktioner til at øge omsætning half-life og substrat levering til målwebsteder sygdom. Underlaget er en kort peptid sekvens (6-8 AA), som er designet til at være specifikke for et mål protease eller en gruppe af proteaser. Underlaget er konjugeret til overfladen af nanopartikler og afsluttes af en reporter, såsom fluorescerende markør, for afsløring. Som dysregulated proteaser kløver peptid substrat, filtreret reporter i urin for kvantificering som en biomarkør af protease aktivitet. Heri beskriver vi opførelse af en nanosensor for matrix metalloproteinase 9 (MMP9), som er forbundet med tumor progression og metastase, til påvisning af kolorektal cancer i en musemodel.
Introduction
Proteaser er multi-funktionelle enzymer, der specialiserer sig i hydrolyse af peptidbindinger og har betydelig kontrol over mange biologiske processer, herunder homøostase, allostasis og sygdom1. En meditativ tilstand protease aktivitet er blevet korreleret til en lang række sygdomme, herunder kræft og hjerte-kar-sygdom, hvilket gør proteaser attraktive kandidater til udvikling i kliniske biomarkører2,3. Derudover er protease aktivitet funktionelt forbundet med særskilte pathogeneses, patientens resultater og prognosen for sygdommen4. Bredt, biosensorer er udviklet til at registrere forskellige biologiske fænomener og sygdomme som kræft, neurodegenerativ sygdom og elektron overførsel behandler5,6,7,8 , 9. mere specifikt substrat-baserede protease sensorer er blevet udviklet til at opdage protease aktivitet, og omfatter fluorogenic sonder til diagnostic imaging10 og brændselsfremstilling mærket peptid substrater for in vitro påvisning af massespektrometri11. Derudover er blevet udviklet aktivitetsbaseret sonder, der indeholder substrat-lignende regioner, der binder eller ændre target protease12. Med denne metode, er målet protease uigenkaldeligt hæmmet når det aktive site er ændret, og analyse kræver høst af væv, som begrænser i vivo applikationer. Det er dog vigtigt at fornemme protease aktivitet i vivo, fordi regulering af protease aktivitet er stærkt afhængige af konteksten af andre biologiske aktiviteter såsom tilstedeværelsen af endogene hæmmere.
Målet med dette arbejde er at beskrive formuleringen af aktivitetsbaseret sensorer, der registrerer protease aktivitet i vivo ved at producere en målbar signal i urinen. Denne platform er brugt som en noninvasiv diagnostiske for at diskriminere komplekse sygdomme såsom kræft ved hjælp af dysregulated protease aktivitet som en funktionel biomarkør. Vores nanosensor platform består af jernoxid nanopartikler (IONP)-konjugeret med protease substrater. Disse substrater er afbrudt af en fluorescerende reporter, der frigives når proteaser kløver substratet. Disse IONPs cirkulerer i vivo, lokalisere til sygdom websteder og udsætte substrater til aktiv sygdom-associerede proteaser. Efter kløvningen, fluorescerende journalister er frigivet, og på grund af deres lille størrelse, er filtreret i urin, mens uncleaved substrater på IONP forblive i kroppen. Derfor, en stigning i protease aktiviteter i vivo vil resultere i højere koncentrationer af reporter i urinen (figur 1). Da vores platform er en urintest, ingen billedbehandling platform er påkrævet og diagnosesignaler er beriget med urin.
Denne platform kan være manipuleret til at detektere en række sygdomme, herunder kræft, fibrose og trombose13,14. Her beskriver vi design af sensorer til at registrere stigninger i Matrix metallopeptidase 9 (MMP9) aktivitet som en biomarkør for kolorektal cancer. Kolorektal cancer er den næststørste årsag til kræft død i USA, med en anslået 136,800 nye tilfælde og 50,300 dødsfald i 2014 alene15. Kolorektal tumorceller producerer MMP9, som har vist sig at drive maligne progression samt matrix nedbrydning og metastase16. Desuden, identificeret vi en egnet peptid substrat (PLGVRGK) for MMP9 fra litteratur17. Denne platform kan anvendes til tidlig kræft opdagelse og lavpris-punkt af care diagnostics13,14,18,19,20,21.
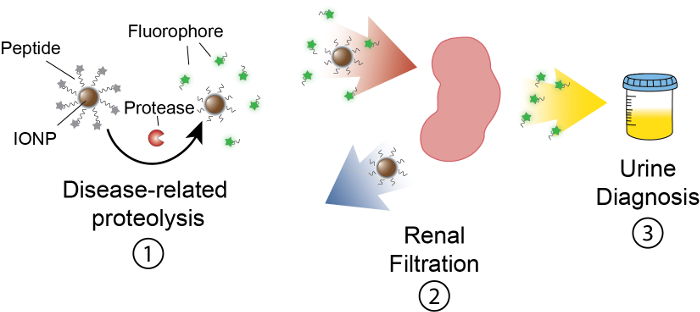
Figur 1: skematisk af Nanosensor aktivitet In vivo. Sensorer cirkulerer gennem kroppen og lokalisere til steder af sygdommen. Derefter, sygdomsrelaterede proteaser kløver peptid substrater IONPs har fremlagt. Størrelsen af kløvet fragmenter tillader renal clearance, forårsager dem til at lokalisere i urinen. Når dyret tisser, kan disse peptid fragmenter analyseres af deres reporter molekyle. Venligst klik her for at se en større version af dette tal.
Protocol
Representative Results
Discussion
I denne metode beskrives udviklingen af aktivitetsbaseret sensorer bestående af protease substrater konjugeret med en nanopartikel kerne. Tilfælde af proteolytiske kavalergang er døbt “farmakokinetiske switch”, fordi kløvet peptid produkter er mindre end renale filtration-størrelsesgrænsen 5 nm23 og filter ind i urinen til at producere en noninvasiv signal. Derfor er det vigtigt at bruge nanopartikler eller luftfartsselskaber med en hydrodynamiske radius, der er større end 5 nm, som noget m…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Dette arbejde blev finansieret af en NIH Directors nye Innovator Award (pris nr. DP2HD091793). Q.D.M. understøttes af NSF Graduate Research stipendier Program (Grant nr. DGE-1650044). B.A.H er understøttet af nationale institutter for sundhed GT BioMAT uddannelse tildeling under Award antallet 5T32EB006343 samt Georgia Tech President’s Fellowship. G.A.K. holder en karriere Award på den videnskabelige Interface fra fondens Burroughs velkommen. Indholdet er udelukkende ansvarlig for forfattere og repræsenterer ikke nødvendigvis de officielle synspunkter af National Institutes of Health.
Materials
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
References
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).

