Nanosensorer att upptäcka proteas aktivitet In Vivo för noninvasiv diagnostik
Summary
Proteaser är hårt reglerade enzymer som är involverade i grundläggande biologiska processer och dysreglerad proteas aktivitet enheter progression av komplexa sjukdomar såsom cancer. Denna metods mål är att skapa nanosensorer som mäter proteas aktivitet i vivo genom att producera en klyvning-signal som är detekterbar från värd urin och diskriminerar sjukdom.
Abstract
Proteaser är multifunktionella enzymer som är specialiserade på hydrolys av peptidbindningar och styra bred biologiska processer inklusive homeostas och allostasis. Dessutom dysreglerad proteas aktivitet driver patogenes och är en funktionell biomarkör för sjukdomar som cancer; Därför kan förmågan att upptäcka proteas aktivitet i vivo ge kliniskt relevant information för biomedicinsk diagnostik. Målet med detta protokoll är att skapa nanosensorer som sond för proteas aktivitet i vivo genom att producera en mätbar signal i urinen. Dessa proteas nanosensorer består av två komponenter: en nanopartikel och substrat. Funktionerna nanopartiklar att öka omsättning halveringstid och substrat leveransen till målet sjukdom platser. Substratet är en sekvens med kort peptid (6-8 AA), som syftar till att vara specifika för en target proteashämmare eller grupp av proteaser. Substratet är konjugerat med ytan av nanopartikelportföljen och avslutas av en reporter, såsom en fluorescerande markör, för upptäckt. När dysreglerad proteaser klyva peptid substratet, filtreras reportern i urin för kvantifiering som en biomarkör av proteas aktivitet. Detta dokument beskriver vi byggandet av en nanosensor för matrix metalloproteinas 9 (MMP9), som är associerad med tumör progression och metastasering, för upptäckt av kolorektal cancer i en musmodell.
Introduction
Proteaser är multifunktionella enzymer som är specialiserade på hydrolys av peptidbindningar och har betydande kontroll över många biologiska processer, inklusive homeostasis, allostasis och sjukdom1. Ett förändrat tillstånd av proteas aktivitet har korrelerats till en mängd olika sjukdomar, däribland cancer och hjärt-kärlsjukdom, att göra proteaser attraktiva kandidater för utveckling till kliniska biomarkörer2,3. Dessutom är proteas aktivitet funktionellt kopplade till distinkta vägarna, behandlingsresultat och prognos av sjukdom4. Broady, biosensorer har utvecklats för att upptäcka olika biologiska fenomen och sjukdomar, såsom cancer, neurodegenerativa sjukdomar och elektronöverföring bearbetar5,6,7,8 , 9. mer specifikt substrat-baserade proteas sensorer har utvecklats för att upptäcka proteas aktivitet, och inkluderar fluorogenic sonder för diagnostisk avbildning10 och isotopically märkt peptid substrat för in vitro identifiering av masspektrometri11. Activity based sonder har dessutom utvecklats, som innehåller substrat-liknande regioner som binder eller ändra målet proteas12. Med den här metoden hämmas irreversibelt i målet proteas när den aktiva platsen ändras, och analysen kräver skörd av vävnad, vilket begränsar i vivo applikationer. Det är dock viktigt att känna proteas aktivitet i vivo, eftersom regleringen av proteas aktivitet är starkt beroende av ramen för andra biologiska aktiviteter såsom förekomsten av endogen hämmare.
Målet med detta arbete är att beskriva utformningen av verksamhetsbaserad nanosensorer som upptäcker proteas aktivitet i vivo genom att producera en mätbar signal i urinen. Denna plattform används som en icke-invasiv diagnostik för att diskriminera komplexa sjukdomar såsom cancer genom att använda dysreglerad proteas aktivitet som en funktionell biomarkör. Vår nanosensor plattform består av järnoxid nanopartiklar (IONP) konjugerat med proteas substrat. Dessa substrat avslutas av en fluorescerande reporter som frigörs när proteaser klyva substratet. Dessa IONPs cirkulera i vivo, lokalisera till sjukdom webbplatser och exponera substrat till aktiva sjukdomsassocierade proteaser. Efter klyvning, fluorescerande reportrar är släppt och på grund av sin storlek, filtreras i urin, medan uncleaved substrat på IONP kvar i kroppen. Därför kommer att en ökning av proteashämmare aktiviteter i vivo resultera i högre koncentrationer av reporter i urinen (figur 1). Eftersom vår plattform är ett urinprov, ingen tänkbar plattform krävs och diagnossignaler är berikad med urin.
Denna plattform kan vara konstruerad för att upptäcka en rad sjukdomar inklusive cancer, fibros och trombos13,14. Här beskriver vi utformningen av nanosensorer att upptäcka förhöjningar i Matrix metallopeptidase 9 (MMP9) verksamhet som en biomarkör för kolorektal cancer. Kolorektal cancer är den näst vanligaste orsaken till dödsfall i cancer i USA, med uppskattningsvis 136.800 nya fall och 50,300 dödsfall i 2014 ensam15. Kolorektal tumörceller producerar MMP9, som har visat att köra malign progression, matrix nedbrytning, samt metastas16. Dessutom har vi identifierat ett passande peptid substrat (PLGVRGK) för MMP9 från litteratur17. Denna plattform kan användas för tidig upptäckt av cancer och låg kostnad point-of-care diagnostics13,14,18,19,20,21.
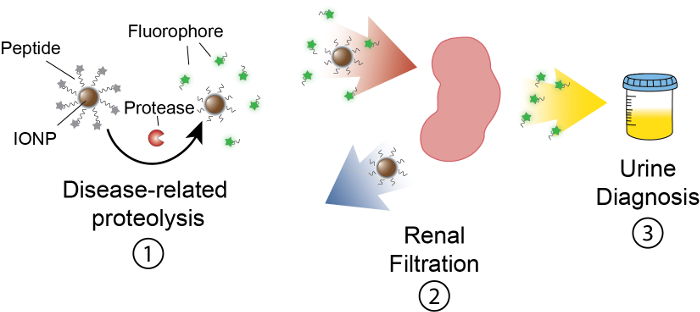
Figur 1: Schematisk av Nanosensor aktivitet i vivo. Nanosensorer cirkulerar genom kroppen och lokalisera till platser av sjukdom. Sedan klyva sjukdomsrelaterade proteaser peptid substrat presenteras av IONPs. Storleken på klyvs fragment möjliggör renalt clearance, vilket får dem att lokalisera i urinen. Efter djuret kissar, kan dessa peptidfragment analyseras av deras reporter molekyl. Klicka här för att se en större version av denna siffra.
Protocol
Representative Results
Discussion
Denna metod beskriver utvecklingen av verksamhetsbaserad nanosensorer bestående av proteashämmare substrat konjugerat med en nanopartikel kärna. Händelse av proteolytisk klyvning är dubbad ”farmakokinetiska switch”, eftersom klyvs peptid produkter är mindre än nedsatt filtration storleksgräns 5 nm23 och filter i urinen för att producera en noninvasiv signal. Därför är det viktigt att använda nanopartiklar eller bärare med en hydrodynamiska radien som är större än 5 nm, som nå…
Disclosures
The authors have nothing to disclose.
Acknowledgements
Detta arbete finansierades av en NIH-regissörens nya innovatör Award (Award No. DP2HD091793). Q.D.M. stöds av NSF forskning stipendier forskarutbildningen (Grant nr. DGE-1650044). B.A.H stöds av nationella institut för hälsa GT BioMAT utbildning bidraget under Award antal 5T32EB006343 samt Georgia Tech presidentens Fellowship. G.A.K. håller en karriär Award vid vetenskapliga gränssnittet från Burroughs Välkommen fonden. Innehållet ansvarar enbart för författarna och representerar inte nödvändigtvis officiella ståndpunkter av National Institutes of Health.
Materials
| 0.2 µm syringe filters | VWR | 4652 | |
| 18G needle | VWR | 89134-024 | |
| 15 mL conicals | VWR | 89039-670 | |
| 250 mL Erlenmeyer flask | VWR | 89000-362 | |
| Stir bar | VWR | 58949-006 | |
| Hot Plate/Magnetic Stirrer | VWR | 97042-634 | |
| Glacial acetic acid | VWR | 97064-482 | |
| Albumin from Bovine Serum (BSA) | Thermo Fisher | A13100 | |
| Iron (III) chloride hexahydrate | Sigma | 236489 | |
| Iron (II) chloride tetrahydrate | Sigma | 44939 | |
| Epichlorohydrin | Sigma | 45340-500ML-F | |
| DMF | Sigma | D4551 | |
| Ammonium Hydroxide | Sigma | 320145-500ML | |
| Sodium Hydroxide pellets | Sigma | 221465-500G | |
| EDTA | Sigma | E9884 | |
| Sodium Borate | Sigma | B9876 | |
| L-Cysteine | Sigma | 168149-100G | |
| Tris-HCl | Sigma | T5941 | |
| Tris base | Sigma | T6066 | |
| PBS tablets | Sigma | P4417 | |
| Dextran | Pharmacosmos | 5510 0020 9006 | |
| Amicon 15 mL 10k filters, 24 pk | Millipore | UFC901024 | |
| Amicon 15 mL 30k filters, 24 pk | Millipore | UFC903024 | |
| Amicon 15 mL 100k filters, 24 pk | Millipore | UFC910024 | |
| Zetasizer Nano ZS | Malvern Panalytical | NanoZS | |
| Slide-A-Lyzer Dialysis Cassette | LifeTech | 66130 | |
| Dynabeads MyOne Tosylactivated | LifeTech | 65501 | |
| SIA | Life Tech | 22349 | |
| PEG 20k | Laysan Bio | MPEG-SH-20K-1g | |
| Fluorescein Antibody [2A3] | GeneTex | GTX10257 | |
| Hiload 16/600 superdex 200 | GE Healthcare | 45-002-490 | |
| Plate Reader | Fisher | BTCYT5M | |
| BD Insulin Syringes | Fisher | NC0872854 |
References
- Lopez-Otin, C., Bond, J. S. Proteases: Multifunctional enzymes in life and disease. Journal of Biological Chemistry. 283 (45), 30433-30437 (2008).
- Hua, Y., Nair, S. Proteases in cardiometabolic diseases: Pathophysiology, molecular mechanisms and clinical applications. Biochimica et Biophysica Acta. 1852 (2), 195-208 (2015).
- Koblinski, J. E., Ahram, M., Sloane, B. F. Unraveling the role of proteases in cancer. Clinica Chimica Acta. 291 (2), 113-135 (2000).
- Lilja, H., Vickers, A., Scardino, P. Measurements of proteases or protease system components in blood to enhance prediction of disease risk or outcome in possible cancer. Journal of Clinical Oncology. 25 (4), 347-348 (2007).
- Jin, H., et al. Flexible surface acoustic wave resonators built on disposable plastic film for electronics and lab-on-a-chip applications. Scientific Reports. 3, 2140 (2013).
- Ma, W., Liu, H. -. T., Long, Y. -. T. Monitoring dopamine quinone-induced dopaminergic neurotoxicity using dopamine functionalized quantum dots. ACS Applied Materials & Interfaces. 7 (26), 14352-14358 (2015).
- Zhang, W. -. H., Ma, W., Long, Y. -. T. Redox-mediated indirect fluorescence immunoassay for the detection of disease biomarkers using dopamine-functionalized quantum dots. Analytical Chemistry. 88 (10), 5131-5136 (2016).
- Ma, W., et al. Investigating electron-transfer processes using a biomimetic hybrid bilayer membrane system. Nature Protocols. 8 (3), 439-450 (2013).
- Holt, B. A., et al. Fc microparticles can modulate the physical extent and magnitude of complement activity. Biomaterials science . 5, 463-474 (2017).
- Edgington, L. E., Verdoes, M., Bogyo, M. Functional imaging of proteases: Recent advances in the design and application of substrate-based and activity-based probes. Current Opinion in Chemical Biology. 15 (6), 798-805 (2011).
- Kleifeld, O., et al. Identifying and quantifying proteolytic events and the natural N terminome by terminal amine isotopic labeling of substrates. Nature Protocols. 6 (10), 1578-1611 (2011).
- Sanman, L. E., Bogyo, M. Activity-based profiling of proteases. Annual Review of Biochemistry. 83 (1), 249-273 (2014).
- Kwong, G. A., et al. Mass-encoded synthetic biomarkers for multiplexed urinary monitoring of disease. Nature Biotechnology. 31 (1), 63-70 (2013).
- Dudani, J. S., Buss, C. G., Akana, R. T. K., Kwong, G. A., Bhatia, S. N. Sustained-release synthetic biomarkers for monitoring thrombosis and inflammation using point-of-care compatible readouts. Advanced Functional Materials. 26 (17), 2919-2928 (2016).
- Meester, R. G. S., et al. Public health impact of achieving 80% colorectal cancer screening rates in the United States by 2018. Cancer. 121 (13), 2281-2285 (2015).
- Mehner, C., et al. Tumor cell-produced matrix metalloproteinase 9 (MMP-9) drives malignant progression and metastasis of basal-like triple negative breast cancer. Oncotarget. 5 (9), 2736-2749 (2014).
- Bremer, C., Tung, C. H., Weissleder, R. In vivo molecular target assessment of matrix metalloproteinase inhibition. Nature Medicine. 7 (6), 743-748 (2001).
- Warren, A. D., et al. Disease detection by ultrasensitive quantification of microdosed synthetic urinary biomarkers. Journal of the American Chemical Society. 136 (39), 13709-13714 (2014).
- Warren, A. D., Kwong, G. A., Wood, D. K., Lin, K. Y., Bhatia, S. N. Point-of-care diagnostics for noncommunicable diseases using synthetic urinary biomarkers and paper microfluidics. Proceedings of the National Academy of Sciences of the United States of America. 111 (10), 3671-3676 (2014).
- Kwong, G. A., et al. Mathematical framework for activity-based cancer biomarkers. Proceedings of the National Academy of Sciences of the United States of America. 112 (41), 12627-12632 (2015).
- Dudani, J. S., Jain, P. K., Kwong, G. A., Stevens, K. R., Bhatia, S. N. Photoactivated spatiotemporally-responsive nanosensors of in vivo protease activity. ACS Nano. 9 (12), 11708-11717 (2015).
- Palmacci, S., Josephson, L. Synthesis of polysaccharide covered superparamagnetic oxide colloids. US patent. , (1991).
- Choi, H. S., et al. Renal clearance of nanoparticles. Nature Biotechnology. 25 (10), 1165-1170 (2007).
- Harris, T. J., von Maltzahn, G., Derfus, A. M., Ruoslahti, E., Bhatia, S. N. Proteolytic actuation of nanoparticle self-assembly. Angewandte Chemie (International edition in English). 45 (19), 3161-3165 (2006).
- Kwon, E. J., Dudani, J. S., Bhatia, S. N. Ultrasensitive tumour-penetrating nanosensors of protease activity. Nature Biomedical Engineering. 1, (2017).
- Villanueva, J., Nazarian, A., Lawlor, K., Tempst, P. Monitoring Peptidase activities in complex proteomes by MALDI-TOF mass spectrometry. Nature Protocols. 4 (8), 1167-1183 (2009).
- Villanueva, J., et al. Differential exoprotease activities confer tumor-specific serum peptidome patterns. The Journal of Clinical Investigation. 116 (1), 271-284 (2006).

